Резюме
Заден план
Проучванията за асоцииране в целия геном показват, че алелите на риска върху локуса на хромозома 9p21.3 са свързани с увеличаване на риска от сърдечно-съдови заболявания (ССЗ). Няколко епидемиологични проучвания са установили, че метаболитният синдром (MetS) е свързан със ССЗ. Диетичните антиоксиданти също са показали, че имат потенциални благоприятни ефекти върху превенцията на MetS. Това проучване изследва взаимодействията между rs1333048 генотипове на 9p21 генетичен регион и общ антиоксидантен капацитет (TAC) спрямо шансовете на MetS.
Методи
263 възрастни от Техерани са били включени в това проучване на напречното сечение. MetS беше дефиниран съгласно ATPIII. Диетичният прием се оценява ежедневно, като се използва FFQ със 147 елемента. Диетичният ОДУ е оценен според базата данни на Министерството на земеделието на САЩ за капацитет на абсорбция на кислородни радикали (ORAC). За анализ на тялото е използван метод за анализ на биоелектричен импеданс и rs1333048 са генотипизирани чрез метод за полиморфизъм на рестрикционни фрагменти. Участниците бяха категоризирани в три групи въз основа на rs1333048 генотипове.
Резултати
Резултатите показват, че разпространението на С алел е 52,85% и Алел 47,15%. След корекция на променливата на объркване, това проучване демонстрира взаимодействие между генотипа на АА и високата способност за абсорбция на лиофилен кислороден радикал (L-ORAC) и високия капацитет на абсорбция на хидрофилен кислороден радикал (H-ORAC) при ниски коефициенти на MetS (OR = 0.24, 95 % CI = 0,06–0,94, P за взаимодействие = 0,04, OR = 0,26, 95% CI = 0,06–0,99, P за взаимодействие = 0,04). Също така, нашият резултат показва, че не е имало взаимодействие между генотипа на АА и високия общ капацитет на абсорбция на кислородни радикали (T-ORAC) и общия прием на феноли при намалени шансове на MetS (OR = 0.07, 95% CI = 0.07–1.10, P за взаимодействие = 0,07, OR = 0,58, 95% CI = 0,16–2,07, P за взаимодействие = 0,40) съответно.
Заключение
Резултатите от настоящото проучване показват, че високият прием на L-ORAC и високият H-ORAC могат да променят повишените шансове на MetS в генотипа AA на rs1333048 върху генетичния локус 9p21.
Заден план
Метаболитният синдром (MetS) е нарастващ проблем на общественото здраве в световен мащаб, който увеличава риска от развитие и прогресиране на сърдечно-съдови заболявания (ССЗ) [1]. Показано е, че MetS и неговите компоненти, включително хипергликемия, хипертония, дислипидемия и коремно затлъстяване, са силно свързани с оксидативен стрес; състояние, което се характеризира с прекомерно производство на реактивни кислородни видове (ROS) и/или липидна пероксидация, както и намалена антиоксидантна защита. Предишни проучвания показват повишено производство на оксидантни биомаркери и намалени нива на антиоксидантна защита при пациенти с MetS. Нарушенията на оксидативния стрес или промененият антиоксидантен статус се предлагат като ефективни ключове при появата на някои хронични заболявания като ССЗ, MetS [2]. Освен това оксидативният стрес изглежда е свързан с развитието на хронични сърдечни заболявания (ИБС) и метаболитни усложнения сред пациентите с MetS [3]. Повишеният оксидативен стрес лежи в основата на патофизиологията на хипертонията [4] и ССЗ [5], като пряко засяга клетките на съдовата стена и намалява секрецията на инсулин от β клетките на панкреаса [6].
Докладите показват, че диетичните антиоксиданти могат да предпазят от окислително увреждане и свързаните с това възпалителни усложнения [7]. По този начин високият прием на антиоксиданти е свързан с намалена смъртност [8]. Тъй като концентрацията на единични антиоксиданти може да не отразява общата антиоксидантна сила на храната, както и други възможни взаимодействия или синергични ефекти на антиоксидантите, концепцията за общия антиоксидантен капацитет (TAC) е въведена за изследване на полезните ефекти на диетичните антиоксиданти, възникващи в смесени диети, както и подход към характеризирането на храната [9,10,11]. Диетичният TAC описва способността на хранителните антиоксиданти да изчистват свободните радикали и той се измерва с помощта на анализа на абсорбционния капацитет на кислородните радикали (ORAC). Наскоро проучвания в напречно сечение съобщиха, че диетичният ОДУ положително свързан с общия плазмен антиоксидантен капацитет [12, 13].
В допълнение към факторите на околната среда (включително начина на живот), които могат да увеличат риска от ССЗ, той може да бъде повлиян и от генетични варианти и няколко геномни области са свързани с риск от ССЗ [14]. Проучванията за асоцииране в целия геном (GWAS) са успешни при идентифицирането на същия локус на чувствителност на хромозома9p21, който се свързва с мултифакторни заболявания. Проучванията показват, че алелите 9p21 са допринесли за риска от ССЗ чрез стимулиране на ектопично натрупване на мазнини, хипертония и нарушен метаболизъм на глюкозата [15, 16]. Някои от тези проучвания са изследвали възможната връзка между единичните нуклеотидни полиморфизми (SNPs) в този локус с MetS и неговите компоненти като важни рискови фактори за ССЗ, както и тяхното взаимодействие с фактори на околната среда като хранителен прием [17]. Като цяло диетата играе важна роля в развитието на ИБС, няколко проучвания показват, че ниската консумация на плодове, зеленчуци и риба, която съдържа високи антиоксиданти и защитава сърцето, е свързана със ССЗ [18] и промените в диетата очевидно имат модифицирани рискови фактори за ССЗ. [19]. Днес знанието за това как такива свързани с диетата рискови фактори могат да взаимодействат с вариантите на генетична податливост на риска от ССЗ е важно за профилактиката на ССЗ.
Въз основа на нашето търсене обаче няма налично проучване, което да е оценило взаимодействието между тези SNP и диетичния антиоксидантен капацитет върху MetS и неговите компоненти. В това проучване са изследвани взаимодействията между диетичния TAC и хромозома 9p21 полиморфизъм rs1333048 върху шансовете на MetS.
Методи и материали
Проучвайте популация
В това проучване на напречното сечение бяха включени 363 участници (18–55 години). Вземането на проби беше направено с реклама в града. Лицата бяха включени, ако отговаряха на следните критерии: а именно възраст 18–55 години, забранено пушене и алкохол. Участниците с анамнеза за ССЗ, диабет, рак или инсулт бяха изключени поради възможни промени в диетата, свързани със заболяването и които приемаха някакви терапевтични лекарства. Също така изключихме субектите, чийто отчитан дневен прием на енергия е 800 kcal/ден (3347 kJ/ден) или 4200 kcal/ден (17 573 kJ/ден) [27]. Тези изключения оставиха 263 субекта (125 мъже и 138 жени) за текущия анализ. Всеки участник беше напълно информиран за протокола на изследването и предостави писмен и информиран формуляр за съгласие, преди да участва в проучването. Протоколът за изследване е одобрен от етичния комитет на Центъра за изследване на ендокринологията и метаболизма на Техеранския университет по медицински науки (TUMS) със следната идентификация: 93-04-161-27-722-1495-80.
Измерване на биохимични параметри
Всички кръвни проби бяха събрани в 8:00 до 10:00 часа сутринта. след 8–12 h гладно състояние в EMRC лабораторията на болница Shariatei на TUMS. За събиране на серуми, серумните проби се центрофугират 10 минути при 3000 об/мин, аликвотират се в епруветки от 1 ml и се съхраняват при - 80, докато се анализират. Плазмената глюкоза на гладно (FPG) се измерва в деня на вземане на кръв по метода на глюкозооксидаза фенол 4-аминоантипирин пероксидаза (GOD/PAP). Концентрациите на серумни триглицериди (TG) бяха изследвани с триацилглицеролови комплекти (Pars Azmoon Inc, Техеран, Иран) чрез използване на метод глицерол-3-фосфат оксидаза фенол 4-аминоантипирин пероксидаза (GPOPAP). Общите нива на холестерола се измерват по метода на ензимната крайна точка, а директният липопротеин с висока и ниска плътност се измерва чрез анализ на ензимен клирънс. Серумен свръхчувствителен С-реактивен протеин (hsCRP), като чувствителен маркер на възпалението, беше измерен чрез имунотурбидиметричен анализ (Randox laboratories kit, Hitachi LTD, Токио, Япония). Концентрациите на серумен инсулин бяха анализирани чрез метод за ензимно-свързан имуносорбентен анализ (ELISA) (комплект човешки инсулин ELISA, DRG Pharmaceuticals, GmbH, Германия), а минималната откриваема концентрация беше 1,76 U/ml, Intra CV беше 2,19% и Inter CV беше 4,4 %.
Антропометрични измервания
Теглото се измерва, докато субектите са минимално облечени и не носят обувки. Теглото се измерва с точност до 100 g с помощта на цифрови везни. Височината се измерва с помощта на рулетка, докато субектът е в изправено положение и не носи обувки, а раменете са отпуснати. Индексът на телесна маса (ИТМ) също се изчислява, като се използва уравнението „тегло (kg)/височина 2 (m 2)“. Кръвното налягане (BP) се измерва с помощта на стандартизиран сфигмоманометър след 5 минути почивка. Обиколката на талията (WC) беше измерена в средната точка на илиачния гребен и гръдния кош.
Пълен анализ на телесния състав
Съставът на тялото на участника беше оценен чрез анализатор на композицията на тялото BC-418MA-Tanita (Обединеното кралство). Този анализатор на биоелектричен импеданс (BIA) е проектиран да изпраща много слаб електрически ток за измерване на импеданса (електрическото съпротивление) на тялото. Следвахме всички следващи инструкции за точно измерване. За да се предотврати евентуално несъответствие в измерените стойности, преди да се направи оценка на телесния състав, участниците бяха помолени да не упражняват енергично, да не използват електрическо устройство и да приемат прекомерна течност или храна; те се извършват сутрин на гладно и уринират непосредствено преди анализа на телесния състав, за да се получи по-точен резултат от измерванията.
Диетична оценка и изчисляване на TAC на диетата
Данните за диетата са събрани с помощта на валидиран полуколичествен въпросник за честотата на храните (FFQ) със 147 хранителни продукта. Обучените диетолози помолиха участниците да определят честотата на приема им за всеки хранителен продукт, консумиран през изминалата година, ежедневно, седмично или месечно. Размерите на консумираните храни се отчитат в битови мерки и след това се преобразуват в грамове [20].
Изчислението на HOMA-IR
Оценка на хомеостатичния модел - инсулинова резистентност (HOMA-IR), се изчислява съгласно следното уравнение: [плазмена глюкоза на гладно (mmol/l) × плазмен инсулин на гладно (mIU/l)]/22,5 [24].
Определение на метаболитния синдром и неговите компоненти
Кардио-метаболитните рискови фактори за метаболитен синдром са определени в съответствие с диагностичните критерии, предложени от Панел за лечение на възрастни III (ATP III) [25] и нови гранични точки на WC за ирански възрастни [26]; синдромът се характеризира като притежаващ поне 3 от следните метаболитни аномалии: (1) Хипергликемия като FPG ≥ 100 mg/dl (5,6 mmol/l); (2) Хипертриглицеридемия като серумен TG ≥ 150 mg/dl (1,69 mmol/l); (3) Серум с нисък HDL-C
Резултати
Проучете характеристиките на популацията
Това сравнително проучване на напречното сечение е проведено върху 263 участници (52,5% жени). Средните стойности (± SD) на възраст, ръст, ИТМ и тегло на индивидите са съответно 35,08 ± 8,78 години, 168,23 ± 9,43 cm, 25,93 ± 4,89 kg/m 2 и 73,51 ± 15,66 kg (Таблица 1). Честотите на алелите A и C на rs1333048 са съответно 52,85% и 47,15%. Общото разпространение на rs1333048 генотипове е съответно 22,6%, 47,9% и 28,7% за AA, AC и CC (Таблица 2). Честотите на разпределение на споменатите SNP в това проучване следват равновесието на Харди-Вайнберг (P> 0,05). Установено е, че 12,5% от участниците са имали MetS и данните показват, че MetS за генотипове AA, AC, CC са съответно 13,3%, 11% и 13% (P = 0,86).
Асоциация между биохимични параметри, телесен състав, антропометрични измервания и rs1333048 генотипове
Общо 263 ирански мъже и жени бяха категоризирани въз основа на rs1333048 генотипове и разделени в три групи: CC генотип (n = 76), AC генотип (n = 127) и AA генотип (n = 60) (Таблица 3). Средствата за WC, бедро, ИТМ, тегло, FM, процент на мазнини и висцерална мастна тъкан (VFR) са по-високи при участниците, носещи алела A, в сравнение с индивидите в генотипа CC, но че няма статистически значима разлика в три групи, дори след корекция за ИТМ, възраст, пол и физическа активност. Също така не се наблюдава значителна разлика по отношение на TG, T-chol, HDL-C, LDL-C, hs-CRP, систолично и диастолично кръвно налягане в групите, дори след корекция за объркващи фактори.
Диетичен прием
След корекция за прием на калории при rs1333048 генотипове, имаше значителни разлики в протеините (P Таблица 4 Диетичен прием на изследвана популация според rs1333048 генотипове
Асоциация между биохимични параметри, телесен състав, антропометрични измервания и ОДУ
Резултатите от сравнението показаха, че средните стойности на WC, TG и T-chol са намалени от ниския прием на диетичен TAC с висок прием, но няма статистически значима разлика, както е показано в таблици 5 и 6.
Гени чрез диетични взаимодействия на MetS
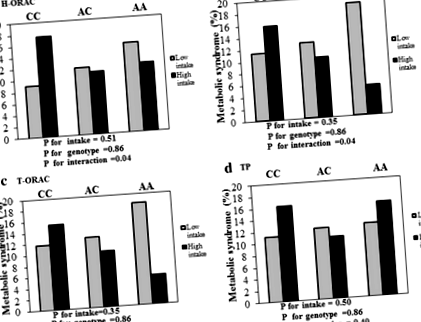
Анализът на бинарния логистичен регресионен модел беше използван за изследване на взаимодействията между rs1333048 генотипове и приема на H-ORAC, L-ORAC, T-ORAC и TP върху шансовете на MetS.
В суровите модели не е имало значително взаимодействие между rs1333048 генотипове и TAC върху шансовете на MetS. След корекция на възрастта, пола, ИТМ и физическата активност се наблюдава значително взаимодействие между rs1333048 генотипове и висок прием на L-ORAC при намаляване на шансовете за MetS (OR = 0,24, 95% CI = 0,06–0,94, P за взаимодействие = 0,04) . Освен това не е имало значително взаимодействие между rs1333048 генотипове и прием на T-ORAC и TP при шансовете на MetS, OR = 0,28, 95% CI = 0,07–1,10, P за взаимодействие = 0,07 и OR = 0,58, 95% CI = 0,16 –2,07, Р за взаимодействие = 0,40) дихателна. Също така, след коригиране на възрастта, пола, WC и физическата активност, се наблюдава значително взаимодействие между rs1333048 генотипове и висок прием на H-ORAC при намаляване на шансовете за MetS (OR = 0,26, 95% CI = 0,06–0,99, P за взаимодействие = 0,04).
Като цяло, при нисък прием на L-ORAC, процентът на MetS в генотипове AA, AC и CC е съответно 18,9%, 12,7% и 11,4%. Докато при висок прием на L-ORAC са съответно 5%, 10,1% и 15,8%. Също така, при висок прием на H-ORAC, процентът на MetS, при генотипове AA, AC и CC е съответно 12%, 10.9% и 17.5% (Фиг. 1).
В анализа на общия линеен модел (GLM) асоциациите на rs1333048 генотипове и H-ORAC, L-ORAC, T-ORAC и TP бяха тествани върху компоненти на MetS, включително: TG, HDL-C, LDL-C, T-chol, WC и BP, но няма значителна разлика дори след контролиране на ИТМ, пол, възраст и физическа активност.
Дискусия
Основната констатация беше, че полиморфизмът rs1333048 на хромозома 9p21 може да бъде свързан с по-високи шансове за MetS и че високият прием на H-ORAC и L-ORAC може да модифицира тази асоциация и да намали шансовете за MetS.
Интересното е, че е установена обратна и силна връзка между високия хранителен прием на L-ORAC и H-ORAC и шансовете за MetS в генотипа на АА. Обикновено приемът на висок хранителен L-ORAC, H-ORAC и T-ORAC променя връзката на rs1333048 генотипите с шансовете за MetS в генотипа AA. Когато се стратифицира от rs1333048 генотипове, високият хранителен прием на L-ORAC и H-ORAC е свързан само с по-нисък риск от MetS при лица с алели на риска.
В настоящото проучване беше установено, че генотипът на АА има средно по-висока маса на мазнини и процент на мазнини, въпреки че няма статистическа значимост, както и че разпространението на MetS в генотипа на АА е по-високо, отколкото в генотипа CC. Teeuw и сътр. съобщава, че честотата на rs1333048 генотипове е AA 35,7%, AC 46,6% и CC 17,9% [28]. Като цяло честотата на генотиповете може да варира в различните популации. Няколко проучвания показват важната роля на гена CDKN2A/B чрез модулация на няколко пътища, участващи в адипоцитите, бета-клетките на панкреаса и по-малко стабилните фенотипи на артериалната плака [29]. Horswell et al. показа, че нокдаунът на CDKN2B експресията в клетъчната линия на адипоцитите на мишка е свързан с повишено ниво на адипогенеза [30], подчертавайки значението на CDKN2B като определящ фактор за адипогенезата.
Констатациите от настоящото проучване показват, че като цяло високият прием на TAC в генотипа AA намалява следните биохимични параметри: TG, FBS, LDL-C и hs-CRP (но без статистически значими разлики). Въпреки това, само високите L-ORAC и T-ORAC приема намаляват WC в генотипа AA, в сравнение с генотипите CC и AC, със статистически значима разлика. Всъщност увеличената консумация на богати на антиоксиданти храни, като плодове, зеленчуци, зехтин, ядки и морски дарове, доведе до подобряване на липидните профили, с повишен HDL-C и намален LDL-C, в някои проучвания за интервенционни проучвания [ 31]. Някои проучвания показват значението на оксидативния стрес във физиопатологията на затлъстяването, а MetS демонстрира, че стойностите на оксидативния стрес се увеличават с броя на компонентите на MetS, както и че натрупването на мазнини е тясно свързано с маркерите на системния оксидативен стрес [32, 33 ]. Всъщност повишеният оксидативен стрес в натрупаните мазнини води до нерегулирано производство на адипоцитокини [34].
Благоприятните ефекти на тези богати на антиоксиданти храни върху подобряването на липидните профили, хомеостазата на глюкозата, инсулиновата резистентност, затлъстяването и затлъстяването са изследвани в предклинични и някои клинични проучвания [37]. В допълнение, диетичните антиоксиданти засягат и други аспекти на свързаните със затлъстяването метаболитни пътища, включително инхибирането на аборт на чревни мазнини, насърчаването на катаболизма в мастната тъкан, инхибирането на пролиферацията, диференциацията и ангиогенезата в преадипоцитите и индуцирането на апоптоза при зрели адипоцити [38]. Някои други диетични антиоксиданти могат да предотвратят затлъстяването, като регулират метаболизма на кафявата мастна тъкан и повишават термогенезата, намалявайки експресията на адипонектин и лептин в адипоцитите [39].
Силата на това проучване е, че това е първото изследване, което оценява взаимодействието между rs1333048 генотипове и TAC върху шансовете на MetS при субектите и че това е проучване, основано на общността. Основното ограничение на настоящото проучване беше относително малкият брой пациенти и ниското разпространение на MetS. Също така, дизайнът на напречното сечение на проучването, при което не беше възможно да се определи механизмът на връзката между L-ORAC/H-LORAC и rs1333048 генотипа, може да се разглежда като ограничение.
Заключение
Констатациите от това проучване показват, че високият прием на L-ORAC и H-LORAC може да намали шансовете за MetS в генотипа AA. Настоящите доказателства показват, че това може да е нова връзка между TAC и rs1333048 генотипове. Въпреки това, механизмът на взаимодействие между генотипите L-ORAC/H-ORAC и AA не е ясно разбран. Това проучване предоставя допълнителни доказателства за препоръчване на храни, богати на антиоксиданти, като полезен инструмент за промоция на здравето и профилактика на заболяванията.
- Взаимодействие между упражненията и лептина при лечението на диабет със затлъстяване
- Взаимодействие между затлъстяването и значението на чревната микробиота в храненето Годишен преглед на храненето
- Изследване на характеристиките на взаимодействие на маслени емулсии и сорбционен материал на основата на цвекло
- Липса на асоциация между NYD-SP18 Variant и затлъстяването
- Мързелива кето диета за отслабване Какво е това и колко ефективен е този вариант на кетогенна диета NDTV