Институт по биология на стареенето Макс Планк, Кьолн, Германия
Дарио Рикардо Валенсано
Институт по биология на стареенето Макс Планк, Кьолн, Германия
CECAD, Университет в Кьолн, Кьолн, Германия
Институт по биология на стареенето Макс Планк, Кьолн, Германия
Дарио Рикардо Валенсано
Институт по биология на стареенето Макс Планк, Кьолн, Германия
CECAD, Университет в Кьолн, Кьолн, Германия
Резюме
Тази статия е част от тематичния брой „Ролята на микробиома в еволюцията на гостоприемника“.
1. Въведение
2. Взаимодействията между домакин и микробиота имат дълга еволюционна история
Фигура 1. Специфична за хоста микробиота. Коеволюцията на микробите и многоклетъчните гостоприемници води до взаимни отношения. Домакинът изгражда динамична екологична ниша, която осигурява хранителни вещества и стабилна среда на микробите. От своя страна микробиотата осигурява хранителни вещества и нови метаболитни пътища. По посока на часовниковата стрелка, горе вдясно: корените на бобовите растения установяват симбиотични взаимодействия с Ризобия бактерии в почвата, които фиксират азота към молекулярни форми, достъпни за растението. Специфичната за вида микробиота в хидрата модулира спонтанните контракции на тялото и предотвратява летални гъбични инфекции. При листни въшки, хранещи се със сок, ендосимбиотични Бухнера осигуряват на гостоприемника незаменими аминокиселини, липсващи в сока. Протисти и бичове в термитите ферментират лигноцелулоза от дърво. Бобтейл калмарът е домакин на симбиотични колонии от биолуминесцентни Aliivibrio fischeri в неговия лек орган, помагащ при отбранително и ловно поведение. При преживните животни, ферментиращите целулоза бактерии усвояват богатите на фибри растения в метаболити, достъпни за приемници, като мастни киселини с къса верига (SCFA). Коменсалните микроби в червата на човека осигуряват хранителни вещества като SCFA, вторични жлъчни киселини и основни витамини. Тази цифра е генерирана с B iorender .
Повсеместната поява на многоклетъчен мутуализъм гостоприемник-микробиота е възможен в екстремни случаи от наличието на високо усъвършенствани анатомични отделения, като специализирани леки органи в калмари с бобтейл, леки органи в риби с фенерчета и преживни животни. Въпреки това, за да се установят коменсални взаимодействия с микробни партньори, по-голямата част от организмите разчитат на специализирани епители, обвивки и лигавични мембрани, които осигуряват физическо разделяне между вътрешността и външността. Тези специализирани мембрани и техният силно хетерогенен клетъчен състав са в състояние да защитят, но също така осигуряват ключовите функции за разпознаване и молекулярно кръстосано хранене между микробите и техните многоклетъчни гостоприемници [10,11]. Изтънчеността на молекулярното кръстосано говорене епител-микробиота достига пикове на сложност в дебелите черва на гръбначните животни, където имунитетът на лигавицата предпазва гостоприемника от патогени и стимулира разнообразна общност от коменсали (фигура 2). 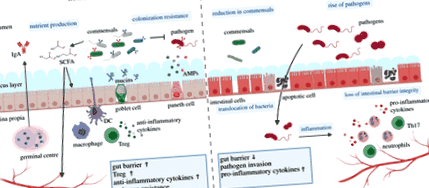
Силно сложните микробни съобщества, сходни сред членовете на един и същи вид, определят специфична за вида микробиота. Например родословната линия, водеща до хора, горила, шимпанзе и бонобо, представя специфични за видовете микробни възли, където специфични анатомични, физиологични и поведенчески адаптации в гостоприемника са свързани със специализирани микробни коменсални общности, вероятно отразяващи дълга история на съизмерване между гостоприемниците и микробите [12].
3. Адаптивна имунна система и създаване на разнообразна коменсална микробиота
Вроденият имунитет е древна линия на защита срещу патогени, споделяна между многоклетъчни организми, включително растения и безгръбначни [37,38]. Вродената имунна система предотвратява инфекциите чрез увеличаване на бариерната функция чрез физическо разделяне, секреция на антимикробни пептиди (AMP) и фагоцитоза. Вроденият имунитет еволюира, за да разпознава и реагира автоматично на набор от предварително определени микробни лиганди, в отговор на което предизвиква възпалителни и антивирусни реакции [39]. Специализирани рецептори, включително Toll-подобни рецептори, NOD-подобни рецептори и С-тип лектинови рецептори, известни също като рецептори за разпознаване на образци, идентифицират запазени молекулярни модели и по този начин откриват патогени или дефектни клетъчни компоненти [40–42]. Чрез предоставяне на ефективни защитни реакции срещу често срещани патогени, напр. чрез AMP вроденият имунитет оформя прости и специфични за гостоприемника коменсални микробни общности [43,44].
Т-лимфоцитите също помагат за поддържане на баланса гостоприемник-микроб в органите на лигавицата чрез действието на специализирани подкласове помощни клетки (напр. Tregs), които реагират на коменсалните антигени чрез експресия на противовъзпалителни цитокини и чрез овлажняване на провъзпалителните програми в ефекторните клетки [58] . Освен това цитотоксичните Т-клетки могат да благоприятстват коменсалните микроби чрез селективно елиминиране на други ефекторни клетки [59].
Микробите могат да се предпазят от имунни атаки в стомашно-чревния тракт чрез синтеза на специфични микробни междинни продукти (напр. Късоверижни мастни киселини (SCFA)), които потискат противовъзпалителните реакции както локално (напр. В колоноцитите и по-широко върху чревния епител), както и системно, променяйки метаболизма на глюкозата и имунните отговори на Т-клетките [60].
Ако обаче, от една страна, адаптивният имунитет дава възможност на гостоприемниците да контролират сложни коменсални микробни общности, с големи ползи за гостоприемника, от друга страна, това също създава нови шансове за хомеостатичен отказ, например когато балансираното взаимодействие гостоприемник-микробиота стане компрометирани, като по време на автоимунни заболявания и стареене.
4. Стареене и дисбиоза
Стареенето е обща характеристика сред почти всички живи организми и се характеризира с възрастово зависим спад на почти всички хомеостатични функции. Зависима от стареенето дисфункция се скалира на всички нива на биологична сложност, от натрупване на ДНК и увреждане на протеини в клетките, до органелна дисфункция (напр. Митохондриална дисфункция), до клетъчно стареене, дисбаланс на органите поради променен клетъчен състав и необратими модификации на извънклетъчния матрикс [65] . Свързани с възрастта метаболитни и клетъчни промени се появяват заедно със системно и хронично нискостепенно възпаление, наречено възпаление [66]. Хомеостатичният дисбаланс и намалената функция на имунната система корелират с хронично възпаление, увеличаване на честотата на инфекциозни заболявания, както и дегенеративни заболявания, като артериосклероза, диабет тип 2, рак и болест на Алцхаймер, наред с други [67]. Кумулативно, зависимият от стареенето системен спад води до прогресивно увеличаване на риска от смърт [68].
5. Взаимодействия между имунната система и микробиотата по време на стареенето на гръбначните животни
Имунната система помага да се поддържа системна хомеостаза и здрави тъкани чрез елиминиране на увредени, заразени и застаряващи клетки [85] и чрез поддържане на баланса между коменсалните и патогенните микроби [86]. Имунната функция обаче е обект на сериозни промени по време на стареенето, включително неправилно имунно наблюдение на увредени и инфектирани клетки, хронични възпалителни реакции и автоимунитет, което води до големи увреждания на тъканите [87]. В резултат на това по време на стареенето гостоприемникът е предразположен към инфекции и към широк спектър от заболявания. Както вродените, така и адаптивните имунни функции претърпяват промени по време на стареенето. Например, работата при мишки показа, че вътреклетъчните антивирусни механизми (напр. Интерферонови отговори) се активират по време на стареенето в отговор на де-репресия на LINE1 (L1) ретротраспозони. Клетките усещат цитоплазматичната L1 ДНК като потенциална вирусна заплаха, активират възпалителни реакции и индуцират клетъчно стареене [88], което играе основна роля в свързаната със стареенето патология [89].
По време на стареенето се засягат и много аспекти на адаптивния имунитет. Загубата на В-клетъчно разнообразие [90] и по-ниско качество на произведените антитела, включително излишък от неспецифични антитела [91], водят до свързана с възрастта имунна дисфункция, която може например да допринесе за по-малко ефективна ваксинация при възрастни хора при нашия вид [ 92]. По време на стареенето на човека медиираният от Т клетки имунитет се влияе от намалена първична лимфопоеза, свързана с инволюция на тимуса [93], и до намалено разнообразие в репертоара на Т клетъчните рецептори [94,95]. Функционалният спад на отговорите на Т-клетките по време на стареенето е свързан с по-висок риск от рак при възрастни хора [96].
Еволюцията на адаптивната имунна система даде страхотно предимство във фитнеса на ранните гръбначни животни, които биха могли да правят разлика между себе си и не-себе си, ефективно елиминирайки патогени и паразити, ставайки способни да създадат разнообразна общност от коменсали. Ако обаче адаптивната имунна система предостави на гръбначните животни новата възможност да имат достъп до биохимичното разнообразие на сложната микробиота, това също дойде с цената на нов набор от хомеостатични модалности на отказ, които според нас могат да определят специфична за гръбначните животни динамика на стареене.
Благодарение на достъпа до чиста вода, ваксинации и антибиотици инфекциозните болести вече не са водещите причини за смърт в индустриализираните страни. Въпреки това и до днес възрастните хора са по-податливи на инфекции в сравнение с младите хора [97]. Имунният спад, свързан с автоимунни заболявания [98], причинени от патогени имунодефицити (напр. Поради ХИВ инфекция) [99] и стареене, често се свързват с чревна дисбиоза [100], която, заедно със зависимата от възрастта загуба на чревната бариерна функция, може да доведе до бактериемия и сепсис, т.е. две от основните причини за смърт при възрастните популации [97]. По време на стареенето фината дискриминация между себе си и не-себе може да стане дефектна, което да доведе до повишен автоимунитет, потенциална толерантност към патогени [101] и депресия на противовъзпалителните реакции срещу коменсалите. Нарушеният имунен надзор по време на стареенето може да доведе до разпространение на опортюнистични патогени и до разширяване на патобионтите, т.е. коменсални микроби при нормални обстоятелства, които могат да се превърнат в патогени [81]. Патобионтите от своя страна също могат причинно да предизвикат автоимунитет [102].
Тук предполагаме, че специфичната за гръбначните животни динамика на стареенето зависи отчасти от сложното механистично взаимодействие между микробиотата и адаптивния имунитет, което има дълга еволюционна история. Всъщност адаптивната имунна система активно оформя коменсалната микробиота, която от своя страна допринася за развитието и поддържането на имунната система. Възникващите скорошни научни доказателства показват как микробиотата играе причинно-следствена роля по време на стареенето. Трансплантацията на микробиота от млади възрастни на индивиди на средна възраст удължава продължителността на живота в краткотрайна система от модели на гръбначни животни, показвайки, че свързани с младите чревни микроби имат кумулативно пробиотично действие [71]. Аналогично, трансплантацията на микробиота от млади мишки на мишки на средна възраст засили имунната функция, реактивирайки дефектните зародишни центрове в червата [103]; и трансплантацията на микробиота от здрави донори на прогероидни (т.е. преждевременно стареещи) мишки доведоха до продължителност на живота и удължаване на здравната продължителност [104].
Остават да бъдат разгледани няколко отворени въпроса. Ако микробиотата влияе причинно на процеса на стареене, направете индивидуална динамика на стареене - напр. по-висок или по-нисък риск от заболявания, свързани със стареенето - зависят от индивидуалния състав на микробиотата? Можем ли да възприемем микробиотата като диагностичен инструмент за прогнозиране на индивидуален риск от заболяване? Ако всеки вид има своя, специфична за вида микробиота - която се получава като функция от местообитанието им, начина на живот, еволюционната история и специфичната функция на имунната система - различава ли се всеки вид по своите патологии, свързани със стареенето? Ако коменсалните микроби могат да потиснат имунния отговор и да благоприятстват имунната толерантност (напр. Чрез SCFA), могат ли патогените да отвлекат молекулярната сигнализация на коменсала, за да егоистично благоприятства патогенността? Как можем да поддържаме баланса между гостоприемник и микробиота за продължително време и по време на имунното стареене?
Заедно еволюцията на многоклетъчните гостоприемници и техните микробни партньори доведе до появата на изумителни биологични нововъведения, включително усъвършенствана адаптивна имунна система, която доведе до възможността за достъп до ново метаболитно пространство - предоставено на гостоприемника от неговите коменсални микроби - но също доведе до нови модалности на хомеостатична недостатъчност, които евентуално характеризират специфичната за гръбначните животни динамика на стареенето.
Достъпност на данни
Тази статия не съдържа никакви допълнителни данни.
- Royal Canin ще бъде домакин на уебинар за изследване на ветеринарната практика за управление на затлъстяването за котки и кучета
- Малките черва Микробиота регулира храносмилателните и абсорбтивни адаптивни отговори на диетата към диетата
- Метопролол и Терафлу Макс-D Тежка настинка; Грипни лекарствени взаимодействия
- Метопролол сукцинат ER и алкохолни взаимодействия с храни
- NRAS - Национално общество за ревматоиден артрит
