Phiwayinkosi V. Dludla
1 Департамент по науки за живота и околната среда, Политехнически университет в Марке, 60131 Анкона, Италия; [email protected] (S.S.); [email protected] (P.O.); [email protected] (L.T.)
2 Платформа за биомедицински изследвания и иновации, Южноафрикански съвет за медицински изследвания, Tygerberg 7505, Южна Африка; [email protected] (B.J.); [email protected] (J.L.); [email protected] (S.E.M.-M.)
Бонгани Б. Нкамбуле
3 Училище за лабораторна медицина и медицински науки, Колеж по здравни науки, Университет на Квазулу-Натал, Дърбан 4000, Южна Африка; az.ca.nzku@belubmakn (B.B.N.); az.ca.nzku.uts@621360712 (Z.M.); az.ca.nzku.uts@911360712 (T.M.)
Babalwa Jack
2 Платформа за биомедицински изследвания и иновации, Южноафрикански съвет за медицински изследвания, Tygerberg 7505, Южна Африка; [email protected] (B.J.); [email protected] (J.L.); [email protected] (S.E.M.-M.)
Зибусисо Мкандла
3 Училище за лабораторна медицина и медицински науки, Колеж по здравни науки, Университет на Квазулу-Натал, Дърбан 4000, Южна Африка; az.ca.nzku@belubmakn (B.B.N.); az.ca.nzku.uts@621360712 (Z.M.); az.ca.nzku.uts@911360712 (T.M.)
Tinashe Mutize
3 Училище за лабораторна медицина и медицински науки, Колеж по здравни науки, Университет на Квазулу-Натал, Дърбан 4000, Южна Африка; az.ca.nzku@belubmakn (B.B.N.); az.ca.nzku.uts@621360712 (Z.M.); az.ca.nzku.uts@911360712 (T.M.)
Соня Силвестри
1 Департамент по науки за живота и околната среда, Политехнически университет в Марке, 60131 Анкона, Италия; [email protected] (S.S.); [email protected] (P.O.); [email protected] (L.T.)
Патрик Орландо
1 Департамент по науки за живота и околната среда, Политехнически университет в Марке, 60131 Анкона, Италия; [email protected] (S.S.); [email protected] (P.O.); [email protected] (L.T.)
Лука Тиано
1 Департамент по науки за живота и околната среда, Политехнически университет в Марке, 60131 Анкона, Италия; [email protected] (S.S.); [email protected] (P.O.); [email protected] (L.T.)
Йохан Луу
2 Платформа за биомедицински изследвания и иновации, Южноафрикански съвет за медицински изследвания, Tygerberg 7505, Южна Африка; [email protected] (B.J.); [email protected] (J.L.); [email protected] (S.E.M.-M.)
4 Катедра по биохимия и микробиология, Университет на Зулуланд, KwaDlangezwa 3886, Южна Африка
Sithandiwe E. Mazibuko-Mbeje
2 Платформа за биомедицински изследвания и иновации, Южноафрикански съвет за медицински изследвания, Tygerberg 7505, Южна Африка; [email protected] (B.J.); [email protected] (J.L.); [email protected] (S.E.M.-M.)
5 Отдел по медицинска физиология, Факултет по здравни науки, Университет Стеленбош, Тигерберг 7505, Южна Африка
Резюме
1. Въведение
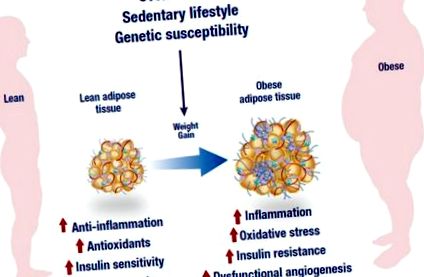
Прекомерното хранене, заседналият начин на живот и генетичната податливост са водещите фактори, свързани с развитието на затлъстяването. В допълнение към дисфункционалната ангиогенеза, състоянието на затлъстяване се характеризира с необичаен възпалителен отговор, нисък антиоксидантен капацитет и намалена инсулинова чувствителност, което в крайна сметка може да доведе до генериране на възпаление, оксидативен стрес и инсулинова резистентност. Фигурата е променена от следния уебсайт, https://mexicobariatriccenter.com/improve-adipose-tissue-function/.
2. Възпаление и инсулинова резистентност в мастната тъкан
Затлъстяването е свързано с дисфункционален липиден метаболизъм, включително прекомерна липолиза, което от своя страна води до повишено производство и секреция на свободни мастни киселини (FFA). Повишените нива на FFA могат да причинят анормален провъзпалителен отговор и последващо развитие на инсулинова резистентност. Докато изчерпаните вътреклетъчни антиоксидантни системи в мастната тъкан, главно поради увеличеното производство на реактивни кислородни видове (ROS), могат да генерират оксидативен стрес, а това допълнително може да доведе до развитие на инсулинова резистентност. NADPH, никотинамид аденин динуклеотид фосфат.
Инфилтрацията на макрофаги в мастната тъкан може също да инициира хронично имунно активиране, което води до метаболитна дисрегулация и повишен риск от сърдечно-съдови заболявания [42,43]. Счита се, че няколко фактора, получени от адипоцити или ендотелни клетки в мастната тъкан, инициират набирането на макрофаги в мастната тъкан. Това води до инфилтрация на някои имунни клетки, като неутрофили и Т клетки, което впоследствие предизвиква хипоксия и смърт на адипоцитните клетки [38]. Редът на набиране на имунни клетки остава неясен, но при затлъстяването макрофагите представляват повече от половината от популацията на левкоцитите, присъстващи във висцералната и подкожната мастна тъкан [30]. Някои проучвания показват пряка връзка между повишени макрофаги, открити във висцералната бяла мастна тъкан, и повишен индекс на телесна маса [44]. В животински модели на диета, предизвикано от затлъстяване, макрофагите съставляват около 50% от всички клетки на мастната тъкан [30], докато при слаби мишки и хора клетките на мастната тъкан се състоят само от 5% макрофаги [30]. Всъщност инхибирането на инфилтрацията на макрофаги чрез блокиране на моноцитния хемоаттрактант 1 (MCP-1) подобрява инсулиновата резистентност [45].
Доказано е, че адипокини като адипонектин инхибират функцията на макрофагите [46,47], а лептинът стимулира възпалението чрез индуциране на активиране и пролиферация на Т лимфоцити [48]. Продуктите на липолиза като FFA активират Т лимфоцитите, което води до увеличаване на мастната маса и възпаление на мастната тъкан. Интересното е, че нивата на цитокините на Т-помощни клетки 17 (TH17) са свързани с възпаление при затлъстели хора, живеещи с T2D [49]. От друга страна беше установено, че хипергликемията индуцира производството на TNF-α чрез регулиране надолу на моноцитната клетъчна повърхност CD33, трансмембранен рецептор, експресиран от моноцити в периферната кръв [50]. CD33 играе решаваща роля в инхибирането на производството на цитокини, а намаляването на експресията на CD33 в моноцити и лимфоцити е свързано с повишено производство на възпалителни цитокини като TNF-α и IL-1 [50,51]. TH17 лимфоцитите секретират IL-17, който задейства ядрения фактор каппа-усилвател на лека верига на активирани В клетки (NF-кВ), водещ до активиране на В лимфоцити [52].
3. Оксидативен стрес в мастната тъкан
4. Кратък преглед на класификацията, появата и бионаличността на галова киселина
Галловата киселина (PubChem CID: 370) е 3,4,5-трихидроксибензоена киселина с молекулярна формула C7H6O5 (MW 170,12 g/mol), която се среща в изобилие в ядки, смрадлика, хамамелис, чаени листа, дъбова кора и други растения [77]. Галловата киселина принадлежи към отделна група естествено срещащи се съединения, известни като фенолни киселини, и обикновено се произвежда чрез хидролиза на танинова киселина. Този клас съединения е уникален за това, че съдържат фенолен пръстен, който притежава поне една функционалност на карбоксилната киселина (Фигура 3). Фенолните киселини обикновено се класифицират в бензоени киселини, съдържащи седем въглеродни атома (C6-C1) и канелени киселини с девет въглеродни атома (C6-C3) [12]. Галовата киселина обаче съществува предимно като хидроксибензоени киселини [77,78] и се среща в различни форми на естери и соли, включително епигалокатехин галат (PubChem CID: 65064) [79], етил галат (PubChem CID: 13250) [80], галокатехин галат (PubChem CID: 199472) [81], метил галат (PubChem CID: 7428) [82], пропил галат (PubChem CID: 4947) [83], теафлавин-3-галат (PubChem CID: 169167) [84] и други (Фигура 3).
- Дефицит на магнезий и оксидативен стрес актуализация
- Употреба на хуминова киселина, странични ефекти, взаимодействия, дозировка и предупреждение
- Как стресът влияе на отслабването - HealthifyMe Blog
- Как стресът влияе върху загубата на мазнини; Лора Шьонфелд
- Как стресът саботира целите за изграждане на мускули и отслабване