Преглед на статия том 2 брой 5
Раджат Гупта, 1
Проверете Captcha
Съжаляваме за неудобството: предприемаме мерки за предотвратяване на измамни подавания на формуляри от екстрактори и обхождане на страници. Моля, въведете правилната дума на Captcha, за да видите имейл идентификатор.
1 Лаборатория за молекулярна неврология и функционална геномика, Технологичен университет в Делхи, Индия
2 Катедра по неврология, Медицински факултет на Университета Туфтс, САЩ
Кореспонденция: Правир Кумар, доцент в катедра по биотехнологии, Технологичен университет в Делхи (бивш технически колеж в Делхи), стая # FW4TF3; Сграда за машиностроене Shahbad Daulatpur, Bawana Road, Делхи 110042, Индия, адюнктивен факултет, Медицинско училище в Университета Туфтс, Бостън, САЩ, тел. 919818898622
Получено: 26 февруари 2015 г. | Публикувано: 16 юни 2015 г.
Цитат: Gupta R, Sawhney P, K Ambasta R, et al. Затлъстяване и невродегенерация. Adv Obes Управление на теглото. 2015; 2 (5): 96-101. DOI: 10.15406/aowmc.2015.02.00029
Ключови думи: затлъстяване, загуба на неврони, хиперинсулинемия, сигнализация, възпаление
NDD, невродегенеративно заболяване; AD, болест на Алцхаймер; PD, болест на Паркинсон; Ар, амилоид бета; NFT, неврофибриларни заплитания; IKK-β, инхибитор на субединица бета на ядрен фактор kappa-b киназа; T2D, диабет тип 2; ССЗ, сърдечно-съдови заболявания; TNFα, фактор на туморна некроза α; APP, амилоиден предшественик протеин; MAP, протеин, свързан с микротубули; HD, болест на Хънтингтън; IDE, ензим, разграждащ инсулина
Затлъстяването е здравословно разстройство, което нараства в световен мащаб с тревожни темпове, най-вече в развитите и развиващите се страни и особено при децата. 1 Това увеличение се дължи главно на промяна към заседнал начин на живот, високо съдържание на мазнини, прием на захар и по-малко физическа активност. Затлъстяването, свързано с прекомерен прием на калории и съхранение на мазнини в мастните тъкани под формата на триглицериди, е основният двигател на метаболитния синдром и също така служи като рисков фактор за развитието на хронични заболявания като T2D и свързаните с тях сърдечно-съдови заболявания (ССЗ) . 2 Затлъстяването също е свързано с ускорения процес на стареене. 3 Различни физиологични промени се наблюдават при затлъстел индивид, т.е. инсулинова толерантност, водеща до увреждане на глюкозната хомеостаза, централно затлъстяване, дислипидемия, където последната се нарича „метаболитен синдром“. Съпътстващите тези две системни промени също се дължат на затлъстяването и метаболитния синдром, т.е. оксидативно увреждане на клетъчните компоненти и повишена секреция на провъзпалителни фактори като TNFα (туморен фактор некроза α), цитокини и интерлевкини. 4–6
Сега нарастващ брой изследователи предполагат връзка между затлъстяването и патологията на NDD. NDD се характеризират с прогресивна загуба на паметта и познанието, което в крайна сметка може да доведе до смърт. Това влошаване е основно резултат от възпаление поради отклонено отлагане на протеини, оксидативен стрес и модификация на липидните пътища. 7,8 AD и PD са двете най-често срещани невродегенеративни заболявания.
Болестта на Алцхаймер е най-често срещаното възрастово невродегенеративно заболяване, засягащо
10% от населението над 65 години. 9 Извънклетъчните Aβ плаки 10 и NFTs 11 са две отличителни лезии на заболяването, които в комбинация с други физиологични и структурни промени причиняват тежка невронална дисфункция и загуба на неврони. Ар, получен от последователното протеолитично разцепване на амилоидния предшественик протеин (APP) от β-секретаза и последван от γ-секретаза, обикновено е с размер 40-42 аминокиселини. 12,13 В мозъка с AD, тау агрегатите присъстват под формата на NFT. Tau е свързан с микротубули протеин (MAP), който се свързва с микротубулите и ги стабилизира. Когато тау стане убиквитиниран и хиперфосфорилиран, неговият афинитет към микротубулите намалява няколко такива хиперфосфорилирани тау агрегата, за да се образуват (NFT). 14,15
Болестта на Паркинсон е второто най-често срещано невродегенеративно заболяване със свързани когнитивни и двигателни нарушения. Характеризира се с патологията на тялото на Lewy. Те са цитоплазмени включвания с диаметър от 5 до 25µm, съдържащи неразтворим синаптичен протеин α-синуклеинови агрегати, докато невритите на Lewy са дистрофични невронални процеси. Тези две патологии причиняват невронална загуба, свързана с PD в региона, отнасящ се до substantia nigra. 16 Различни проучвания сега показват, че съществува потенциална връзка между появата на затлъстяване и патологията на NDD като AD, PD, болест на Хънтингтън (HD) и др. Въпреки че генетичните връзки между затлъстяването и NDDs са слабо разбрани, сега е известно много за функционалните промени и взаимното въздействие на двете заболявания.
Физиологични промени в затлъстяването, допринасящи за невродегенерацията
Инсулинова резистентност: Инсулинът е пептиден хормон, който играе критична роля в периферната хомеостаза на глюкозата, регулирайки баланса между производството на глюкоза от черния дроб и усвояването му от мускулите и мастните тъкани. Инсулинът притежава важни невротрофни свойства в мозъка. Хормонът се транспортира до централната нервна система през кръвно-мозъчната бариера чрез транспортен механизъм, медииран от инсулиновите рецептори. Тези рецептори са локализирани главно в хипокампуса, енторхиналната кора и фронталната част, която функционира в обучението, паметта и познанието. 17
Забелязано е, че висцералното затлъстяване е основна причина за инсулиновата резистентност. Висцералните мастни тъкани поради високата си скорост на метаболизма действат като ендокринни органи, които секретират адипокини (напр. Лептин) и цитокини (напр. TNF-α, IL-6, свързващ хепарин епидермален растежен фактор). Активирането на провъзпалителните пътища и секрецията на цитокини води до инсулинова резистентност. При мозъчен дефицит и резистентност на инсулин предизвиква невронална смърт поради отнемане на трофичния фактор, дефицит на енергиен метаболизъм и по този начин инхибиране на инсулин-реагиращата генна експресия, стимулираща невродегенерацията. 18.
В случай на болестта на Паркинсон инсулинът регулира отрицателно мозъчната допаминергична активност. Инсулинът инхибира изстрелването на допамин-съдържащи неврони, открити в substantia nigra, и спира или обръща увеличаването на скоростта на освобождаване на допаминергичните клетки, обикновено предизвикани от антагониста на допаминовия рецептор халоперидол. 19 Също така, реактивните кислородни видове, произвеждащи хронична хипергликемия, могат да бъдат механизъм, лежащ в основата на загубата на допаминергични клетки при хипергликемични животни. Хроничната хипергликемия обаче е само незначителен рисков фактор за болестта на Паркинсон при хората. 20.
Непоносимост към глюкоза и захарен диабет тип 2.
Инсулиновата резистентност е често срещана патофизиологична характеристика на затлъстяването и непоносимостта към глюкоза, тъй като засяга транспорта на мембранния катион. Глюкозната непоносимост се определя като преддиабетна ситуация на хипергликемия, която е свързана с инсулинова резистентност и повишен риск от сърдечно-съдова и неврологична патология. Нарушеният глюкозен толеранс предшества T2D mellitus, който от своя страна действа като причина за много невродегенеративни нарушения. 21 Стратегиите за лечение на макроваскуларните и микроваскуларните усложнения на захарния диабет са забелязали дълбоко подобрение. Следователно хората живеят в по-дълга възраст със захарен диабет, което е довело до появата на няколко нови усложнения. Деменцията е един пример за тези нововъзникващи нови усложнения. В сравнение с общото население, повишеният риск от деменция е 50% –150% при хората с T2DM. 22 T2DM е тясно свързан с идентифицирани рискови фактори за деменция, включително атеросклеротично съдово заболяване, алела APOE-ε4. Няколко изследвания показват, че диабетът с алел APOE-ε4 е свързан с повишен риск от деменция. 23.
Мозъчните клетки не са в състояние да синтезират или съхраняват глюкоза; следователно трябва да се транспортира през кръвно-мозъчната бариера. Това се прави от транспортери за глюкоза като GLUT-1, GLUT-3 и GLUT-4. 24 В състояние на глюкозен дисметаболизъм, крайните продукти на Advanced Glycation (AGE), които са продукти от реакцията на Maillard, могат да започнат да се натрупват в клетките. AGEs гликирани Ар, които правят тези пептиди по-податливи на агрегация, също така AGE играят роля в хиперфосфорилирането на тау. Тази модификация на Ар води до образуване на сенилни плаки, тау хиперфосфорилиране и последващо образуване на неврофибриларни заплитания, които са белези за патологията на AD. 25
Хиперинсулинемия - рисков фактор за АД
Инсулинът регулира метаболизма на амилоидния предшественик чрез намаляване на вътреклетъчното му натрупване. При умерени концентрации инсулинът също се свързва със синтеза на основни невротрансмитери като ацетилхолин и норепинефрин. Хиперинсулинемията с повишени нива на инсулин в мозъка може да бъде свързана с намаляване на клирънса на Ар поради конкуренция за техния основен разграждащ механизъм - „Инсулин-разграждащият ензим“. IDE е многофункционален ензим, който разгражда инсулин и амилин, пептиди, свързани с патологията на T2D, заедно с Ар пептид в мозъка на AD. Хиперинсулинемията може да повиши нивата на Ар чрез конкуренцията на инсулина с Ар за IDE. 26 Следователно IDE е потенциална връзка между хиперинсулинемия и AD. Тъй като IDE е много по-селективен за инсулин, отколкото за Ар, мозъчната хиперинсулинемия може да лиши Ар от неговия основен механизъм за изчистване, подпомагайки отлагането му в мозъка, а оттам и последващите невротоксични ефекти. 27
Дислипидемия
Дислипидемията е една от последиците от затлъстяването и се характеризира с повишаване на триглицеридите и свободните мастни киселини и намаляване на HDL-C и HDL. 28 Това увеличаване на свободните мастни киселини заедно с възпалението, предизвикано от затлъстяването, води до инсулинова резистентност. 29 Много от мастните киселини са цитотоксични и могат да причинят възпаление чрез стимулиране на синтеза на възпалителни цитокини като TNF-α, IL-1, IL-6 и т.н. 30
Секреция на адипокин
Адипокините са разтворими медиатори, произвеждани главно от адипоцити, които действат паракринно, автокринно или системно. Досега са идентифицирани над 50 адипокини, от които лептин, автотаксин и адипонектин са показали, че играят преобладаваща роля в невродегенерацията. 31
Лептинът (идентифициран през 1994 г.) е 16KDa протеин, преведен от затлъстял (ob) ген, който регулира затлъстяването чрез инхибиране на глада. 32 Лептинът действа предимно върху хипоталамусната област и контролира апетита. Рецепторите за лептин също се експресират в допълнителни хипоталамусни области като амигдала, мозъчен ствол и малкия мозък.
Ефект на секрецията на адипокин върху AD: В нормална клетка лептинът действа като невропротектор чрез инхибиране на клетъчната смърт, намаляване на клетъчната цитотоксичност и намаляване на ефектите на оксидативен стрес. От експериментите с диети, предизвикани от затлъстели гризачи, се стига до заключението, че активността на кръвно-мозъчната бариерна транспортна система е намалена, което води до провал в циркулацията на лептин към целите му в мозъка. По този начин сигналът за лептин е значително намален в дъгообразното ядро на хипоталамуса. Експресията на лептин е в отрицателна корелация с патологията на AD, тъй като регулира нивата на Ар чрез потискане на натрупването на интраневронални липиди и инхибиране на GSK-3β, като по този начин намалява тау фосфорилирането и образуването на неврофибриларни заплитания. 33
Ефект на секрецията на адипокин върху PD: PD се характеризира със загуба на неврони, произвеждащи допамин в substantia nigra. Лептинът има защитни ефекти срещу 6-OHDA (6-хидроксидопамин) токсичност в допаминергичните неврони и запазва функционирането на допаминовата система. Тъй като нивата на лептин са намалени поради затлъстяване, следователно, увеличаване на риска от PD. 34
Невровъзпаление
Невровъзпалението може да се опише като активиране на вродения имунен отговор на мозъка за защита на ЦНС срещу инфекции, наранявания и заболявания. 35 Невроинфламацията е сложна поредица от реакции, включваща клетъчни и молекулярни промени, активиране на периферния имунен отговор, иницииране на вътреклетъчен сигнален път, освобождаване на възпалителни медиатори, водещи до невронална дисфункция и загуба. 36 Невроинфламацията води до невродегенерация чрез активиране на IKKβ/NF-кВ път, дисфункция на кръвно-мозъчната бариера и натрупване на макрофаги (астроцити и микроглии). 37,38 Затлъстяването води до натрупване на бяла мастна тъкан, която действа като ключово място за улесняване на системното възпаление. 39 Хипертрофираните адипоцити и имунните клетки на мастната тъкан причиняват повишаване на циркулиращите нива на възпалителни цитокини като TNF-α, IL-6, IL-1β и др. 40–42, от които IL-6 и IL-1β могат да унищожат участващите невронални вериги в познанието и паметта. 43 Натрупване и активиране на макрофаги е наблюдавано в мастните тъкани при затлъстели хора. 44 По този начин невровъзпалението може да се разглежда като последица от затлъстяването, водещо до невродегенерация.
Хипоталамусът представлява основната част от ЦНС, засегната от възпаление. Хипоталамусното възпаление се отнася до клетъчните и молекулярни промени в хипоталамуса поради физически наранявания, травми, инфекции, метаболитни аномалии и стареене. 45 Хипоталамусът регулира енергийния баланс, управлява физиологичните процеси като хранене, енергийни разходи, телесно тегло и метаболизъм на глюкозата. Медиобазалната област на хипоталамуса (MBH) разпознава различни циркулиращи сигнали и активира сигналните пътища надолу по веригата, за да контролира метаболитната физиология. Съобщава се, че IKKβ/NF-κb предизвиква възпаление на хипоталамуса, което може да причини диабетни промени като непоносимост към глюкоза, инсулинова резистентност и нарушена секреция на инсулин. 47 Активирането на IKKβ/NF-κb път засяга сигналния път на прореза, за да инхибира диференциацията на невронните стволови клетки и да наруши оцеляването на тези клетки, причинявайки невродегенерация, което може да доведе до заболявания като AD. 48
Промяна в сигналните пътища поради затлъстяване
Многобройни промени в пътя са очевидни при затлъстяването, което може да повлияе на нормалното функциониране на мозъка. Тези променени пътища водят до вредни ефекти върху мозъчните клетки като оксидативен стрес, ER стрес и митохондриална дисфункция, като по този начин причиняват дисфункция на клетъчните машини и постепенно загуба на неврони.
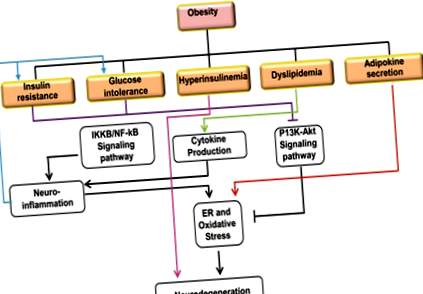
Инсулинът и инсулиновият фактор на растеж 1 (IGF-1) са важни за хомеостазата на мозъчната глюкоза и за оцеляването на клетките, действащи по паракринен или автокринен начин 49 чрез сигналния път P13K-Akt. 50 Този път е чувствителен към различни метаболитни сигнали и стресови състояния и основно участва в инхибирането на образуването на тумори и апоптозата. 51 При нормални инсулинови условия инсулиновите рецептори (IR)/IGF-1R се активират в отговор на оксидативен стрес, докато гликоген синтазекиназа-3 β (GSK-3β) се инхибира. Това е придружено от повишено производство на 4-хидроксиноненал (4-HNE) за окислителна защита на невронални липиди и протеини. 52 Въпреки това, нарушената инсулинова/IR и IGF-1/IGF-1R сигнализация е резултат от променени нива на инсулин и/или IGF-1 в мозъка със затлъстяване или T2D. Това променено сигнализиране е свързано с APP дисметаболизъм и тау хиперфосфорилиране стимулация, две отличителни причини за AD. 53,54 (Фигура 1)
Възпалителният отговор се медиира от активирането на IKKb/NF-κB пътя. Доказано е, че хипоталмичното възпаление, индуцирано от IKKb/NF-kB, причинява глюкозна непоносимост и инсулинова резистентност. 56 По този път IKKβ разгражда протеина IkB и освобождава NF-κB, който се локализира в ядрото и активира транскрипцията на възпалителни протеини. В случай на затлъстяване, Toll-подобни рецептори (TLR) и цитокинови рецептори са показали, че медиират невровъзпаление чрез активиране на IKKb/NF-κB път. 57,58 Проучвания показват, че хипоталмичното възпаление се постига чрез активиране на IKKb/NF-κB пътя чрез ER стрес и дефекти на автофагията. 59–74 (Таблица 1)
Гени, участващи в затлъстяването и невродегенерацията
- Онлайн книжен клуб MIssion Възможно изкореняване на затлъстяването в Америка Билети, събота, 24 октомври 2020 г. в 12
- Лекарите изграждат по-малко отношения с пациенти със затлъстяване - Gudzune - 2013 - Затлъстяване - Wiley Online Library
- Съвети на лекар за затлъстяване за отслабване, докато Борис Джонсън призовава британците да подобрят здравето - Mirror Online
- Затлъстяване и психично здраве
- Затлъстяването и преяждането как да се преодолее лош навик - ABC News