Марта Влодарчик
1 Катедра по биохимия и фармакогеномика, Фармацевтичен факултет към Катедра по лабораторна медицина, Медицински университет във Варшава, Banacha 1B, 02-097 Варшава, Полша; [email protected]
2 Център за предклинични изследвания, Медицински университет във Варшава, Banacha 1B, 02-097 Варшава, Полша
Гражина Новичка
1 Катедра по биохимия и фармакогеномика, Фармацевтичен факултет към Катедра по лабораторна медицина, Медицински университет във Варшава, Banacha 1B, 02-097 Варшава, Полша; [email protected]
2 Център за предклинични изследвания, Медицински университет във Варшава, Banacha 1B, 02-097 Варшава, Полша
Резюме
Затлъстяването е признато, че увеличава риска от такива заболявания като сърдечно-съдови заболявания, диабет и рак. Това показва, че затлъстяването може да повлияе на стабилността на генома. Оксидативният стрес и възпаление, често срещани при затлъстяване, могат да предизвикат увреждане на ДНК и да инхибират механизмите за възстановяване на ДНК. Натрупването на увреждане на ДНК може да доведе до повишена скорост на мутация и може да промени генната експресия, което води до нарушения в клетъчния метаболизъм. Увреждането на ДНК, свързано със затлъстяването, може да насърчи растежа на рака, като благоприятства разпространението и миграцията на раковите клетки и устойчивостта на апоптоза. Оценката на увреждането на ДНК и/или нарушенията в възстановяването на ДНК може да бъде потенциално полезна при оценката на риска и профилактиката на свързаните със затлъстяването метаболитни нарушения, както и ракови заболявания. Увреждането на ДНК при хора със затлъстяване изглежда обратимо и както загубата на тегло, така и подобряването на хранителните навици и състава на диетата могат да повлияят на стабилността на генома.
1. Въведение
Нарастващото разпространение на затлъстяването се превърна в основен здравословен проблем при възрастните, както и сред децата и юношите. Затлъстяването е сложно хронично заболяване, характеризиращо се със значително увеличаване на телесната мастна тъкан и е свързано с нарушения в метаболизма на липидите и глюкозата, хронично възпаление и оксидативен стрес и повишен риск от няколко заболявания, най-вече сърдечно-съдови заболявания, диабет, и ракови заболявания, и с намаляване на продължителността на живота [1,2,3]. При хора със затлъстяване се съобщава за натрупване на увреждания на ДНК и се предполага, че участват в развитието на свързано със затлъстяването заболяване [4,5,6]. ДНК лезиите оказват въздействие върху репликацията на ДНК, което води до мутации и по този начин може да създаде опасност за клетъчния метаболизъм и клетъчното оцеляване [7]. Установено е, че загубата на телесно тегло води до намаляване на нивото на увреждане на ДНК [8].
Целта на тази статия е да подчертае затлъстяването като ДНК увреждащ фактор и да представи връзката между затлъстяването, увреждането на ДНК и развитието на метаболитни нарушения и рака.
2. Възпаление и реактивни видове кислород (ROS), предизвикани от увреждане на ДНК
Възпалението се активира, за да предпази тялото от тези вредни стимули [9]. Хроничното възпаление е свързано със стареенето и множество хронични заболявания като сърдечно-съдови заболявания, автоимунни заболявания и рак [10,11]. Провъзпалителният сигнал набира и активира неутрофили и макрофаги и от своя страна се създават ендогенни видове кислород и азот. Освен това, реактивните кислородни видове (ROS) също се образуват в клетките по време на митохондриалния окислителен метаболизъм, апоптозата или ензимната реакция на никотинамид аденин динуклеотид фосфат (NADPH) оксидази, супероксид дисмутаза (SOD), миелопероксидаза (MPO) и азотен оксид синтаза (NOS) [12].
Въпреки наличието на специфичната защитна система срещу радикали, постоянното производство на АФК и ниската антиоксидантна активност могат да доведат до загуба на баланс между образуването на АФК и работата на защитна система, което води до развитие на оксидативен стрес. Повишеното производство на ROS и оксидативният стрес могат да предизвикат ендогенно увреждане на ДНК, прекъсване на транскрипцията и да предизвикат спиране на клетъчния цикъл [13,14]. Процесите на пероксидация на липидите също се индуцират от ROS и водят до образуването на ДНК реактивни лезии [15].
3. Ремонт на ДНК щети
Системата за възстановяване на ДНК съществува, за да преодолее увреждането на ДНК и да поддържа целостта на структурата на ДНК. По принцип процесът на възстановяване на увреждане на ДНК включва разпознаване на увреждане на ДНК от специфични сензори, генериране и усилване на сигнала за увреждане на ДНК, трансдукция на този сигнал към цитоплазмата и активиране на специфични ефектори [21]. Описани са междуиндивидуални вариации в активността на ензимите, които участват в пътищата за възстановяване на ДНК [22,23]. Следователно могат да се очакват някои разлики в ефективността на възстановяването на ДНК и наблюдаваните нива на ендогенно увреждане на ДНК [24,25].
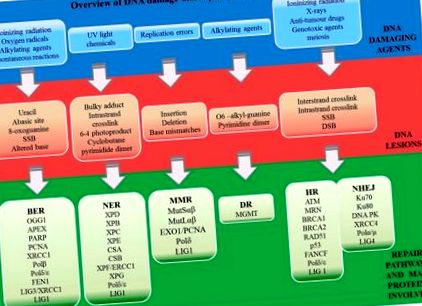
Сред няколко известни механизма за възстановяване на ДНК, директното възстановяване се случва по време на репликацията, докато непрякото възстановяване се извършва след синтеза на ДНК [26]. Стратегията за непряко възстановяване включва основно изрязване (BER), възстановяване на изрязване на нуклеотиди (NER), възстановяване на несъответствие (MMR), нехомологично свързване в края (NHEJ) и хомоложна рекомбинация (HR). Обяснението на пътищата, свързани с възстановяването на ДНК от трима учени бе признато, като им се присъди Нобелова награда за химия през 2015 г. [27]. Томаш Линдал описа модела на BER, който участва в ремонта на модифицирани бази [28]. Пол Модрич откри отделен път, който открива и премахва основи, които са неправилно включени по време на репликацията на ДНК. Накрая, Aziz Sancar предложи механизма за отстраняване на ДНК адукти NER [29]. Преглед на ДНК увреждащите агенти, индуцираните ДНК лезии и техните пътища за възстановяване е представен на Фигура 1 .
Преглед на агентите, увреждащи ДНК, индуцирани ДНК лезии и техните пътища за възстановяване (BER - възстановяване на ексцизия на базата, NER - възстановяване на ексцизия на нуклеотиди, MMR - поправка на несъответствие, DR - директно възстановяване, NHEJ - нехомологично свързване в края; рекомбинация). Преките пътища са обяснени в раздела за съкращения.
4. Затлъстяване и увреждане на ДНК
При хора със затлъстяване е наблюдаван широк спектър от ДНК лезии като двуверижни прекъсвания (DSB), едноверижни прекъсвания (SSB) или окислени основи и около 2 пъти по-голямо увреждане на ДНК в лимфоцитите, отколкото при пациенти с нормално тегло и корелация между индекса на телесна маса (BMI) и увреждане на ДНК също е установено [5,30,31]. Значителна разлика в нивата на увреждане на ДНК, измерено чрез фосфорилиране на H2AX, се наблюдава и при деца с наднормено тегло и затлъстяване в сравнение с постните контроли [32]. Лимфоцитите от хора със затлъстяване са имали повече индуцирани от митомицин С увреждания на ДНК в сравнение с клетки от пациенти с нормално тегло [33]. Наличните данни относно връзката между затлъстяването и нивата на окислени основи в ДНК като 8-oxodG и 8-OHdG са противоречиви [34,35,36,37].
Добре е прието, че при затлъстяването хроничното енергийно претоварване води до засилено производство на ROS и възпаление [38]. Наличните данни показват, че източникът на ROS може да се различава в зависимост от етапа на затлъстяване [39]. В ранните етапи на затлъстяването увеличеното усвояване на адипоцити от глюкоза и мастни киселини активира NOX4, основната изоформа на NADPH оксидаза в адипоцитите, и индуцира производството на ROS. Съобщава се, че заглушаването на NOX4 намалява генерирането на ROS и инхибирането на моноцитен хемоаттрактант протеин-1 [40]. Прекомерното натрупване на мазнини в адипоцитите насърчава производството на възпалителни адипокини. Провъзпалителните цитокини индуцират инвазия в прицелната тъкан от имунни клетки и развитие на хронично възпаление [41]. Натрупването на Т-лимфоцити и макрофаги в мастната тъкан по време на развитието на затлъстяването насърчава производството на ROS от NOX2, NADPH оксидазата, експресирана във възпалителни клетки. В допълнение, адипоцитите и гладкомускулните клетки, изложени на висока FFA (свободна мастна киселина) или висока концентрация на глюкоза, показват повишено митохондриално делене и повишено производство на ROS на митохондриите [42,43,44]. Характерно за затлъстяването прекомерното натрупване на триглицериди в адипоцитите води до засилено митохондриално β-окисление на FFA и повишено генериране на ROS на митохондриите.
Освен това, хроничното възпаление, свързано със затлъстяването, е силно свързано с образуването на ДНК лезия [38]. Активираните макрофаги секретират цитокини като TNFα и IL-6, които могат да предизвикат увреждане на ДНК в нецелена тъкан, отдалечена от мястото на възпаление [45,46]. Освободените цитокини могат да пътуват до различни области на тялото и да активират резидентни макрофаги, за да произвеждат възпалителни молекули като COX2, NOS, супероксид, ROS и NO [47,48]. Освобождаването на тези молекули може да доведе до окислително увреждане на ДНК в клетките. Също така, макрофагите, които трябва да абсорбират апоптотични клетки, могат да се преместят в друга област на тялото и след това да освободят фактори, предизвикващи увреждане на ДНК [49]. Транслокацията на ДНК увреждащи фактори чрез макрофаги може да достави голямо количество сигнали, причиняващи увреждане от отдалечени места, а също така може да бъде специфична за региони, където макрофагите вероятно ще пътуват (напр. Черва, далак, кожа, лимфни възли). По този начин свързаният със затлъстяването оксидативен стрес и възпаление могат да предизвикат увреждане на ДНК в различни тъкани.
Публикуваните интервенционни следи за отслабване при затлъстели, при които е извършена оценка на увреждането на ДНК, са ограничени. Установено е значително намаляване на нивата на увреждане на ДНК след нискокалорична загуба на тегло, причинена от диета [8,50]. Подобряване на геномната стабилност, характеризиращо се с намаляване на окислителното увреждане в слюнката, се наблюдава и след бариатрична хирургия, свързана със загуба на тегло при пациенти с морбидно затлъстяване [51].
4.1. Възстановяване на увреждане на затлъстяването и ДНК
Съобщава се за смущения в пътя на реакция на увреждане на ДНК, свързани с повишено повишено телесно тегло [52]. Открита е обратна връзка между ИТМ и капацитет за възстановяване на ексцизия на нуклеотиди (NER) при млади жени [53]. Присъствието на затлъстяване също беше признато за промяна на възстановяването на DSBs, индуцирани от генотоксични агенти [34]. Свързаното със затлъстяването подобрено производство на ROS може да модулира реакцията на увреждане на ДНК чрез въздействието върху експресията на гени, участващи в възстановяването на ДНК (Фигура 2) [54,55]. Съобщава се за инхибиране на ензимите за възстановяване на ДНК, провокирани от оксидативния стрес [56,57]. При затлъстели алтер експресия на гени, свързани с реакция на стрес и токсични агенти също са разпознати [58].
Затлъстяване и увреждане на ДНК. Затлъстяването е свързано с възпаление и оксидативен стрес, който предизвиква увреждане на ДНК и инхибира възстановяването на увреждане на ДНК, което води до натрупване на увреждане на ДНК в адипоцитите и други тъкани.
4.2. Затлъстяване и увреждане на ДНК на митохондриите
ДНК лезии се срещат както в ядрената, така и в митохондриалната ДНК (mtDNA). Поради липсата на механизъм за възстановяване на нуклеотидна ексцизия в митохондриите, mtDNA е по-податлива на увреждане, причинено от реактивни видове, отколкото ядрената ДНК. Фотодимерите и обемистите адукти, възникващи в резултат на оксидативен стрес, свързан с възпаление и фактори на околната среда, не се отстраняват ефективно от mtDNA [66,67]. Въпреки че mtDNA кодира само 1% от митохондриалните протеини, митохондриалните заболявания са свързани с голям брой лезии в mtDNA [68]. В допълнение, засиленото разграждане на mtDNA и намаляването на броя на mtDNA копия са свързани и с диабет, рак или невродегенеративни заболявания [69,70,71]. Натрупването на окислителни лезии на mtDNA може да доведе до пренареждане или точкови мутации, които могат да бъдат наследствени по майчина линия [72].
При затлъстяване митохондриалната дисфункция води до неуспех в окисляването на мастните киселини (FA) и нарушения в хомеостазата на глюкозата [43,73,74]. Установено е, че повишената екскреция на урина с mtDNA при пациенти със затлъстяване е значително намалена след бариатрична хирургия, свързана със загуба на тегло [75]. Проучването при животни показва, че при мишки, хранени с високо съдържание на мазнини, увреждането на mtDNA се увеличава и е свързано с митохондриална дисфункция [76]. Освен това беше установено, че окислената mtDNA индуцира синтез на възпалителни цитокини като IL-6, TNF-α, pro-IL-1β чрез активиране на тол-подобен рецептор 9 (TLR-9) [77,78]. Следователно свързаното със затлъстяването възпаление може да бъде отчасти както причина, така и последица от натрупването на лезии на mtDNA.
4.3. Ефект на увреждане на ДНК, свързано с родителското затлъстяване, върху потомството
Свързаното със затлъстяването увреждане на ДНК може поне отчасти да реагира на нарушения в репродуктивния капацитет на затлъстелите субекти и здравето на тяхното потомство [79]. Установено е, че затлъстяването причинява фрагментация на ДНК на сперматозоиди, повлиява метилирането на ДНК и причинява отклонения в хроматина в мъжките зародишни клетки [80,81]. При пациенти със затлъстяване е признат висок индекс на фрагментация на ДНК (DFI) в сперматозоидите и намалена плодовитост [82,83]. Увреждането на ДНК в зародишните клетки може да е резултат от повишено производство на ROS, характерно за затлъстяването [59,84,85]. ДНК увреждане е налице в дъщерните клетки след последващо клетъчно делене, което показва неефективна реакция на увреждане на ДНК [86]. Следователно се подозира, че появата на ДНК лезии в зародишните клетки може да се предаде на генома на бъдещите поколения [87]. Затлъстяването на майката може да причини de novo мутации в ембриона, да промени състоянието на метилиране на гените в ембриона и чрез miRNA да повлияе на експресията на ембрионални протеини [88,89,90,91].
5. ДНК увреждане и метаболитни нарушения, свързани със затлъстяването
Няма съмнение, че затлъстяването е свързано с оксидативен стрес, причиняващ увреждане на ДНК. Известно е, че възстановяването на окислени, наситени и пръстено-фрагментирани основи чрез BER пътя е от решаващо значение за поддържане на геномната стабилност. От друга страна, беше показана важна роля на протеините за възстановяване на ДНК в модулирането на митохондриалната енергия и енергийния баланс на цялото тяло [116]. Продукти от такива гени като OGG1, NTH1, NEIL1 и NEIL2 участват в инициирането на възстановяване на окислителни ДНК лезии. NEIL1 е ензим, който инициира BER на пръстено-фрагментирани пурини и някои наситени пиримидини [117,118]. Мишките нокаут neil1 развиват симптоми, съответстващи на метаболитния синдром: тежко затлъстяване, затлъстяване на черния дроб, дислипидемия и инсулинова резистентност [119]. OGG1, критичен ензим за възстановителния път на BER, участва в възстановяването на най-често срещаната окислителна ДНК лезия, тъй като експресията на 8-оксо-7,8-дихидрогуанин (8-oxoG) и OGG1 се индуцира в отговор на диета с високо съдържание на мазнини [120]. Мишки без липса на OGG1 (Ogg1 -/-) развиха характеристики на метаболитния синдром, включително повишено затлъстяване, затлъстяване на черния дроб, повишени триглицериди и нарушен глюкозен толеранс [116].
Следователно затлъстяването може да предизвика увреждане на ДНК и нарушения в възстановяването на ДНК, което води до клетъчно натрупване на увреждане на ДНК, което причинява възпаление и промени в генната експресия и нарушения в клетъчния метаболизъм (Фигура 3). В резултат на тези промени могат да се развият метаболитни нарушения и намаляването на увреждането на ДНК може да бъде важно за профилактика и лечение на метаболитни заболявания, свързани със затлъстяването [5,121].
- Ново лекарство предотвратява увреждането на черния дроб, затлъстяването и непоносимостта към глюкоза при мишки на диета с високо съдържание на мазнини
- Ново лекарство предотвратява увреждането на черния дроб, затлъстяването и непоносимостта към глюкоза при мишки на диета с високо съдържание на мазнини
- Панел за разработване на насоки на APA за затлъстяване
- Ново лекарство предотвратява увреждането на черния дроб, затлъстяването и непоносимостта към глюкоза при мишки на диета с високо съдържание на мазнини
- Паразитните червеи могат да помогнат за лечение на заболявания, свързани със затлъстяването - ScienceDaily