Матей Орешич
1 Системна биология и биоинформатика, VTT Център за технически изследвания на Финландия, Еспоо, FIN-02044 VTT, Финландия
Резюме
Първичното затлъстяване и психотичните разстройства са сходни по отношение на свързаните с тях промени в енергийния баланс и съпътстващите заболявания, включително метаболитен синдром. Такива прилики не показват непременно причинно-следствени връзки, но вместо това предполагат, че специфични причини и метаболитни нарушения, свързани със затлъстяването, играят патогенна роля в развитието на съпътстващи заболявания, потенциално дори преди да се развие затлъстяването. Метаболомиката - систематичното изследване на метаболитите, които са малки молекули, генерирани в процеса на метаболизма - е важна за изясняването на пътищата, лежащи в основата на свързаните със затлъстяването съпътстващи заболявания. Този преглед обхваща как последните метаболомични проучвания са напреднали в откриването на биомаркери и изясняването на механизмите, залегнали в основата на затлъстяването и неговите съпътстващи заболявания, със специфичен фокус върху метаболитния синдром и психотичните разстройства. Подчертава се значението на идентифицирането на метаболитни маркери на междинни фенотипове, свързани с болести - признаци, модулирани, но не кодирани от ДНК последователността. Такива маркери биха били приложими като диагностични инструменти в персонализирано здравно заведение и биха могли също така да разкрият нови терапевтични възможности.
Въведение
Затлъстяването се характеризира с излишни телесни мазнини, които се съхраняват предимно в мастната тъкан. Преобладаването на затлъстяването и свързаните с него съпътстващи заболявания - включително неалкохолна мастна чернодробна болест (NAFLD), диабет тип 2 и сърдечно-съдови заболявания - непрекъснато се увеличава през последните 40-50 години, подчертавайки патогенната значимост на обезогенната среда (Catenacci и др., 2009). Тъй като затлъстяването, инсулиновата резистентност, диабетът, дислипидемията и затлъстяването на черния дроб са склонни да се срещат едновременно при един и същ индивид, беше полезно да се нарече този клъстер от прояви като „метаболитен синдром“. Групирането на тези патологии не се счита за случайно събитие: по-скоро те вероятно имат общи патогенни механизми. Тъй като нашите информационни технологии стават все по-усъвършенствани и епидемиологичните данни за пациентите се интегрират по-добре, нашето разбиране за метаболитния синдром постепенно се обогатява. По-специално, сега е ясно, че има голямо разпространение на метаболитни нарушения при лица с шизофрения и други психотични разстройства (Saarni et al., 2009; Suvisaari et al., 2007). По този начин патогенните механизми, участващи в метаболитния синдром, също могат да допринесат за развитието и/или ускоряването на тези психиатрични разстройства (въпреки че обратното също може да е вярно).
Сложните заболявания имат безспорно силен генетичен компонент. Например, наследствеността се изчислява на 40% или повече за метаболитен синдром (Lusis et al., 2008) и 65% или повече за шизофрения (Lichtenstein et al., 2009). Въпреки това става все по-очевидно, че настоящите подходи, използвани за изследване на генетични асоциации с болестни черти, обясняват само малка част от известната наследственост на болестта (Maher, 2008). Според схващането за системна биология, по-голямата част от генетичния компонент на възприемчивостта на сложните заболявания не е отделни гени, а във взаимодействието им с други гени и с околната среда (Tang et al., 2009). В този контекст измерването на признаци, които са модулирани, но не са кодирани от ДНК последователността - обикновено наричани междинни фенотипове (Meyer-Lindenberg and Weinberger, 2006) - представлява особен интерес.
Промените в концентрацията на специфични групи метаболити (малки молекули, генерирани в процеса на метаболизъм) са чувствителни и специфични за патологично значими фактори като генетични вариации (Illig et al., 2010), диета (Holmes et al., 2008), развитие (Nikkilä et al., 2008), възраст (Maeba et al., 2007), състояние на имунната система (Oresic et al., 2008b) и чревна микробиота (Martin et al., 2007; Velagapudi et al., 2010). Въпреки че значението на изучаването на метаболитите в контекста на здравето и болестите е било признато преди десетилетия (Pauling et al., 1971), аналитични инструменти преди това не са били на разположение за цялостно изследване на метаболитите. Това се е променило през последното десетилетие с няколко важни постижения в аналитичните и биоинформатичните технологии, които позволяват чувствителното и цялостно измерване на метаболитите в биологичните системи (Goodacre et al., 2004; Katajamaa and Oresic, 2007). По този начин метаболомиката - глобалното изследване на метаболитите - бързо се очертава като мощен инструмент за характеризиране на сложни фенотипове и идентифициране на биомаркери на специфични физиологични отговори (Oresic et al., 2006). Забележително е, че метаболомът е чувствителен както към генетични фактори, така и към фактори на околната среда, което прави метаболомиката мощен инструмент за фенотипизиране на персонализирана медицина.
Тази статия предоставя кратък преглед на неотдавнашния напредък в метаболомиката, приложен към откриването на биомаркери и изясняването на механизмите, залегнали в основата на затлъстяването и съпътстващите му заболявания, със специфичен акцент върху метаболитния синдром и психотичните разстройства.
Оценка на индивидите спрямо популациите
Смята се, че метаболитната дисфункция може да възникне отчасти от липотоксичността, причинена от приема на липиди, която надвишава това, което мастната тъкан на индивида може да съхранява (Unger, 1997; Virtue and Vidal-Puig, 2010). Капацитетът на мастната тъкан да съхранява липиди зависи от генетичните и екологичните фактори. Има убедителни доказателства от епидемиологични проучвания, че има почти линейна връзка между телесното тегло (т.е. съхранение на липиди) и инсулиновата резистентност. Подобна асоциация обаче може да се дължи на „ефекта на усредняване“ на общ популационен анализ. Хипотезата за разширяемостта на мастната тъкан предполага, че за всеки индивид има праг за телесно тегло, който зависи от способността на мастната тъкан на този индивид да съхранява липиди (Virtue and Vidal-Puig, 2008). Превишаването на този праг на телесно тегло е придружено от значително намаляване на инсулиновата чувствителност поради претоварване на липидите и техния поток към други периферни органи. Според тази хипотеза нарастването на телесното тегло все още ще се свързва линейно с инсулиновата чувствителност, средно. Въпреки това, информацията за прага на разширяемост на мастната тъкан на всеки индивид се губи при популационен анализ.
Традиционно молекулярните биомаркери като тези, получени чрез метаболомика, се свързват със специфични клинични крайни точки в епидемиологичните проучвания. Такива маркери могат да се представят статистически добре при големи популационни настройки, но, както е обяснено по-горе, може да имат малка стойност, когато се прилагат към индивиди. Вместо това биомаркерите трябва да са чувствителни към специфичната за органите генетична уязвимост и към специфични патофизиологични механизми, водещи до усложнения, свързани със затлъстяването. Например, биомаркер, който е чувствителен към метаболитния статус на мастната тъкан, може да се използва за идентифициране на индивиди, чиито адипоцити са близо до достигане на капацитет за съхранение на липиди - и поради това са изложени на риск от развитие на инсулинова резистентност поради повишеното телесно тегло. Намирането на такива биомаркери би предоставило мощни инструменти за откриване на лица в риск много по-рано, отколкото е възможно в момента, и би подобрило персонализираното здравеопазване.
Липидомът в здравето и болестите
Липсват чувствителни платформи за глобални и количествени изследвания на липиди от клетъчно до организма. Наскоро обаче „липидомиката“ се появи като дисциплина, тясно свързана с метаболомиката; този подход оценява глобално липидомите, включващи пътища и мрежи от клетъчни липиди в биологични системи (Oresic et al., 2008a). Липидите са разнообразна група от основни метаболити с много ключови биологични функции, като например действащи като структурни компоненти на клетъчните мембрани, източници за съхранение на енергия и междинни продукти в сигналните пътища. Липидите са под строг хомеостатичен контрол (Oresic et al., 2008a) и проявяват пространствена и динамична сложност на множество нива. Следователно не е изненадващо, че промененият липиден метаболизъм има глобален обхват като патогенен механизъм и участва в диабет и индуцирана от липотоксичност инсулинова резистентност (Medina-Gomez et al., 2007; Medina-Gomez et al., 2009; Unger, 1997 ), Болест на Алцхаймер (Han et al., 2001; Oresic et al., 2011a), шизофрения (Kaddurah-Daouk et al., 2007; Oresic et al., 2012; Oresic et al., 2011b; Schwarz et al., 2008), рак (Hilvo et al., 2011) и атеросклероза (Lusis, 2000).
Липидомиката се счита за една от ключовите технологии за изследване на метаболитните нарушения. Например липотоксичността се характеризира с свръхпроизводство на реактивни (липо) токсични липиди като керамиди и диацилглицероли в периферните органи. Това се случва поради увеличения поток на мастни киселини от мастната тъкан - т.е., защото способността на индивида да съхранява мазнини в мастната си тъкан е надвишена (Virtue and Vidal-Puig, 2010). Следователно когато се характеризират липидните профили на метаболитните органи като черен дроб или мускули, не е достатъчно да се измери количеството липиди в тези органи; необходимо е да се вземе предвид и качеството на липидите - тоест да се изследва подробният молекулярен състав на липидите в тъканта. Такава информация може да бъде получена чрез липидомика.
Откриване на ранни маркери на метаболитни нарушения
Определянето на метаболитните профили, свързани със затлъстяването и неговите метаболитни съпътстващи заболявания е активна област на изследване. Например, мащабно метаболомично проучване на връзката между инсулиновата чувствителност и кохортата на сърдечно-съдовите заболявания (RISC) идентифицира а-хидроксибутират като ранен маркер на инсулиновата резистентност (Gall et al., 2010). Няколко други проучвания също свързват повишените концентрации на аминокиселини с разклонена верига в циркулацията с инсулинова резистентност и риск от захарен диабет (Newgard et al., 2009; Pietiläinen et al., 2008; Wang et al., 2011). Липидомичните проучвания също така разкриват, че триглицеридите с по-ниско въглеродно число и съдържание на двойна връзка са свързани с инсулинова резистентност (Kotronen et al., 2009b), висока чернодробна мазнина (Kotronen et al., 2009a; Westerbacka et al., 2010) и диабет риск (Rhee et al., 2011).
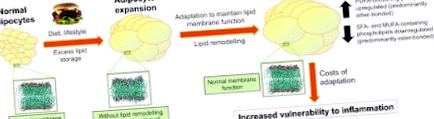
Модел за физиологично регулиране на състава на липидната мембрана при затлъстяване. При здравословно затлъстяване липидните мембрани се адаптират, когато адипоцитите се разширяват по размер. Като се има предвид, че адаптацията изглежда включва относително увеличаване на предшествениците на провъзпалителни медиатори, адаптацията може да увеличи уязвимостта към възпаление. MUFA, мононенаситена мастна киселина; PUFA, полиненаситени мастни киселини; SFA, наситена мастна киселина. Възпроизведено с разрешение (Pietiläinen et al., 2011).
По-специално, видовете липиди, натрупани в мембраните на адипоцитите при затлъстелите близнаци, са предшественици на провъзпалителни липидни медиатори като левкотриени и простагландини (Murphy, 2001). По този начин, въпреки че мембранното липидно ремоделиране при метаболитно компенсирани затлъстели лица може да помогне за поддържане на нормалната мембранна функция, това може също да направи мастната тъкан по-уязвима към възпаление. Тези открития могат да обяснят защо хората със затлъстяване са изложени на по-висок риск от развитие на възпалителни разстройства като захарен диабет.
Резултатите от това изследване на близнаци предполагат, че мембраните на адипоцитите съдържат улики за ранните патофизиологични процеси на свързаните със затлъстяването съпътстващи заболявания. Следователно измерването на липидите на мембранната мастна тъкан или техните корелати в кръвта като междинен фенотип може да осигури мощни ранни маркери. Изследването също така предполага, че могат да възникнат нови възможности за профилактика или лечение на метаболитни усложнения, свързани със затлъстяването, ако е възможно да се модулира липидната мрежа на мастната тъкан, за да се регулира функционалната поддръжка на мембраната и/или уязвимостта към възпаление.
Черният дроб е друг ключов метаболитен орган, за който е известно, че е свързан с риск от диабет. NAFLD, водещ до хронично чернодробно заболяване и чернодробна недостатъчност, се характеризира с отлагане на мазнини в черния дроб, главно под формата на триглицериди. Разпространението на NAFLD при възрастни в Съединените щати се е удвоило от 5,51% на 11,01% между 1988 и 2008 г. и може да достигне епидемични размери, ако настоящите нива на затлъстяване и диабет продължат да ескалират (Younossi et al., 2011). Освен това, чернодробните мазнини са основен фактор, определящ метаболитния синдром (Cohen et al., 2011; Kotronen and Yki-Järvinen, 2008; Van Gaal et al., 2006).
Чернодробните мазнини обикновено се определят чрез хистология или се изчисляват чрез магнитно-резонансна спектроскопия. Първият метод е силно инвазивен, изисква чернодробна биопсия, така че се прилага само при хронични чернодробни състояния, докато вторият метод е твърде скъп за целите на медицинския скрининг. Неинвазивен тест, който би могъл да се приложи широко в здравни заведения, не е налице, така че е спешно необходимо да се идентифицират молекулярни маркери, които присъстват в кръвта, отразяващи количеството мазнини в черния дроб с висока чувствителност. Обнадеждаващо, предварителните липидомични и метаболомични проучвания вече дават надежда, че скоро може да бъдат разкрити надеждни биомаркери, свързани с NAFLD (Barr et al., 2010; Puri et al., 2007).
Оценка на съпътстващите заболявания при затлъстяване извън метаболитния синдром
Връзката между затлъстяването и психотичните разстройства е друга област на нарастващ изследователски интерес (Kaidanovich-Beilin et al., 2012). Психотичните разстройства са психични разстройства, характеризиращи се с нарушено тестване на реалността или изкривяване на реалността. Психотичните симптоми включват заблуди, халюцинации, дезорганизирана реч и причудливо или кататонично поведение. Честотата на психотичните разстройства достига връх в младата зряла възраст (Suvisaari et al., 1999), период на развитие, когато се наблюдават значителни промени в състава на мастните киселини в мозъчната кора поради аксоналната миелинизация. Доживотното разпространение на тези нарушения е 3,5%, а най-често срещаната е шизофренията, която има доживотно разпространение ∼1% (Perälä et al., 2007).
Заключения
Има спешна необходимост от идентифициране на молекулярни маркери, които ще позволят ранно откриване на патофизиологичните процеси, водещи до съпътстващите заболявания на затлъстяването. Въпреки че епидемиологичните проучвания откриват връзки между специфични рискови фактори на заболяването на популационно ниво, необходимо е по-голямо внимание върху идентифицирането и разбирането на междинните фенотипове, свързани с болестта, и техните маркери при индивидите. Маркерите на съответните междинни фенотипове биха били по-приложими в персонализираните здравни заведения, отколкото свързаните с болестта рискови фактори, придобити от общ скрининг на населението, тъй като те биха могли да открият наличието на специфичен патофизиологичен процес, свързан с болестта, протичащ при индивида. Освен това изясняването на междинните фенотипове и техните маркери може да доведе до нови терапевтични и диагностични стратегии за свързаните със затлъстяването съпътстващи заболявания, включително диабет, както и други заболявания, включително рак, болест на Алцхаймер и психични разстройства.
Благодарности
Авторът е благодарен на Антонио Видал-Пуиг, Селсо Аранго и Яана Сувисаари за полезни дискусии.
Бележки под линия
Тази статия е част от специален брой за затлъстяването: вижте свързани статии в том. 5, брой 5 на Дис. Модел. Мех. на http://dmm.biologists.org/content/5/5.toc.
КОНКУРЕНТНИ ИНТЕРЕСИ
Авторът декларира, че нямат никакви финансови или конкуриращи се интереси.
ФИНАНСИРАНЕ
Тази работа беше подкрепена от Центъра за върхови постижения на Академията на Финландия в областта на изследванията на имунологията и физиологията на молекулярните системи (SyMMyS, 2012–2017, Решение № 250114) и от проекта „Характеризиране и моделиране на хранителни ефекти, медиирани от чревната микробиота върху липидния метаболизъм“, който беше подкрепен от Европейската комисия в рамките на 7-ма рамкова програма (договор FP7-KBBE-222639).
- PRIME PubMed Връзката между коремните мазнини, затлъстяването и резултатите от често срещаните психични разстройства
- Нарушения на устата Чести проблеми с устата MedlinePlus
- Затлъстяване и рак на панкреаса Актуализация на епидемиологичните доказателства и молекулярните механизми -
- Механизми за затлъстяване и рак Туморна микросреда и възпаление Вестник по клинична онкология
- ЗАТЪЛВАНЕ И НАРУШЕНИЯ НА ЕТАЖА НА ТЕЛКА ПРЕГЛЕД НА ЛИТЕРАТУРАТА