Джузепина Паладини
1 Катедра по вътрешни болести и терапия, Университет в Павия, Павия, Италия
2 Fondazione IRCCS Policlinico S. Matteo, Университет на Павия, Павия, Италия
Лора Г. Ди Паскуа
1 Катедра по вътрешни болести и терапия, Университет в Павия, Павия, Италия
Клариса Берардо
1 Катедра по вътрешни болести и терапия, Университет в Павия, Павия, Италия
Вероника Сицилиано
1 Катедра по вътрешни болести и терапия, Университет в Павия, Павия, Италия
Плинио Ричелми
1 Катедра по вътрешни болести и терапия, Университет в Павия, Павия, Италия
Стефано Перлини
1 Катедра по вътрешни болести и терапия, Университет в Павия, Павия, Италия
2 Fondazione IRCCS Policlinico S. Matteo, Университет на Павия, Павия, Италия
Андреа Фериньо
1 Катедра по вътрешни болести и терапия, Университет в Павия, Павия, Италия
Марияпия Вайрети
1 Катедра по вътрешни болести и терапия, Университет в Павия, Павия, Италия
Свързани данни
Данните, използвани в подкрепа на констатациите от това проучване, са достъпни от съответния автор при поискване.
Резюме
1. Въведение
Сред възникващите метаболитни хронични чернодробни заболявания неалкохолната мастна чернодробна болест (NAFLD) и нейната по-напреднала форма, неалкохолен стеатохепатит (NASH), се превръщат в основен проблем на общественото здраве в индустриализираните страни [1, 2]. Изчисленото разпространение в световен мащаб е 4-46% за NAFLD и 3% -5% за NASH [3]. Най-голямото разпространение на NAFLD се наблюдава в западните страни (17% до 46%), където е готово да се превърне в най-важната причина за заболеваемост и смъртност при хронични чернодробни заболявания [2, 4].
Животинските модели са основен инструмент за идентифициране на механизмите, движещи патогенезата и прогресирането на NAFLD към NASH. В идеалния случай експерименталните модели трябва да отразяват етиологията, прогресията на болестта и патологията на NAFLD при човека. За съжаление, наличните в момента модели, MCD диета, западна диета и диета с високо съдържание на мазнини, се допълват и всеки от тях отразява частично реалната картина на NAFLD при човека [5]. Наличните експериментални модели могат да бъдат класифицирани в генетични и хранителни: основният генетичен модел е Zucker плъх (fa/fa), генетичен модел на метаболитен синдром със затлъстяване, докато най-често използваният хранителен модел използва диета с дефицит на метионин и холин (MCD диета) [5]. Това е много възпроизводим модел, който последователно индуцира фенотип на тежък NASH след 8 седмици на приложение [6].
Чернодробният паренхим показва функционална организация, известна като метаболитна зоналност: хепатоцитите, наредени между синусоидите по портоцентралната ос, показват структурна и функционална хетерогенност [7]. В допълнение обаче има все повече доказателства за функционална хетерогенност в отделните чернодробни лобове, разкриващи необяснима междулобуларна вариабилност, както е показано от хетерогенно разпределение на щетите при сравняване на различни лобове [8]. Много разлики между чернодробните лобове се откриват при няколко чернодробни заболявания и токсични увреждания като химическа канцерогенеза, цироза и токсичност на ацетаминофен [9-11]. По-рано демонстрирахме, че функционална лобарна хетерогенност на черния дроб съществува при модели на животни с исхемия/реперфузия и обструктивна холестаза, което показва, че различни събития като модулация на извънклетъчната матрица (ECM) и оксидативен стрес възникват с различна интензивност в чернодробните лобове [12, 13].
Целта на настоящото проучване беше да се изследва предполагаемата хетерогенност на чернодробните лобове при модели на неалкохолна мастна чернодробна болест (NAFLD) и неалкохолен стеатохепатит (NASH), по отношение на промяна на ECM, активността на матричната металопротеиназа (MMP) и специфични инхибитори (TIMP) и на съдържанието на оксидативен стрес, образуване на ROS и TBARS.
2. Материал и методи
2.1. Животни
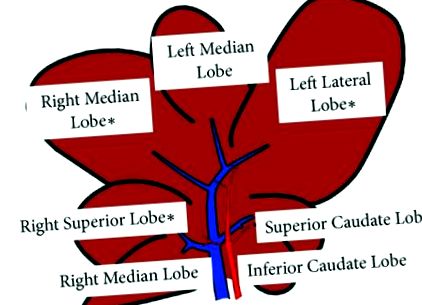
Zucker плъховете представляват добре характеризиран модел на NAFLD. Използвани са четиринадесет 11-седмични мъжки плъхове със затлъстяване (fa/fa) Zucker и слаби възрасти (fa/-). Животните (n = 7 всяка група) са доставени от Charles River, Италия. Най-широко използваната диета за индуциране на NASH е диетата с дефицит на метионин-холин (MCD). Четиринадесет 8-седмични мъжки плъхове Wistar са били хранени с MCD диета (Laboratorio Dottori Piccioni, Милано, Италия) или с изокалорична диета, допълнена с холин и метионин (Control) в продължение на 8 седмици. Животните (n = 7 всяка група) са доставени от Charles River, Италия. Използваните модели на животни бяха одобрени от италианското министерство на здравеопазването и от местната университетска комисия за грижа за животните (Документ номер 2/2012). По време на жертвоприношението, на базата на лобарна структура на плъхове, наскоро описана от Sanger et al. [14], чернодробни проби от горния десен лоб (RL), десния среден лоб (ML) и страничния ляв лоб (LL) бяха събрани и щракани замразени в течен азот (Фигура 1); серумни кръвни проби също бяха събрани.
Графично (схематично) представяне на чернодробни лобове. Бяха събрани чернодробни проби (∗) от горния десен лоб (RL), десния среден лоб (ML) и страничния ляв лоб (LL).
2.2. Анализи
Чернодробното увреждане се оценява чрез серумна оценка на нивата на аланин трансаминаза (ALT) и аспартат трансаминаза (AST) с помощта на търговски комплект (Sigma). Серумните нива на TNF-алфа бяха оценени чрез търговски комплект ELISA в съответствие с производствените процедури (R&D Systems, Minneapolis, MN). Определянето на чернодробните реактивни кислородни видове (ROS) е последвано от превръщането на 2 ′, 7′-дихлорфлуоресцеин диацетат (H2DCFDA) във флуоресцентен 2 ′, 7′-дихлорфлуоресцеин (DCF), както е описано по-горе [15]. Степента на липидно пероксидация по отношение на образуването на реагиращи с тиобарбитурова киселина вещества (TBARS) беше измерена, както е описано по-рано [16].
2.3. Източници на тъкани и изолиране на чернодробни протеини
След умъртвяването чернодробните дялове бързо се изрязват и се поставят в студен (4 ° С) буфер (30 тМ хистидин, 250 тМ захароза, 2 тМ EDTA, рН 7,2) за отстраняване на кръвта. Черният дроб се претегля и впоследствие се нарязва, замразява се в течен азот и се съхранява при -80 ° C до употреба. Чернодробният протеин се екстрахира чрез хомогенизиране (IKA-Ultraturrax T10) на замразена чернодробна тъкан, в ледено студен екстракционен буфер (1:10 тегл./Об.), Съдържащ 1% Triton X-100, 500 mmol/L Tris-HCl, 200 mmol/L NaCl и 10 mmol/L CaCl2, рН 7,6 [17]. След това хомогенатът се центрофугира (30 минути при 12 000 об/мин при 4 ° С) и концентрацията на протеин в супернатантата се измерва с колориметричния метод на Лоури [18]. Преди употреба пробите се съхраняват при -20 ° C. Нивата на MMP-2 (желатиназа А; EC 3.4.24.24), MMP-9 (желатиназа B; EC 3.4.24.35), TIMP-1 и TIMP-2 са определени с търговски комплект ELISA (Abnova).
2.4. ММР-2 и ММР-9 Зимография
За да се открие литичната активност на MMPs, чернодробните екстракти се нормализират до крайна концентрация от 400 μg/ml в буфер за зареждане на пробата (0,25 M Tris-HCl, 4% тегл./Захароза, 10% SDS тегл./Об. И 0,1% бромфенол синьо тегло/обем, рН 6,8). След разреждане пробите се зареждат върху електрофоретични гелове (SDS-PAGE), съдържащи 1 mg/ml желатин при нередуциращи условия [19], последвано от зимография, както е описано по-горе [20]. Зимограмите бяха анализирани с денситометър (GS900 Densitomer; BIORAD, Hercules, CA, USA) и данните бяха изразени като оптична плътност (OD), свързана с 1 mg/ml протеиново съдържание.
2.5. Статистически анализ
Резултатите се изразяват като средна стойност ± стандартна грешка. Сравненията между групите бяха извършени чрез несдвоен t тест. Когато разпределението на данните не беше нормално според теста на Колгоноров-Смрна, беше използван тест на Ман-Уитни. Всички статистически процедури бяха извършени с помощта на статистическия софтуерен пакет MedCalc (версия 11.6.0.0). Стойност на p 2 (a) и 2 (b)). Активността на MMP-9 е по-ниска в ML в сравнение с LL (Фигура 2 (b)). Макар и да не е значима, подобна тенденция се наблюдава за MMP-2 в контролните дробчета (Фигура 2 (а)). Значително увеличение на активността на MMP-9 също е установено в RL в сравнение с ML и LL при контролни плъхове (Фигура 2 (b)). Установено е значително увеличение на активността на MMP-2 и MMP-9 при RL, ML и LL на животните от NASH в сравнение със съответните контролни животни (Фигури 2 (a) и 2 (b)).
Нивата на TIMP-1 и TIMP-2 са по-високи в RL в модела NASH, в сравнение с ML и LL (Фигура 3 (а)). Същата тенденция се наблюдава при контролните животни за TIMP-1. По-ниско ниво на TIMP-2 при плъхове NASH е установено в RL в сравнение с ML. Тази тенденция се наблюдава за ML спрямо RL при контролните животни (Фигура 3 (b)). Установени са и по-ниски нива на TIMP-1 в RL, ML и LL при плъхове NASH в сравнение със съответните им контролни животни (Фигура 3 (а)). Същата тенденция се наблюдава за TIMP-2 в LL и ML (Фигура 3 (b)).
Чернодробно съдържание в TIMP-1 (a) и TIMP-2 (b), получено от LL, ML и RL в MCD и контролни плъхове. Нивата на TIMP се изразяват в ng/mL. Данните са показани като средни стойности ± SE. ∗ p Фигура 4 (а)). Не се открива активност на ММР-9 при плъхове със затлъстяване и постно Зукър. Установени са по-ниски нива на активност на MMP-2 в RL на плъхове NAFLD в сравнение със съответните слаби животни (Фигура 4 (а)).
TIMP-1 е значително по-висок в ML в сравнение с LL при плъхове NAFLD (Фигура 5 (а)). Сравними нива за TIMP-1 бяха открити в лобовете от плъхове Lean Zucker (Фигура 5 (а)). Не се открива разлика за TIMP-2 както при плъхове със затлъстяване, така и при постно цукер. Установени са сравними нива на TIMP-1 и TIMP-2 в RL, ML и LL при плъхове със затлъстяване Zucker в сравнение с постни животни, с изключение на TIMP-1 в RL (Фигури 5 (a) и 5 (b)).
Чернодробно съдържание в TIMP-1 (a) и TIMP-2 (b), получено от LL, ML и RL при NAFLD и постни плъхове. Нивата на TIMP се изразяват в ng/mL. Данните са показани като средни стойности ± SE. ∗ p Фигура 6 (а)). Напротив, при контролни плъхове е установено по-ниско съдържание на ROS в RL в сравнение с LL (Фигура 6 (а)). По-високи нива на чернодробен TBARS са наблюдавани в LL в сравнение с RL и ML в NASH и контролни животни. Установено е значително увеличение на TBARS, когато LL, ML и RL при плъхове NASH са сравнени със съответните им контролни животни (Фигура 6 (b)).
Чернодробни нива на ROS (a) и TBARS (b), получени от LL, ML и RL при NASH и контролни плъхове. Данните са показани като средни стойности ± SE. ∗ p Фигура 7 (а)). Същата тенденция се наблюдава при плъхове Lean Zucker (Фигура 7 (а)). По-ниски нива на ROS бяха открити, когато LL, ML и RL, получени от плъхове NAFLD, бяха сравнени със съответната Lean група (Фигура 7 (а)). Установени са по-високи нива на TBARS в LL както при плъхове със затлъстяване, така и при постно и Zucker в сравнение със съответните ML и RL (Фигура 7 (b)). По-ниски нива на TBARS бяха открити, когато LL, ML и RL, получени от плъхове със затлъстяване Zucker, бяха сравнени със съответните лобове от групата на Lean (Фигура 7 (b)).
Чернодробни нива на ROS (a) и TBARS (b), получени от LL, ML и RL при NAFLD и постни плъхове. Данните са показани като средни стойности ± SE. ∗ p Таблица 1). Същото важи и за концентрацията на TNF-alfa, индекс на активиране на Kupffer клетки (Таблица 1). При плъхове Zucker е установено само увеличение на ALT при затлъстелите животни (Таблица 1); не се открива разлика в серумната концентрация на TNF-алфа между животните със затлъстяване и постно цукер (Таблица 1). Сравнявайки модела NAFLD с модела NASH, бяха открити значително по-ниски нива на TNF-алфа при плъховете със затлъстяване Zucker в сравнение с плъховете MCD (Таблица 1).
маса 1
Серумни ензими и TNF-алфа при плъхове NASH и NAFLD.
| NASH | Контрол | 30,8 ± 2 | 97,8 ± 2 | 26,8 ± 2,2 |
| MCD | 166,2 ± 23 ∗ | 245,1 ± 39 ∗ | 36,7 ± 2,6 ∗ § | |
| NAFLD | Пост Зукър | 66,2 ± 4,3 | 112,3 ± 2,8 | 10,2 ± 0,5 |
| Затлъстелите Зукър | 114,5 ± 20 ∗ | 116,1 ± 10 | 9,5 ± 0,4 |
∗ p § p Фигура 8). Въпреки че причината за това различно метаболитно поведение, наблюдавано в различни лобове, е неразгадана загадка, това проучване подкрепя нарастващите доказателства за функционална хетерогенност между чернодробните лобове, вече наблюдавани при други чернодробни заболявания, със същата тенденция, срещаща се и при NAFLD и NASH.
Схематично представяне на хетерогенността на чернодробните лобове в моделите NASH и NAFLD (MMP, матрични металопротеинази; TIMP, тъканни инхибитори на ROS на металопротеиназа, реактивни кислородни видове; TBARS, вещества, реагиращи с тиобарбитурова киселина).
Благодарности
Благодарим на г-н Масимо Коста за умелото му техническо съдействие, г-жа Николета Бреда за съдействието за редактиране и професор Антъни Болдри за преразглеждането на английския.
Наличност на данни
Данните, използвани в подкрепа на констатациите от това проучване, са достъпни от съответния автор при поискване.
Конфликт на интереси
Авторите декларират, че нямат конфликт на интереси.
Принос на авторите
Джузепина Паладини и Лора Г. Ди Паскуа допринесоха еднакво.
- Мишките с дефицит на фактор, индуциращ апоптоза, не развиват чернодробна стеатоза при високо съдържание на мазнини
- Разработено лечение срещу затлъстяване при животински модели - ScienceDaily
- Развъждане за собственици на домашни любимци - Бременност в кучета VCA Animal Hospital
- Бариатрична хирургия за безалкохолен стеатохепатит при пациенти със затлъстяване Cochrane
- Бъдете проницателни, когато управлявате млечното си стадо! Животно; Хранителни науки