Резюме
ABTS анализът принадлежи към най-популярните методи за оценка на антиоксидантната активност. Изследователите обаче рядко обръщат внимание на специфични фактори, влияещи върху определянето на антиоксидантната активност на изследваните съединения и смеси. Хартията показва, че видът на използвания алкохол значително влияе върху оценката на антиоксидантната активност на фенолните съединения в ABTS анализа, а именно, че тяхната антиоксидантна активност се увеличава с удължаването на алифатната верига в алкохола. Това е резултат по-скоро от промените в ABTS •+ енергия на солватация от използваните алкохоли, отколкото от дисоциационните вариации на фенолни съединения. Получените резултати сочат към трудностите при правилната оценка на реалните антиоксидантни свойства на растителни и хранителни екстракти чрез ABTS анализ. Представените резултати имат и екологично значение, тъй като се отнасят до разликата в оценката на антиоксидантните свойства на съединенията, получени в резултат на заместването на токсичния метанол с GRAS (общопризнати като безопасни) разтворители, етанол и пропанол.
Въведение
Експериментална секция
Реактиви
Метанолът, етанолът, пропанолът-1 (всички с аналитичен реагент) и реагентът на Карл Фишер са закупени от Полския химически завод-POCh (Гливице, Полша). 2,2′-азинобис (3-етилбензотиазолин-6-сулфонова киселина) диамониева сол (ABTS), калиев персулфат (ди-калиев пероксидисулфат), 2.2-дифенил-1-пикрилхидразил (DPPH •) и BHT са закупени от Sigma-Aldrich (Познан, Полша). Водата се пречиства чрез Milli-Q система от Millipore (Millipore, Bedford, MA, USA).
Методи
ABTS анализ
Генерирането на ABTS [2,2′-азинобис (3-етилбензотиазолин-6-сулфонова киселина) диамониев] катион се извършва от Nenandis [16]. Разтворът ABTS • + се приготвя чрез реакция на 5 ml 7 mM воден разтвор ABTS и 88 μl 140 mM (2,45 mM крайна концентрация) калиев персулфат (K2S2O8). Сместа се инкубира на тъмно в продължение на 16 часа. Образуваният по този начин радикален катион се разрежда допълнително в метанол или етанол или пропанол-1 или пропанол-2. Бяха приложени два вида алкохолни ABTS • + разтвори:
показващ първоначална стойност на абсорбция от 0,71 при 744 nm и
притежаващи същото количество ABTS • + (80 или 120 μl разтвор на радикалния катион в 10 ml от крайния алкохолен разтвор).
Кинетиката на реакцията ABTS • +/BHT беше изчислена, като се измерва намаляването на концентрацията на ABTS радикален катион при 744 nm (при 757 и 412 nm от време на време) и/или увеличаването на концентрацията в намалената ABTS форма при 346 nm. За нулиране на спектрофотометъра бяха използвани чисти разтворители (без ABTS • + и BHT). Като контрол се прилагат разтворите ABTS • + без антиоксидант.
ABTS анализите се провеждат съгласно следната процедура: 2000 μl ABTS • + разтвор в даден алкохол се смесва в 4-милилитрова епруветка с 20 μl BHT разтвор в същия алкохол (0,5 mg/ml). Сместа се разбърква енергично в продължение на 30 s и се излива в кварцови кювети (1 cm × 1 cm × 3,5 cm). Промените в абсорбцията се наблюдават при споменатата дължина на вълната в продължение на 60 минути (180 минути от време на време) с помощта на UV Probe-1800 спектрофотометър (Shimadzu, Kyoto, Japan). Последващите показания бяха взети на редовни интервали (60 s).
Процентът на оставащите ABTS • + се изчислява от следното уравнение:
където A т0 и A т са стойностите на абсорбция на ABTS • + за 0 минути и по време, равни на (т) съответно min.
Кинетиката на реакцията ABTS • +/BHT също беше оценена, наблюдавайки повишаване на концентрацията в намалената ABTS форма при 346 nm. Поради влиянието на алкохолния тип върху интензитетите на абсорбционната лента при тази дължина на вълната, промените в концентрацията на ABTS се изразяват като относителни промени в концентрацията. Относителната концентрация на ABTS се изчислява от следното уравнение:
където A т0, A т и A т180 са стойностите на абсорбция на ABTS за 0 минути, във време, равно на (т) съответно min и на 180 min.
Определяне на водата от Карл Фишер
Част от изследвания алкохол (100 μl) се инжектира в полуавтоматично устройство на Karl Fischer от Metrohm (Herisau, Швейцария). Получените резултати отразяват абсолютното водно съдържание в% от инжектирания разтвор.
Статистически анализ
Както беше споменато по-горе, промените в абсорбцията се наблюдават в продължение на 60 минути (180 минути от време на време) на равни интервали (60 s). Кинетичните криви бяха удавени, използвайки всички експериментални данни; за яснота обаче на фигурите са посочени само няколко експериментални точки (средни стойности ± SD). За да се определи повторяемостта на измерванията, всеки анализ на антиоксидантната активност се прави три пъти. RSD от всички измервания са по-ниски от 10%. P
Резултати и дискусия
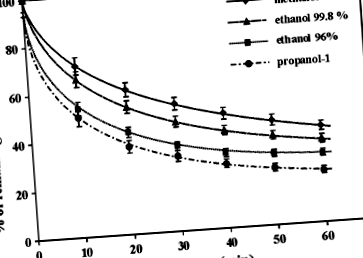
Влиянието на алкохолния тип (метанол, етанол и пропанол-1) върху кинетиката на ABTS •+/BHT реакцията се изкривява в продължение на 60 минути
Влиянието на концентрацията на вода в метанол, етанол и пропанол-1 върху разликата (Δ) в количеството нереагирали ABTS • + в системите, съдържащи първоначалния алкохол и в едни и същи разтворители при различни количества вода
Резултатите, представени на фиг. 1, са получени след общото предположение за ABTS анализ, че абсорбцията на първоначалния ABTS радикален катионен разтвор трябва да бъде равна на 0.71 ± 0.05 при 744 nm. На този етап трябва да се спомене, че различни обеми на ABTS •+ трябва да се приложи основен разтвор, за да се постигне необходимата първоначална абсорбция на отделните алкохолни разтвори. Например в представените експерименти са използвани около 150 или 120 μl обеми изходен разтвор, за да се приготвят съответно 10 ml обеми пропанолов или метанолов разтвор. Всичко това предполага солватохромния ефект в ABTS • +/ABTS спектъра. Спектрите на ABTS • +/ABTS в метанол или етанол или пропанол са представени на фиг. 3а. Максимумите на абсорбция при около 412, 658 и 744 nm съответстват на ABTS радикалния катион, а максимумът при около 346 nm съответства на намалената ABTS форма [19, 20]. Както се вижда от фиг. 3а, заместването на метанол с пропанол-1 измества максимума на препоръчителната абсорбционна лента от 744 на 757 nm. Фигура 3b – e показва влиянието на алкохолния тип върху промените в концентрацията на останалите ABTS • + по време на 60 минути ABTS • +/BHT реакция, измерена:
Абсорбционни спектри на ABTS и неговия продукт на окисление, ABTS •+, в метанол, етанол и пропанол-1 (а) и влиянието на алкохолния тип (метанол и пропанол-1) върху промените в концентрацията на останалите ABTS •+ по време на 60 минути ABTS •+/BHT реакция, измерена: при 744 nm за метанол и при 757 nm за пропанол-1 в системи с първоначална абсорбция на ABTS радикален катионен разтвор, равна на 0,71 (б); при 744 nm за метанол и при 757 nm за пропанол-1 в системи, съдържащи същите обеми ABTS •+ изходен разтвор (80 μl) (° С); при 744 nm за метанол и при 757 nm за пропанол-1 в системи, съдържащи същите обеми ABTS • + изходен разтвор (120 μl) (д); при 412 nm (д)
при 744 nm в случай на метанол и при 757 nm в случай на пропанол-1 за системи с първоначална абсорбция на ABTS радикален катионен разтвор, равна на 0,7;
при 744 nm в случай на метанол и при 757 nm в случай на пропанол-1 за системи, съдържащи същите обеми ABTS • + основен разтвор (80 и 120 μl);
Тези експерименти бяха ограничени до сравнението на системите с метанол и пропанол-1 поради наблюдаваните отчетливи разлики в кинетиката на ABTS • +/BHT реакцията, проведена в тези алкохоли. Зависимостите, представени на фиг. 3В-3Е, потвърждават констатацията от фиг. 1 - скоростта на реакция ABTS • +/BHT е по-бърза при пропанол-1, отколкото при метанола. Следователно може да се заключи, че наблюдаваната разлика в скоростта на реакцията не е резултат от солватохромен ефект на ABTS • +/ABTS система.
Много автори [21, 22] класифицират ABTS като метод за електронен трансфер (ET). Методът, базиран на ЕТ, открива способността на потенциален антиоксидант да прехвърля един електрон, за да намали радикал (например ABTS • +). Според Musialik & Litwinienko [23] този процес се ускорява в среда, поддържаща йонизацията на антиоксиданта. Следователно получените резултати могат да предполагат по-добра йонизация на BHT в пропанол-1, отколкото в метанола. И все пак това предположение може да породи някои съмнения. Много стойности на рКа за фенолни съединения в алкохолни разтвори се намират в литературата [24]. Докато някои от тях показват повишена йонизация на фенолите, когато техният разтворител се промени от метанол на пропанол, повечето от тях показват обратната зависимост. Следователно, наблюдаваното увеличение на ABTS •+/Реакционната скорост на BHT в резултат на заместването на метанол с пропанол е трудно да се обясни с увеличаването на йонизацията на BHT.
Влиянието на алкохолния тип върху ABTS •+/Кинетиката на BHT реакция може да бъде свързана със структурните различия на алкохолите в насипно състояние. Насипните алкохоли се състоят от свързани с водород клъстери [25, 26], които остават в термодинамично равновесие. Според Borowski et al. [25], насипният метанол се състои предимно от хепта-, хекса-, пента-, тетра- и тримерни клъстерни структури. Мономерните молекули на метанола съставляват само малка част от насипния алкохол. Количеството на изолираните алкохолни молекули също е с ниско съдържание на етанол, но останалата част от алкохола се състои главно от пентамерни клъстери при стайна температура. Не може да се изключи, че различните клъстерни структури на използваните алкохоли проявяват различна способност за предаване на протони и следователно са отговорни за наблюдаваните разлики в кинетиката на реакцията.
Тези разлики могат да се дължат и на енергията на солватация на използваните радикали (ABTS •+ ) в използваните алкохоли. Вероятно е по-полярните и по-киселинните метанолови молекули да взаимодействат силно с ABTS • + (особено с електронните двойки, съществуващи при = N – N = мостовете на тези радикали), като инхибират както електронен, така и/или водороден атом трансфер между антиоксиданта и тези радикали.
Влиянието на алкохолния тип (метанол и пропанол-1) върху а относителните промени в концентрацията на ABTS (измервания при 346 nm), и б ABTS •+ промени в концентрацията (измервания при 744 и 757 nm съответно за метанолов и пропанолов разтвор) по време на 180 минути ABTS •+/BHT реакция
- Значението на управлението на теглото при захарен диабет тип 2 - Wilding - 2014 - International
- Язва диета Какъв тип тръби се използва при байпас за трансплантация на черен дроб
- Какво означава вашата кръвна група за вашето здраве Северозападна медицина
- Разбиране на значението на протеина за спортистите
- Разбиране на подагра Вид артрит - Поликлиниката