От Pei-Chi Chan и Po-Shiuan Hsieh
Изпратено: 17 май 2016 г. Преглед: 31 август 2016 г. Публикувано: 22 март 2017 г.
Резюме
Ключови думи
- адипоцит
- хипертрофия
- хипоксия
- възпаление на мастната тъкан
- инсулинова резистентност
информация за глава и автор
Автори
Пей-Чи Чан
- Национален отбранителен медицински център, Институт по физиология, Тайпе, Тайван
Po-Shiuan Hsieh *
- Национален отбранителен медицински център, Институт по физиология, Тайпе, Тайван
* Адресирайте цялата кореспонденция на: [email protected]
От редактирания том
Редактиран от Ян Оксхолм Горделадзе
1. Въведение
Предполага се, че възпалението на мастната тъкан е от решаващо значение за патологичните механизми на свързаните със затлъстяването кардиометаболитни усложнения, включително инсулинова резистентност, диабет тип 2, атеросклероза и безалкохолно мастно чернодробно заболяване (NAFLD). Въпреки това основните механизми на този процес все още се разследват.
Адипоцитите в условия на затлъстяване, особено при болестно затлъстяване, се характеризират с хипертрофия и хипоксия и те са важните източници за инициализиране на възпалението на мастната тъкан. Това възпаление се медиира от производството на голям брой цитокини и хемокини, включително фактор на туморна некроза-α (TNF-α), интерлевкин-6 (IL-6), моноцитен хемотактичен протеин-1 (MCP-1) и се регулира при активиране, нормална експресирана и секретирана Т-клетка (RANTES). Тези цитокини и хемокини, произведени от адипоцити по време на хипертрофия и хипоксия, значително допринасят за развитието на свързано със затлъстяването възпаление на мастната тъкан. Капацитетът на конститутивно и регулирано освобождаване на имунни медиатори от адипоцити показва причинно-следствена връзка между биологията на адипоцитите и имунните клетки, като макрофаги и Т клетки. Освен това се предполага, че взаимодействието на хипертрофични, хипоксични адипоцити и имунни клетки на мастната тъкан играе ключова регулаторна роля в развитието на индуцирана от затлъстяване инсулинова резистентност.
Този преглед предоставя актуализирани доказателства, за да се подчертае важната роля на хипертрофията на адипоцитите и хипоксията при развитието на свързано със затлъстяването възпаление на мастната тъкан (AT) и инсулинова резистентност, а също така обсъжда възможния механизъм.
2. Основни предмети
2.1. Възпалението на мастната тъкан от решаващо значение допринася за патогенезата на свързаната със затлъстяването инсулинова резистентност и захарен диабет тип 2 (DM)
От друга страна, натрупването на излишни мазнини насърчава освобождаването на свободни мастни киселини от мастната тъкан в кръвообращението и засяга много други тъкани, включително черния дроб, скелетните мускули и сърцето. [11]. Вредното въздействие на мастните киселини и техните метаболити, като ацил-коензим А, керамиди и диациглицерол, върху инсулиновата сигнализация чрез активиране на протеинкинази като протеин киназа С, митоген-активирани протеинкинази (MAPK), c-Jun N-терминал киназа (JNK) и инхибиторът на ядрения фактор κβ киназа В са докладвани [12]. Освен това, свободните мастни киселини служат като лиганди за Toll-подобен рецептор 4 (TLR4) комплекс [13] и стимулират производството на цитокини на макрофаги [14], като по този начин модулират възпалението на мастната тъкан, което също значително допринася за свързаните със затлъстяването метаболитни усложнения.
2.2. Развитието на хипертрофия на адипоцитите и хипоксия при възпаление на мастната тъкан
Мастната тъкан може да реагира бързо и динамично на промени в лишаването и излишъка на хранителни вещества чрез хипертрофия на адипоцитите и хиперплазия [15]. Особено при болестното затлъстяване, за разлика от разширяването на мастната тъкан при здравословното затлъстяване, състоящо се от разширяване на мастната тъкан чрез ефективно набиране на адипогенни клетки-предшественици към адипогенните програми, патогенното разширяване на мастната тъкан се състои от масивно разширяване на съществуващите адипоцити и ограничена ангиогенеза и осигуряване хипоксия [16]. Например, адипоцитите стават хипертрофични по време на развитието на затлъстяване и техният размер се увеличава до 140–180 μm в диаметър, но границата на дифузия на кислорода е най-много 100 μm [17]. От друга страна, възможно е кръвоснабдяването на адипоцитите да бъде намалено по време на прогресивното разширяване на адипоцитите с последваща хипоксия [18].
2.3. Хипотезата и доказателствата за ефекта на хипертрофия и хипоксия на адипоцитите върху развитието на възпаление на мастната тъкан и инсулинова резистентност
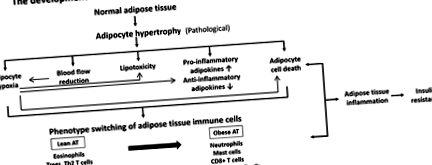
Последните проучвания показват, че мастната тъкан по време на развитието на болестно затлъстяване се характеризира с хипертрофия на адипоцитите, последвана от хипоксия, инфилтрация на имунни клетки и провъзпалителни адипоцитокини по време на прогресиране на хронично възпаление. В допълнение, едновременното развитие на намалена перфузия на кръвния поток, липотоксичност и смърт на адипоцитните клетки също биха влошили допълнително напредъка на възпалението на мастната тъкан (Фигура 1).
Фигура 1.
Развитието на нездравословно затлъстяване и инсулинова резистентност.
2.3.1. Ефект на хипертрофия на адипоцитите върху хипоксията на мастната тъкан
Затлъстяването като излишък от мастна тъкан се дължи на хипертрофия и хиперплазия на адипоцитите. Адипоцитите имат ограничен капацитет за хипертрофия. Едно от обясненията се счита за граница на дифузия на кислорода, която е най-много 100 μm [17]. Следователно е възможно хипертрофичните адипоцити да издържат по-малко от адекватно снабдяване с кислород. От друга страна, е доказано, че хипоксия на затлъстели мишки може да се появи в зоните в мастната тъкан в резултат на хипертрофия на адипоцитите, нарушаваща ефективното снабдяване с O2 от съдовата система и след това да инициира възпалителни реакции, посочени чрез аддукция на пимонидазол хидрохлорид (веществени доказателства) както и концентрацията на лактат (физиологични доказателства) [19]. Освен това се съобщава също, че хипоксията води до възпаление на мастната тъкан и инсулинова резистентност in vitro и при проучвания върху животни [19–21].
Хипоксията е в състояние да предизвика възпаление в мастната тъкан чрез индуциране на свързана с хипоксия генна експресия в адипоцити и макрофаги. Важен и добре характеризиран ключов регулатор на адаптивната реакция към промени в напрежението на кислорода е индуцируемият от хипоксия фактор-1а (HIF-1α), транскрипционен фактор, който се натрупва по време на хипоксия и активира пътищата на ядрения фактор-кβ, което води до повишено възпаление и стимулиране на ангиогенезата [19].
Трябва да се отбележи, че индуцираният от хипоксия фактор-1а (HIF-1α), който играе ключова роля в отговора на хипоксия [20], се счита за главен регулатор на O2 хомеостазата. HIF-1α е идентифициран в човешката мастна тъкан и се съобщава, че се увеличава при затлъстяване [21]. В допълнение, няколко проучвания с гризачи показват, че повишената генна експресия на HIF-1α, по-хипоксични зони и по-нисък PO2 са открити в бяла мастна тъкан на ob/ob, KKAy и индуцирани от храната затлъстели мишки [22–24]. Намаленото напрежение на кислорода е пряко измерено при депа със затлъстяване при модели на мишки и хора [23]. Доказано е също, че свръхекспресията на HIF-1α в адипоцита е по-профибротична и провъзпалителна, отколкото проангиогенна [25]. Специфичното за адипоцитите делеция на HIF-1α ограничава възпаление на мастната тъкан с високо съдържание на мазнини и инсулинова резистентност и тъканта е еднакво васкуларизирана като контролите от див тип [26]. По този начин увеличаването на експресията на HIF-1α може да допринесе за локализирано възпаление в мастната тъкан, което разпространява цялостно системно възпаление, свързано с развитието на съпътстващи заболявания, свързани със затлъстяването [27].
2.3.2. Ефект на хипертрофия на адипоцитите върху производството на свободни мастни киселини (липотоксичност)
Независимо от това, увеличаването на потока на мастни киселини в мастните клетки води и до по-голям синтез на FFA в триглицериди, което би довело до стрес от ендоплазмен ретикулум (ER), активиращ JNK пътя и по този начин допълнително увеличаващ инсулиновата резистентност в мастните клетки [31].
2.3.3. Ефект на хипертрофия на адипоцитите върху намаляването на кръвния поток в мастната тъкан
Нарастващата мастна маса, по-специално коремната мастна тъкан, е свързана с неблагоприятни промени в кръвния поток на мастната тъкан и развитието на метаболитни нарушения в състояние на затлъстяване. Намаленият кръвен поток, показан при увеличена мастна маса, може главно да се дължи на развитието на адипоцитна хипертрофия.
Намаляването на перфузията на мастната тъкан е често срещана характеристика при затлъстяването. West и сътр. [32] демонстрира, че притокът на кръв към мастната тъкан, измерен с радиомаркирана микросфера, е намален при плъхове със затлъстяване Zucker. При хората нивата на кръвния поток в мастната тъкан се измерват с позитронно-емисионна томография, като се използва вода с маркировка [15 O] [33] и метод за измиване на 133 Xe [34] и са по-ниски при затлъстяване в сравнение с лица без наднормено тегло. В допълнение, нарушенията в регулирането на кръвния поток в мастната тъкан са свързани със затлъстяването и инсулиновата резистентност [35]. Това проучване демонстрира тясна връзка между инсулиновата чувствителност и регулирането на кръвния поток от мастна тъкан след хранене, независимо от затлъстяването. Следователно нарушената регулация на кръвния поток в мастната тъкан чрез хипертрофия на адипоцитите също може да има значителен и независим принос за развитието на инсулинова резистентност в състояние на затлъстяване [35].
2.3.4. Ефект на хипертрофия на адипоцитите върху смъртта на адипоцитите
Както беше споменато по-горе, хипертрофията на адипоцитите може пряко и непряко да причини адипоцитна хипоксия. Хипоксията може да бъде потенциален рисков фактор за смърт на адипоцитите в мастната тъкан на затлъстели лица. Съобщава се за увеличаване на смъртността на адипоцитите в мастната тъкан на затлъстели лица и се предлага да предизвика инфилтрация на макрофаги [36]. Клетъчната смърт може също да насърчи липолиза и освобождаване на FFA в кръвния поток при инсулинова резистентност. Това значително ще допринесе за увеличаване на плазмената FFA при затлъстяване. Освен това е доказано, че честотата на смъртта на адипоцитите е свързана значително с експресията на мастните гени на TNF-α, IL-6 и MCP-1 в мастната тъкан и развитието на инсулинова резистентност на цялото тяло [37].
Макрофагите са изключително опитни в отстраняването на множество молекули, вариращи от малки липиди през колонии от патогени до мъртви клетки. Некрозата на адипоцитите, задвижвана от хипертрофия и ускорена от затлъстяване, е виден фагоцитен стимул, който привлича инфилтрация на макрофаги в мастната тъкан [18]. Използвайки трансгенен животински модел на индуцируема липоатрофия, Pajvani et al. демонстрира, че масивната смърт на адипоцитите наистина може да доведе до бързо натрупване на макрофаги на мастната тъкан (АТМ) като неразделна част от ремоделирането на мастните накладки [38]. Тези наблюдения предполагат важна роля на хипертрофията на адипоцитите в развитието на смърт на адипоцитите и свързаните с тях възпалителни промени в усложненията на АТ и затлъстяването.
2.3.5. Ефект на хипертрофия на адипоцитите върху производството на адипокин
Повишаването на провъзпалителните цитокини в мазнините и кръвообращението като TNF-α, IL-1, IL-6, MCP-1 и PAI-1 е документирано при затлъстяване [23,25,39]. Предполага се, че увеличаването на производството на адипокин при хипертрофия на адипоцитите и хипоксия е в основата на развитието на възпалителния отговор в мастната тъкан, който се проявява в състояние на затлъстяване [11,40]. Ясно е посочено, че размерът на адипоцитите е важен фактор, определящ секрецията на няколко възпалителни адипокини, като лептин, IL-6 и MCP-1, като по този начин осигурява друга връзка между размера на адипоцитите и възпалението при затлъстяване [41]. В същото проучване се наблюдава тенденция към намаляване на освобождаването на противовъзпалителни адипокини като IL-10 и адипонектин с увеличаване на размера на адипоцитите [41].
От друга страна се предполага, че хипоксията е подбуждаща етиология на некроза и инфилтрация на макрофаги в мастната тъкан, което впоследствие води до нарушаване на регулирането на производството на свързани с възпалението адипокини като лептин, адипонектин, TNF-α, IL-6 и съдов ендотелен растежен фактор (VEGF) [40,42]. Напоследък се съобщава също така, че хипоксията индуцира производството на PAI-1 и инхибира синтеза на адипонектин от адипоцити на 3T3-L1 [39]. Съобщава се също, че индуцира експресията на висфатин в тези клетки [43]. Експресиите на други основни адипокинови продукти от миши или човешки адипоцити, включително ангиопоетин-подобен протеин 4 (Angptl4), интерлевкин-6 (IL-6), инхибиторен фактор за миграция на макрофаги (MIF) и VEGF [23, 40, 44] също са стимулиран от хипоксия. Съответно, Wang et al. имитира хипоксия при човешки адипоцити за 24 часа, използвайки кобалтов хлорид (CoCl2). Показано е, че HIF-1α заедно с маркери за оксидативен стрес, маркери за възпаление и лептин е увеличен, но обратно адипонектинът е намален по време на хипоксия [42].
2.4. Взаимодействието на адипоцитите при хипертрофия и хипоксия и инфилтрирани имунни клетки при развитие на възпаление на мастната тъкан и усложнения при затлъстяване
Хипертрофията на адипоцитите и хипоксията са изключително важни за възпалението на мастната тъкан чрез индуциране на провъзпалителни цитокини, както и на хемокини, които привличат имунните клетки в ранното развитие на затлъстяването. Отдавна е известно, че мастната тъкан при затлъстяване е в повишено състояние на възпаление. Наскоро тя се трансформира от знанието, че имунните клетки като макрофаги и Т клетки могат да инфилтрират мастната тъкан и са отговорни за по-голямата част от възпалителното производство на цитокини и възпалението на мастната тъкан. Предполага се също, че адипоцитите могат да действат като антиген-представящи клетки към имунните клетки при възпаление на мастната тъкан [45].
2.4.1. Макрофаги
Някои от последиците от хипертрофия на адипоцитите включват поток на мастни киселини, васкуларизация, повишена секреция на адипокин, хипоксия и смърт на адипоцитни клетки. Тези свързани с адипоцитите последици от разширяването на мастната тъкан са важни фактори за започване на набирането на макрофаги при болестно затлъстяване. Инфилтрацията на макрофаги в възпалената мастна тъкан е резултат от приток на кръвни моноцити, привлечен главно от хемокина MCP-1, който се секретира главно от хипертрофични адипоцити [46]. Макрофагите на мастната тъкан (АТМ) се натрупват както в подкожните, така и във висцералните депа за разширяване на мазнините [46]. Освен че се увеличават в брой, макрофагите на мастната тъкан също се променят фенотипично по време на затлъстяването от противовъзпалителните М2 макрофаги в провъзпалителни М1 макрофаги, доминиращо в този на затлъстелите мишки [5]. Активираните М1 банкомати са основният източник на провъзпалителни цитокини като TNF-α и IL-6, които могат да блокират инсулиновото действие в адипоцитите чрез автокринна/паракринна сигнализация и също да причинят системна инсулинова резистентност чрез ендокринна сигнализация. Трябва да се отбележи, че производството на адипокин по време на хипертрофия на адипоцитите и хипоксия, като свободни мастни киселини и TNF-α, съобщава, че улеснява превключването на фенотип M1 в състояние на затлъстяване [47].
2.4.2. Т клетки
Освен това, наскоро откритите клетки на Т хелпер 17 (Th17) представляват ново подмножество на CD4 + Т клетки, дефинирани от тяхното производство на интерлевкин 17 (IL-17) [54]. Интересното е, че серумният IL-17 е регулиран при пациенти със затлъстяване при хора [55], а затлъстяването е положително корелирано с повишена експресия на IL-17 в Т-клетки, изолирани от далака [56]. Zúñiga и сътр. разкри, че IL-17, секретиран от Т клетки в мастната тъкан, е важен отрицателен регулатор на адипогенезата чрез потискане на експресията на няколко проадипогенни транскрипционни фактора, включително PPAR-γ и C/EBP-α [57], а също и метаболизма на глюкозата до влошават инсулиновата резистентност [58]. По този начин, повишената секреция на IL-17 от Th17 клетки инхибира диференциацията на стволови клетки, получени от адипоцити (ASC) до адипоцити и също така потиска инсулиновата реакция на адипоцитите. Eljaafari et al. [59] предоставят интригуващи доказателства чрез използване на съвместната култура на човешки ASC с човешки мононуклеарни клетки (MNC), ASC от затлъстели донори увеличават диференциацията на наивните CD4 + Т клетки към Th17 клетки и променят фенотипа на MNC чрез повишена секреция на IFN-γ от Th17 клетки. Взети заедно, тези наблюдения предполагат важна роля на клетките IL-17 и Th17 в свързаната със затлъстяването дисфункция на мастната тъкан и системните усложнения.
2.4.3. Други
В допълнение, нашето скорошно проучване [63] допълнително демонстрира, че СОХ-2 медиираната PGE2 EP3 сигнализация по време на развитието на адипоцитна хипертрофия и хипоксия е важна за набирането и взаимодействието с мастните имунни клетки за усилване на възпалителните реакции в мастната тъкан, което също е причинно-следствена свързана с развитието на системна инсулинова резистентност.
2.5. Регулаторните механизми на хипертрофия на адипоцитите при развитието на затлъстяване
Патогенната промяна на хипертрофията на адипоцитите по време на затлъстяване се определя от два различни процеса на затлъстяване: диференциация на адипоцитите (адипогенеза) и липогенеза. Те са зависими както от генетичното предразположение, така и от околната среда. По време на постоянен положителен калориен прием, хипертрофия на адипоцитите може да доведе до дисфункция на адипоцитите, докато адипогенезата е нарушена [64,65].
От друга страна, механизмите на диференциация на адипоцитите са широко проучени през последните десетилетия. Идентифицирани са редица ключови транскрипционни фактори и адипокини в диференциацията на адипоцитите [66]. Например, те са включени протеини от фамилия, активирани от пероксизомен пролифератор (PPAR) [67], CCAAT/свързващ протеин (C/EBP) [68], зависим фактор на определяне на диференциацията на адипоцитите (ADD1) [69] и белтъци от семейството на свързващ елемент протеин 1 (SREBP 1) протеини от семейството [70]. В допълнение, тирозин фосфорилираният Dok1 също е демонстриран да насърчава хипертрофия на адипоцитите чрез противодействие на инхибиторния ефект на извънклетъчната сигнално-регулирана киназа (ERK) върху PPAR-γ [71].
В допълнение, трайният енергиен излишък може да улесни съхранението на енергия чрез липогенеза и хипертрофия на съществуващи адипоцити, отколкото чрез адипогенеза с набиране и диференциране на нови адипоцити от пред-адипоцити. В крайна сметка това би довело до патологична хипертрофия на адипоцитите, която допринася за развитието на възпаление на мастната тъкан и метаболитни нарушения, свързани със затлъстяването [72,73].
2.6. Терапевтичните последици
В тази глава обсъждаме скорошния напредък относно ролята на адипоцитите в контрола на развитието, растежа и ремоделирането на мастната тъкан, свързана със затлъстяването. Тази статия за преглед допълнително подчертава важната роля на адипоцитите по време на хипертрофия и хипоксия в развитието на възпаление на мастната тъкан и след инсулинова резистентност. Освен това разбирането на регулаторния механизъм на хипертрофия на адипоцитите по време на развитието на затлъстяване може да осигури по-добра стратегия за профилактика и лечение на асоцииран със затлъстяването диабет тип 2 и метаболитен синдром.
Благодарности
Авторите оценяват подкрепата за финансиране от Министерството на науката и технологиите по грантови номера. МОСТ 105-2811-B-016-004 и МОСТ 104-2320-B-016-001; Обща болница Tri-Service, по грант № TSGH-C104-007-007-S01 в Тайван.
- Ролята на липопротеиновата липаза в развитието на мастната тъкан и метаболизма International Journal
- Ролята на карагенан и карбоксиметилцелулоза в развитието на чревни възпаления
- Ролята на адипонектин в свързаната със затлъстяването специфична за жените канцерогенеза - ScienceDirect
- Свързаният със затлъстяването пептид лептин предизвиква хипертрофия в вентрикуларни миоцити на новородени плъхове
- Защо Рут Бадер Гинзбърг е моят модел за роля на ALS - ALS News Today