Резюме
Обективен
Да се изследва как продължителното лечение с дексаметазон влияе върху разхода на енергия и затлъстяването при мишки и дали това се влияе от храненето с диета с високо съдържание на мазнини (HFD).
Проектиране и методи
Мишките бяха поставени на HFD за 2 седмици и започнаха с дексаметазон при 5 mg/kg през ден през следващите 7 седмици.
Резултати
Лечението с дексаметазон увеличава телесните мазнини, ефект, който е по-изразен при животните, отглеждани на HFD; лечението с дексаметазон също влошава чернодробната стеатоза, причинена от HFD. В същото време лечението с дексаметазон понижава RQ при животни, хранени с чау и забавя нощната скорост на метаболизма при животните, отглеждани на HFD. В допълнение, острото ускорение на VO2 в отговор на β3 адренергичната стимулация е значително ограничено при третираните с дексаметазон животни в резултат на значително намаляване на UCP-1 иРНК, наблюдавано при НДНТ на тези животни.
Заключения
Дългосрочното лечение с дексаметазон при миши модел на диета, предизвикано от затлъстяване, намалява термогенезата на НДНТ и преувеличава затлъстяването и чернодробната стеатоза.
ВЪВЕДЕНИЕ
Кортизолът е основният естествен глюкокортикоид при хората и неговият излишък увеличава общата маса на мастната тъкан, преразпределяйки мазнините от периферните към централните депа (1). Всъщност дългосрочното лечение с глюкокортикоиди е свързано с централно затлъстяване при хората (2, 3), което също обикновено се наблюдава при повечето пациенти със синдрома на Кушинг (4). Въпреки това, пациентите със затлъстяване не показват повишени серумни концентрации на кортизол. Вместо това се съобщава за по-високи нива на кортизол в мастната им тъкан в резултат на повишена активност на 11β-хидроксистероид дехидрогеназа тип 1 (11β-HSD 1), ензим, който превръща кортизона в кортизол (5).
Механизмите, чрез които екзогенните глюкокортикоиди променят метаболизма и предизвикват наддаване на тегло, са слабо разбрани. Въпреки стимулирането на синтеза и секрецията на лептин (директно или чрез инсулин) от адипоцитите при хора (6, 7), глюкокортикоидите повишават апетита, като ограничават индуцираното от лептин ситост и благоприятстват NPY орексигенната активност (8, 9). Например, предполага се, че увеличаването на приема на диетична енергия обяснява увеличаването на телесното тегло и мастната маса, наблюдавано при здрави жени доброволци, лекувани с глюкокортикоиди (10). От друга страна, глюкокортикоидите са хормони на стреса с добре познати липолитични ефекти; Счита се, че тези стероиди участват в свързаната с рака кахексия чрез повишена липидна мобилизация от мастна тъкан (11). Освен това участието на други системи също е вероятно, както е показано в неотдавнашния доклад, че остеобластите медиират много от неблагоприятните ефекти на екзогенните глюкокортикоиди върху метаболизма на горивата (12).
Един от възможните механизми, чрез които екзогенните глюкокортикоиди влияят върху затлъстяването и размера на различни депа на бяла мастна тъкан, е чрез забавяне на скоростта на енергийните разходи (EE). Това включва ЕЕ в покой и индуцируемата ЕЕ, която е свързана с физическа активност, хранене с диета с високо съдържание на мазнини (HFD) или предизвикана от стимули на околната среда като излагане на студ (13). Докато мускулната контракция и разграждането на АТФ обяснява ЕЕ, свързана с физическата активност, разединяването на митохондриите в кафявата мастна тъкан (НДНТ) е в основата на значителна част от ЕЕ, индуцирана от диетата и студа (13). Изглежда обаче, че глюкокортикоидите не играят основна роля в регулирането на ЕЕ в покой. Например, има лоша корелация между базовите ЕЕ и нивата на кортикостерон при мишки (14), а при хората ЕЕ не се променя с остро инхибиране на глюкокортикоидното действие (15) или излишък на глюкокортикоиди, напр. при пациенти със синдром на Кушинг (16).
Малко се знае за индуцируемата ЕЕ и екзогенните глюкокортикоиди, като краткосрочните проучвания при здрави мъже отчитат значително увеличение на ЕЕ и ускорено окисление на мазнините по време на тренировка (17, 18), докато в други подобни проучвания индуцируемата ЕЕ не се влияе от глюкокортикоиди (19 ). Съществува обаче консенсус, че острото приложение на глюкокортикоиди инхибира експресията на разединяващ протеин-1 (UCP-1), ключовият митохондриален протеин, участващ в енергийните разходи за НДНТ (20, 21). Прилагането на кортикостерон при плъхове намалява нивата на UCP-1 иРНК и протеини, както и реакцията на излагане на студ или приложение на епинефрин (21). Също така, ob/ob мишките, които показват по-високи нива на кортикостерон, имат намалени нива на UCP-1 и намалени EE (22). По-конкретно, ако медиираното от глюкокортикоиди намаляване на експресията на UCP-1 трябва да забави скоростта на ЕЕ, тогава това би обяснило защо хроничното лечение с дексаметазон влошава затлъстяването и дислипидемията при мишки, предизвикано от диета (23). Това е потенциално от голям интерес с оглед на наблюдението, че НДНТ се задържа от хората по време на зряла възраст (24, 25, 26).
UCP-1 е индуцируем сАМР вътрешен мембранен митохондриален протеин, който нарушава протонния градиент през тази мембрана, като по този начин бързо ускорява окислението на енергийните субстрати, отделени от синтеза на АТФ в НДНТ. Както UCP-1, така и адренергичната стимулация са от решаващо значение за индуцирана от диетата ЕЕ в НДНТ, тъй като мишки с UCP-1 нокаутират (27), троен адренергичен рецептор нокаутират (28) или нокаутират β1 адренергичния рецептор (29 ) показват дефектна термогенеза на НДНТ, развиващи тежка непоносимост към студ и затлъстяване. Основният въпрос, разгледан от настоящите проучвания, обаче е дали намаляването на UCP-1, причинено от прилагането на глюкокортикоиди, може значително да забави базалната или индуцируема от НДНТ медиирана ЕЕ и следователно да допринесе за метаболитна дисрегулация в миши модел на диета, предизвикано от затлъстяване.
МЕТОДИ И ПРОЦЕДУРИ
Животни
Комитетът по грижи и употреба на животните от Медицинското училище в Маями Милър одобри всички процедури. Двумесечни мъжки мишки C57BL/6J са получени от лабораторията Jackson (Bar Harbor, ME) и са настанени при стандартни условия с храна и вода ad libitum, при 22 ° С и 12-часов цикъл светлина/тъмнина. Животните са били лекувани с диета с високо съдържание на мазнини (HFD: 4,5 kcal/g; 42,7% въглехидрати, 15,3% протеини, 42% мазнини; TD95121; Harlan Teklad, Indianapolis, IN) или са останали на стандартна чау диета (3,5 kcal/g; 58,5% въглехидрати, 28,8% протеини, 12,7% мазнини; 5010; PMI Nutrition, Richmond IN) за общо 10 седмици. Мишките бяха оставени да се адаптират към околната среда поне една седмица преди да започнат диетата. След 2 седмици диета, животните бяха лекувани с интраперитонеални (ip) инжекции на дексаметазон натриев фосфат (APP Pharmaceutical, LLC; 5 mg/kg) или 0,9% натриев хлорид (Baxter, Deerfield, IL) през други дни до края на експериментален период. Както е посочено, данните са представени като (i) вариация между изходното ниво и края на експерименталния период (преди и след декса) или (ii) кръстосано сравнение между групите, третирани с физиологичен разтвор или дексаметазон в края на експерименталния период.
Метаболитни параметри
Телесното тегло се измерва през ден до евтаназия. Калоричният прием се измерва индивидуално през 8-дневен период след две седмици лечение с дексаметазон или физиологичен разтвор и резултатите се изразяват като функция от телесното тегло (kcal/g BW · ден). Съставът на тялото (чиста телесна маса,% мазнини и мастна маса) се измерва при мишки на гладно през нощта и се анестезира с кетамин и ксилазин (200 mg/kg и 7–20 mg/kg) с помощта на рентгенова абсорбциометрия с двойна енергия (DXA, Lunar Pixi, Janesville, WI) в избрани часови точки.
Непряка калориметрия и β3-селективна адренергична стимулация
За тези проучвания животните бяха допуснати до цялостна лабораторна система за наблюдение на животните (C.L.A.M.S .; Oxymax System, Columbus Instruments, Columbus OH), в отделни клетки и им беше позволено да се аклиматизират за два дни. 24-часови метаболитни профили са получени през следващите пет дни. Оборудването е калибрирано спрямо определена газова смес от O2 и CO2 (Airgas, Tampa, FL). Дихателният коефициент (RQ) се изчислява като съотношение между производството на CO2 (литри) и консумацията на O2 (литри). Консумацията на кислород (VO2) се изразява в ml O2/min и се нормализира чрез чиста телесна маса, както е определено от DXA. VO2 също се оценява в продължение на 4 часа преди и след подкожни (s.c.) инжекции на β3-селективен агонист на адренергичен рецептор - CL 316243 (Sigma Chemical Co. St Louis, MO; 1mg/kg).
Евтаназия и следкланичен анализ
В края на експерименталния период мишки на гладно през нощта бяха убити чрез сърдечна пункция след кратко излагане на CO2. Интерскапуларната НДНТ и черният дроб бяха отстранени, претеглени и бързо замразени в течен азот. Теглото на тъканта се нормализира чрез дължина на бедрената кост, измерена с помощта на електронен цифров апарат (Control Company, Friendswood, TX, закупен чрез VWR). Чернодробните триглицериди се измерват след екстракция с хлороформ: метанол (2: 1) и 0,05% сярна киселина от 0,2 g проба замразен черен дроб, използвайки наличен в търговската мрежа комплект (Sigma-Aldrich, St. Louis, Mo), както е публикувано по-рано (30 ).
Измервания на израза UCP-1
Общата РНК се извлича с помощта на QuiagenRNeasy комплект съгласно протокола на производителя (Qiagen, Валенсия, Калифорния) и концентрацията се определя с спектрофотометър Nanodrop. cDNA беше получена от 1 μg mRNA чрез използване на комплект за обратна транскрипция на cDNA с голям капацитет, съгласно протокола на производителя (Applied Biosystems, Foster City, CA). Интересният ген е оценен чрез RT-qPCR спрямо калибрационна крива на обединени миши проби (Bio-Rad iCycleriQ в реално време PCR система за откриване) и нормализиран от домакинския ген циклофилин А, както е описано по-горе (31). Използваните последователности на грундове са: UCP-1: 5′AGGTGTGGCAGTGTTCATTGG-3 ′, 3 ′ CTGTCCTGGGAGAGAGTTGATG-5 ′. Цикло-А: 5 ′ GCCGATGACGAGCCCTTG-3 ′, 3 ′ TGCCGCCAGTGCCATTATG-5 ′.
Анализ на данни
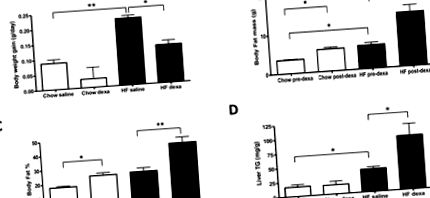
В целия ръкопис всички данни са изразени като средна стойност ± стандартна грешка на средната стойност (SEM). Данните бяха анализирани от софтуера PRISM Parallel GraphPad (Сан Диего, Калифорния). Използва се t-тест на Student за сравняване на разликите между две независими групи. Статистическата значимост се разглежда на ниво p Фиг. 1А). Масата на телесните мазнини (фиг. 1В), телесният процент мазнини (фиг. 1С) и съдържанието на триглицериди в черния дроб (фиг. 1D) също са значително увеличени; не са наблюдавани значителни ефекти на HFD върху приема на калории (0,50 ± 0,06 срещу 0,42 ± 0,01 kcal/g BW/ден; чау-диета спрямо HFD; n = 3/група) при третирани с физиологичен разтвор животни, измерени на петата седмица от Експериментът.
(А) Показано е наддаване на телесно тегло. Съставът на тялото се оценява чрез DXA преди (преди декса) и след (след декса) лечение с DEXA и се изразява като: (Б) Маса на телесните мазнини и (° С) общо телесни мазнини. (Д) Съдържание на чернодробни триглицериди (TG). Резултатите се изразяват като средна стойност ± SEM (n = 3–6). СН, диета с високо съдържание на мазнини. Декса, дексаметазон. * P ** P Фиг. 1А), като същевременно се увеличава масата на телесните мазнини (Фиг. 1Б) и процентът на мазнините (Фиг. 1С), и при двата вида диета; обаче ефектите са по-изразени при животните, отглеждани на HFD (Фиг. 1B-C). По същия начин, само при мишки, третирани с дексаметазон, държани на HFD, съдържанието на чернодробни триглицериди е приблизително удвоено (фиг. 1D). Забележително е, че поне част от ефекта на дексаметазон върху намаляването на наддаването на телесно тегло се дължи на намаляване на линейния растеж, което се доказва от намалената дължина на бедрената кост (14,6 ± 0,20 срещу 15,5 ± 0,04 mm; n = 3/група; p Фиг. 2А), но значително намали нощния RQ (фиг. 2C – D). Това е индикация, че окисляването на мастните киселини е ускорено чрез лечение с дексаметазон. Въпреки това, при животните, отглеждани на HFD, лечението с дексаметазон насърчава значително намаляване на VO2, което достига статистическа значимост през нощния период (фиг. 2A-B). Това, обаче, не е свързано с по-нататъшно намаляване на RQ, вероятно защото окисляването на мастните киселини вече е ускорено чрез задържане на животните на HFD (Фиг. 2C).
- Енергиен баланс и затлъстяване при лица с муковисцидоза - PubMed
- Разходите за енергия при затлъстели жени преди и по време на загуба на тегло, след хранене и в
- Промени в енергийните разходи с увеличаване на теглото и загуба на тегло при хората - PubMed
- Frontiers EGCG намалява затлъстяването и увеличаването на бялата мастна тъкан отчасти чрез активиране на AMPK при мишки
- Енергиен баланс и затлъстяване при лица с муковисцидоза - ScienceDirect