Едит Ланер, Джанлука Еспозито, Глория Гали, Бруно Анибале
Ключови думи: Атрофичен гастрит; злокачествена анемия; чревна метаплазия; рак на стомаха; тип 1-стомашни карциноиди
Подадено на 07 май 2015 г. Прието за публикуване на 25 май 2015 г.
Атрофичен гастрит: предраково състояние
Атрофичният гастрит е възпалително състояние, характеризиращо се със загуба на стомашни жлезисти структури, които са заместени от съединителна тъкан (неметапластична атрофия) или от жлезисти структури, неподходящи за местоположението (метапластична атрофия) (1). Атрофията на стомашната лигавица и чревната метаплазия създават висок риск за развитието на рак на стомаха, тъй като те представляват фона, в който могат да се развият дисплазия и стомашен аденокарцином от стомашен тип (2,3). Поради тази причина атрофичният гастрит и чревната метаплазия се считат за предракови състояния.
В много случаи развитието на стомашен аденокарцином на стомаха представлява крайна стъпка от последователност на възпаление-метаплазия-дисплазия-карцином, наричана още карета на Correa от многостепенна стомашна канцерогенеза. Според тази каскада ракът на стомаха се развива като последица от постепенното прогресиране от нормалната стомашна лигавица чрез хроничен неатрофичен гастрит, атрофичен гастрит и чревна метаплазия, свързан с Helicobacter pylori (H. pylori), до дисплазия и карцином (4,5 ). Надлъжните проучвания потвърдиха този модел (6,7).
Различни фенотипове на атрофичния гастрит могат да се развият поради различното излагане на околната среда и генетичните профили. Интра-стомашното разпределение на премалигнените промени на стомашната лигавица е един от факторите, определящи риска от рак на стомаха: случаите на атрофия на оксинтичната жлеза и/или чревна метаплазия, разпределени по мултифокален модел, включително по-малката кривина на корпуса и очното дъно, се наричат мултифокален атрофичен гастрит и този фенотип, описан като „екстензивен“, е свързан с по-висок риск от рак на стомаха. По същия начин концепцията за „гастрит на фенотипа на карцинома“ предполага, че преобладаващият корпус гастрит увеличава риска от рак на стомаха, вероятно поради промени в интра-стомашната среда като повишено рН, намалена аскорбинова киселина (АА) и изчистване на нитрити и други потенциални канцерогенни вещества (8-10).
Чревната метаплазия може да бъде класифицирана като „пълна“ или „непълна“, където пълната чревна метаплазия показва чашевидни и абсорбиращи клетки, намалена експресия на някои стомашни муцини като MUC1, MUC5AC и MUC6, но експресия на чревния муцин MUC2. За разлика от това, непълната чревна метаплазия показва чашевидни и колонообразни абсорбиращи клетки, ко-експресиращи стомашни и чревни муцини (11-13). Някои изследвания показват положителна връзка между степента на чревна метаплазия и степента на непълна чревна метаплазия, но при рутинната диагностика подтипирането на чревната метаплазия не е широко разпространено.
Съвсем наскоро е описан трети модел на чревна метаплазия, известен като спазмолитична полипептидна експресираща метаплазия (SPEM), която се характеризира с експресията на TFF2 спазмолитичния полипептид, свързан с оксинтична атрофия. Съобщава се, че този модел на чревна метаплазия, наблюдаван в стомашното тяло, е силно свързан с инфекция с H. pylori и рак на стомаха и може да представлява друг път към стомашната неоплазия (14). Съвсем скорошно проучване, проведено в Тайван, показа, че геномни единични нуклеотидни полиморфизми (ITGA5-1160/ITGB1-1949/ITGB1 + 31804 като носители T/A/C и COX-2-1195/IL-10-592 като G-носител/AA ) в поколението на пациенти с рак на стомаха предразполагат към SPEM след инфекция с H. pylori и може да служи като маркер за идентифициране на високорискови субекти за ерадикация на H. pylori (15).
Стомашната дисплазия представлява предпоследния етап от последователността на стомашната канцерогенеза. Тази лезия се дефинира хистологично като недвусмислен неопластичен епител без данни за тъканна инвазия (16), който се характеризира с клетъчна атипия, отразяваща анормална диференциация и дезорганизирана жлезиста архитектура. По този начин стомашната дисплазия трябва да се счита за пряка неопластична предракова лезия. Класификациите в Падуа, Виена и СЗО са предложения за стандартизиране на терминологията за морфологичния спектър на стомашни диспластични лезии (17-20).
Епидемиологичните данни предполагат, че атрофичният гастрит е свързан не само с рак на стомаха от чревен тип, но и със стомашен карциноид тип 1. Патофизиологичните механизми, които водят до развитието на тези стомашни тумори, са дълбоко различни. Както бе споменато по-горе, ракът на стомаха се развива като краен резултат от многостепенен процес, започващ от гастрит, свързан с H. pylori, до атрофичен гастрит, чревна метаплазия и дисплазия (4). За разлика от това, стомашните карциноиди тип 1 са гастрин-зависими тумори. Тези тумори са добре диференцирани с нисък пролиферативен индекс и обикновено доброкачествено поведение и представляват до 80% от всички стомашни карциноиди (21). Основен патогенетичен фактор за стомашните карциноиди тип 1 е хипергастринемията, дължаща се на атрофичен гастрит. Гастрин действа като растежен фактор за ентерохромафиноподобни клетки, които при атрофичен гастрит са хронично индуцирани да се размножават и чрез многостепенен процес, преминаващ от хиперплазия към дисплазия, може да се развие карциноид (21-23).
Няколко събития се случват в стомашната лигавица преди развитието на рак на стомаха или стомашен карциноид тип 1 и тези събития могат да отнемат няколко години. По този начин знанието за разпространението на атрофичния гастрит в различни клинични условия, неговите клинични характеристики и възможни рискови фактори, свързани с прогресирането на това състояние до стомашни новообразувания, са важни въпроси.
Атрофичен гастрит: епидемиология и клинични особености
Атрофичният гастрит е хронично разстройство, срещащо се в до 8% от общата популация, характеризиращо се главно с атрофия на окситичните жлези с последваща липса на стомашна киселина и в късен стадий липса на вътрешен фактор. Често се наблюдават положителността на автоантителата срещу париеталните клетки и/или присъщият фактор, присъствието на автоимунни заболявания като автоимунно заболяване на щитовидната жлеза или диабет тип 1 (24-27). В проучване, проведено през 2008 г. (27), от 319 разследвани пациенти с атрофичен гастрит, 169 (53%) са имали свързано с това заболяване на щитовидната жлеза и 89 (52,7%) от тях не са знаели за него. Заболяването на щитовидната жлеза е автоимунно при 128 пациенти (75,7%) и неавтоимунно при 41 пациенти. Логистичната регресия показа, че рисковите фактори за автоимунно заболяване на щитовидната жлеза при пациенти с атрофичен гастрит са женски пол (коефициент на съотношение 5.6), наличие на антитела на париетални клетки (коефициент 2.5) и наличие на метапластична атрофия (коефициент 2.2). Тези данни показват, че автоимунното заболяване на щитовидната жлеза и атрофичният гастрит се срещат по тясно свързан начин и те предполагат, че пациентите с атрофичен гастрит трябва да бъдат изследвани за окултно автоимунно заболяване на щитовидната жлеза, по-специално жени и тези с положителни антитела на париеталните клетки (27).
Често клинично проявление на атрофичен гастрит е пернициозната анемия, мегалобластна анемия, произтичаща от малабсорбция на витамин В12 като последица от вътрешен дефицит на фактор (28,29). Атрофичният гастрит може да се прояви и с желязодефицитна анемия, дължаща се на малабсорбция на желязо, като последица от намалената секреция на стомашна киселина заедно с нормални или ниски нива на кобаламин (30,31), а някои от тези пациенти с течение на времето могат да развият явна злокачествена анемия (32). Причините за тези различни клинични прояви на пациенти с атрофичен гастрит, съдържащи подобни стомашни промени, които на практика водят до дефицит на витамин В12, не са известни и може да имат генетична основа. В скорошно проучване, при което група от единични нуклеотидни полиморфизми, свързани с абсорбцията на кобаламин, е изследвана при пациенти с атрофичен гастрит със и без пернициозна анемия в сравнение със здрави контроли, показва, че генетичен вариант на транскобаламин II, свързан с по-ниски нива на витамин В12, е по-често при пациенти с пернициозна анемия в сравнение с контролите, показващи правдоподобността на генетични фактори, определящи възможната клинична проява на атрофичен гастрит (33).
Пернициозната анемия, възможният краен стадий на атрофичен гастрит, се счита за автоимунно разстройство (28,29). Към днешна дата няма ясни общоприети критерии за определяне на автоимунен гастрит и за разграничаване на тази клинична единица от хроничен атрофичен гастрит, задвижван от H. pylori. В предишна работа беше показано, че характеристики, които трябва да помогнат да се направи разлика между автоимунен и неавтоимунен гастрит, като позитивност към антитела на вътрешния фактор и париетални клетки, наличие на ентерохромафиноподобни клетки, пернициозна анемия и активна инфекция с H. pylori, са сходни при пациенти с ограничен корпус атрофичен гастрит (класическата хистологична характеристика на автоимунния гастрит) и такива с антрален и телесен атрофичен гастрит (главно приписван на инфекция с H. pylori), което показва, че специфичните клинично-хистологични характеристики, свързани с автоимунния гастрит, са далеч от добре дефинирани (31).
Неотдавнашен систематичен преглед оценява честотата на атрофичен гастрит при пациенти, свободни от атрофичен гастрит в момента на включване в проучването (34). Авторите са избрали 14 последващи проучвания, при които атрофичният гастрит е диагностициран чрез хистология (12 проучвания) или от серумен пепсиноген (две проучвания). Честотата на атрофичния гастрит варира от 0 до 10,9% годишно, вероятно обяснено от конкретните клинични условия, при които се поставят диагнозите за атрофичен гастрит, включително пациенти с рефлуксен езофагит и успешно лекувани за инфекция с H. pylori с най-ниска честота (0 %) (35,36) и пациенти, претърпели ваготомия поради пептична язва с най-висока честота (37). В мета-анализ съотношенията на честотата, сравняващи честотата на атрофичен гастрит при положителни пациенти с H. pylori и тези при отрицателни на H. pylori, варират от 2,4 до 7,6 с обобщена оценка от 5 (95% CI: 3,1-8,3) (34 ).
В други проучвания разпространението на атрофичния гастрит се оценява чрез серологичен скрининг, като се използват сурогатни маркери на стомашната функция (пепсиноген I или съотношение пепсиноген I/пепсиноген II) или чрез гастроскопия/хистология. В много случаи серологичният и хистологичният скрининг са направени в обща популация. Серологичните проучвания съобщават за честота на разпространение на атрофичен гастрит между 3% и 7%, които са по-ниски от тези, докладвани от хистологичните (38-47). По-високите нива на разпространение на атрофичен гастрит, установени в азиатските страни, могат да бъдат оправдани от по-високия риск от рак на стомаха в тези области и различното определение на диагнозата атрофичен гастрит между западните и азиатските страни. В проучвания, докладвани от азиатски страни, диагностиката на атрофичен гастрит включва всички атрофични лезии, независимо от локализацията на атрофията в стомашната лигавица (антрална и/или корпусна); в по-голямата част от проучванията, проведени в западните страни, диагностиката на атрофичен гастрит включва само пациенти с атрофично тяло като корпус-атрофичен гастрит или мултифокален атрофичен гастрит.
Съвсем скорошно серологично проучване върху 5284 участници в Швеция (48) документира увеличаване на разпространението на атрофичен гастрит сред възрастни на възраст 35-44 години от 22 на 64/1000 между 1990 и 2009 г., но намаляване на разпространението на атрофичен гастрит при участници 55 -64 години от 124 на 49/1000 за същия период на наблюдение. Стабилизиращата сероперевалентност на H. pylori и нарастващото разпространение на наднорменото тегло и затлъстяването може да допринесат за тази неочаквана тенденция; необходими са обаче проучвания, за да се определи дали тези промени са повлияли на честотата на рак на стомаха (48).
Атрофичен гастрит и риск от стомашни новообразувания
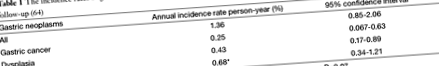
Ракът на стомаха все още е четвъртият най-често срещан рак в света и втората причина за смърт, свързана с рак (49). Съобщава се за различна степен на прогресия на атрофичния гастрит до рак на стомаха до 2% годишно в периоди на проследяване, вариращи от 1 до 16 години (50-52). Неотдавнашен систематичен преглед показа при пациенти с атрофичен гастрит с пернициозна анемия обединен процент на заболеваемост от рак на стомаха от 0,3% човек годишно и изчислен 7-кратен относителен риск от рак на стомаха (53).
Що се отнася до наблюдението на стомашни карциноиди тип 1, показанията са още по-несигурни. Неотдавнашно проучване за ендоскопско лечение на тези тумори съобщи, че при пациенти с атрофичен гастрит без повтарящи се стомашни карциноиди тип 1, ендоскопските контроли могат да бъдат планирани ежегодно в началото на проследяването, но вероятно могат да станат по-малко интензивни с ендоскопски контрол на всеки 4 години според атрофичен скрининг за гастрит за риск от рак на стомаха (62). За да се оцени по-добре стойността на наблюдението при пациенти с атрофичен гастрит и да се установят честоти на проследяване, са необходими по-точни данни за появата на стомашни неопластични лезии, за предпочитане получени в големи проспективни проучвания с адекватно проследяване (63).
Характеристиките на пациентите, свързани с рак на стомаха и стомашни карциноиди тип 1, са различни, като са в крак с различните патогенетични механизми на тези два вида тумори (4,21). Появата на стомашни карциноиди тип 1 се свързва главно с характеристиките на автоимунния гастрит като пернициозна анемия и позитивност към стомашни автоантитела. Вместо това ракът на стомаха се свързва с наличието на H. pylori в телесната лигавица (HR 8) (64), като е в крак с концепцията за преобладаващ корпус гастрит, както се наблюдава от Uemura преди повече от десет години, че H. pylori е положителен пациентите и тези с тежка стомашна атрофия, преобладаващ корпус гастрит или чревна метаплазия са изложени на повишен риск от рак на стомаха (9). Фигура 1 показва кривите на Каплан на рак на стомаха и карциноиди по отношение на пернициозната анемия: Наличието на пернициозна анемия е свързано със стомашни карциноиди, но не и с рак на стомаха, тъй като оцеляването без карциноиди е значително по-кратко при пациенти с пернициозна анемия.
Стана ясно, че освен H. pylori, други бактерии могат да участват в стомашната канцерогенеза; доказано е, че в микробиотата на рака на стомаха преобладават видове от родовете Streptococcus, Lactobacillus, Veillonella и Prevotella, въпреки че трябва да се определят ролите на тези видове в развитието на рак на стомаха (70). Фигура 2 дава схематичен преглед на промените в интрагастралната среда, които вероятно са свързани с по-високия риск от стомашни новообразувания при пациенти с атрофичен гастрит.
Откриване на атрофичен гастрит и премалигнени промени
Въпреки че честотата на рак на стомаха е намаляла през последните десетилетия, особено в западните страни, смъртността поради рак на стомаха остава висока (71). Откриването и наблюдението на пациенти с предмалигнени състояния, като атрофичен гастрит и чревна метаплазия, може потенциално да доведе до откриване и лечение на напреднали лезии - т.е. диспластични лезии и рак на стомаха - в ранен стадий (72-74). При пациенти с предмалигнени състояния рискът от развитие на рак на стомаха може да бъде допълнително стратифициран по местоположение, тежест и степен на стомашна атрофия и/или метаплазия (75,76).
Разработени са няколко хистологични класификации за атрофичен гастрит и пренеопластични промени. Към днешна дата в клиничната практика и в научните изследвания се използва главно обновената Сидни система. Тази система комбинира топографска, морфологична и етиологична информация за стандартизиране на хистологичните отчети (77). Съвсем наскоро са предложени системите, известни като OLGA (оперативна връзка за оценка на гастрит) и OLGIM (оперативна връзка за стомашно-чревна метаплазия) за стадиране на гастрит (78). За съжаление, класификациите все още са трудни за използване в клиничната практика и често представляват недостатъка на важните вариации между и между наблюдателите (79).
Заключения
Атрофичният гастрит и чревната метаплазия са премалигнени промени, които при голяма част от пациентите за щастие никога няма да прогресират до аденокарцином от чревен тип или стомашен карциноид тип 1. До този момент бяха положени много усилия за получаване на знания за тези състояния и за оптимизиране на управлението и наблюдението на пациенти с атрофичен гастрит и/или чревна метаплазия. Напоследък се съобщава, че анализът на наноарит е в състояние да открие предракови стомашни лезии и рак на стомаха чрез издишан дъх и че евентуално би могъл да осигури липсващия неинвазивен скрининг за рак на стомаха и свързаните с него предракови лезии, както и за наблюдение последно (81). Докато се чака валидирането на тези или други иновативни инструменти, важните въпроси трябва да бъдат разгледани по-добре, тъй като включването на пациенти с автоимунен гастрит и пернициозна анемия сред пациенти с по-висок риск от рак на стомаха и карциноиди и оптимален интервал от време и икономическа ефективност на ендоскопско-хистологично проследяване при пациенти с атрофичен гастрит и чревна метаплазия.
Благодарности
Бележка под линия
Конфликт на интереси: Авторите нямат конфликт на интереси, който да декларират.
- Диета за атрофичен гастрит Разпространение, причини, симптоми, видове и лечение
- 5 Симптоми на гастрит и как да се предотврати грижа за стомашния еруфу
- Хранителни фактори за развитието на стомашно-чревна метаплазия при функционална диспепсия
- Бандиран байпас на Roux-en-Y при пациенти със супер болезнено затлъстяване (BRandY-проучване) протокол на
- Бариатрична хирургия - лапароскопски стомашен байпас