Резюме
Стомашната дисплазия е неопластична лезия и предшественик на рак на стомаха. Класификациите в Падуа, Виена и Световната здравна организация са разработени, за да се преодолеят несъответствията между западните и японските патологични диагнози и да се осигури общоприета класификация на стомашната епителна неоплазия. Понастоящем естествената история на стомашната дисплазия е неясна. Много данни сочат, че пациентите с високостепенна дисплазия са изложени на висок риск от прогресия към карцином или синхронен карцином. Следователно е необходима ендоскопска резекция. Въпреки че се съобщава, че пациентите с нискостепенна дисплазия са изложени на нисък риск от прогресия до карцином, поради забележимите хистологични несъответствия между биопсия на форцепс и ендоскопски образци, се препоръчва ендоскопска резекция за тази лезия, особено при наличието на други рискови фактори ( голям размер; депресиран груб тип; повърхностен еритем, неравности, язва или ерозия; и тубуловилозна или вилозна хистология). Изкореняването на Helicobacter pylori при пациенти с дисплазия след ендоскопска резекция изглежда намалява честотата на метахронни лезии.
ВЪВЕДЕНИЕ
Ракът на стомаха остава едно от най-предизвикателните злокачествени заболявания в света. Стомашната дисплазия е предракова лезия и предпоследния етап в стомашната канцерогенеза, особено чревния тип, както е предположено от Correa [1]. Следователно, идентифицирането, управлението и наблюдението на такива лезии са важни за ранното откриване и профилактика на рак на стомаха. Независимо от това, точната диагноза и управлението на тази лезия остават противоречиви. Следователно в този преглед се обсъждат съвременните познания за тази лезия, заедно със съответните диагностични и терапевтични стратегии.
ОПРЕДЕЛЕНИЕ
Световната здравна организация (СЗО) определя дисплазията в стомашно-чревната система като наличие на хистологично недвусмислен неопластичен епител без данни за тъканна инвазия [2]. Съществува известно объркване по отношение на термините аденом и дисплазия. Първоначално аденомът се счита за повдигната ограничена лезия, или приседнала, или надупчена, за разлика от дисплазията, която се определя като плоска или депресирана лигавица [3]. Използването на термини като „плосък аденом“ или „депресиран аденом“ от някои изследователи е довело до объркване. СЗО определя стомашните аденоми като ограничени полипоидни лезии, съставени от тръбни и/или вилозни структури, облицовани с диспластичен епител [4]. Направени са усилия за стандартизиране на терминологията на аденом и дисплазия; аденомът е дефиниран като неопластични ограничени доброкачествени лезии, несвързани с основно възпаление, като атрофичен гастрит, независимо дали е надупчен, приседнал, плосък или депресиран. За разлика от това, дисплазията се определя като доброкачествени неопластични лезии, свързани с основно възпаление [5]. В момента обаче аденомът и дисплазията се използват безразборно от повечето клиницисти.
КЛАСИФИКАЦИОННИ СИСТЕМИ
маса 1.
Системи за класификация на стомашната епителна неоплазия
| Група I: Нормална или доброкачествена | Реактивна | Категория 1: Отрицателни за дисплазия | Категория 1: Отрицателни за дисплазия | Категория 1: Отрицателни за дисплазия | Няма интраепителна неоплазия/дисплазия |
| Група II: Доброкачествена с атипия | Неопределено за дисплазия | Категория 2: Неопределен за дисплазия | Категория 2: Неопределен за дисплазия | Категория 2: Неопределен за дисплазия | Неопределен за интраепителна неоплазия/дисплазия |
| Група III: Гранична граница | Нискостепенен аденом/дисплазия | Категория 3.1: Неинвазивна нискостепенна неоплазия (нискостепенна аденом/дисплазия) | Категория 3: Неинвазивна нискостепенна неоплазия (нискостепенна аденом/дисплазия) | Категория 3: Мукозна нискостепенна неоплазия (нискостепенна аденом/дисплазия) | Нискостепенна интраепителиална неоплазия/дисплазия |
| Група IV: Силно подозрителни за инвазивен карцином | Високостепенен аденом/дисплазия | Категория 3.2: Неинвазивна високостепенна неоплазия (високостепенна аденом/дисплазия) | Категория 4: Неинвазивна високостепенна неоплазия | Категория 4: Мукозна високостепенна неоплазия | Високостепенна интраепителна неоплазия/дисплазия |
| 3.2.1: Подозрителен за карцином (без инвазия на ламина проприа) | 4.1: Високостепенен аденом/дисплазия | 4.1: Високостепенен аденом/дисплазия | |||
| 3.2.2: Неинвазивен карцином (CIS) | 4.2: Неинвазивен карцином (CIS) | 4.2: Неинвазивен карцином (CIS) | |||
| 4.3: Подозрителен инвазивен карцином | 4.3: Подозрително за инвазивен карцином | ||||
| 4.4: Интрамукозен карцином | |||||
| Група V: Определящ за инвазивен карцином | Инвазивен карцином | Категория 4: Подозрителни за инвазивен карцином (с инвазия на ламина проприа) | Категория 5: Инвазивна неоплазия 5.1: Интрамукозен карцином 5.2 Субмукозен карцином или извън него | Категория 5: Субмукозна инвазия от карцином | Интрамукозна инвазивна неоплазия (интрамукозен инвазивен карцином) |
| Категория 5: Инвазивна неоплазия (интрамукозен/субмукозен карцином или bevond) | Инвазивна неоплазия |
JRSGC, Японско изследователско дружество за рак на стомаха; СЗО, Световната здравна организация; CIS, карцином in situ.
КЛИНИЧНИ ХАРАКТЕРИСТИКИ И ЕСТЕСТВЕНА ИСТОРИЯ
Съобщава се, че разпространението на дисплазия е от 0,5% до 3,75% в западните страни и 9% до 20% в региони с висока честота на стомашен аденокарцином, като Колумбия и Китай [11]. Пациентите с такива лезии са предимно мъже и са
10 години по-млади от пациенти с рак на стомаха (61,35 години за стомашна дисплазия срещу 70 години за рак на стомаха) [12]. Стомашната дисплазия може да се открие навсякъде в стомаха, но най-често в антрума [13]. Повечето стомашни дисплазии се откриват случайно по време на скринингови ендоскопски изследвания.
Както LGD, така и HGD имат потенциал да прогресират до карцином. Следователно, прогнозирането на риска от злокачествена трансформация при диагностицирането на тези лезии е важно. Въпреки това, реалният риск от прогресия до рак за дисплазия остава неясен. Всъщност, добре дефинираните дългосрочни проследяващи проучвания, добре проектираните протоколи за вземане на проби от биопсия и получаването на информирано съгласие на пациента могат да бъдат проблематични в клиничните изпитвания по отношение на изясняване на естествената история на стомашната дисплазия. Рискът от злокачествени промени се увеличава с хистологичната степен на дисплазия. Предишни проучвания постоянно показват, че пациентите с HGD са изложени на висок риск от прогресия към карцином или синхронен карцином. Съобщава се, че степента на злокачествена промяна на HGD варира от 60% до 85% за среден интервал от 4 до 48 месеца [14-20]. Неотдавнашно национално кохортно проучване, което показа това
25% от пациентите с HGD са получили диагноза рак на стомаха в рамките на 1 година от първоначалната диагноза, потвърждават високия риск от злокачествени промени в HGD [21]. В сравнение с HGD, LGD има по-нисък риск от прогресия до карцином. Документирано е, че LGD регресира при 38% до 75% и продължава в 19% до 50% от случаите [22]. От случаите на LGD, 0% до 23% показват злокачествени промени в рамките на средно от 10 до 48 месеца [15,18,20,23,24]. Последните наблюдателни проучвания потвърдиха ниския риск от злокачествени промени при пациенти с LDG (3% до 9%) [20,23].
Стомашната дисплазия има висок риск от синхронен карцином в други области на стомаха [25]. Синхронен аденокарцином е открит при до 30% от пациентите със стомашна дисплазия [26].
ХИСТОЛОГИЧНА НЕДОСТАТЪЧНОСТ: ФОРПСИРА БИОПСИЯ И ЕНДОСКОПСКА РЕЗЕКЦИЯ
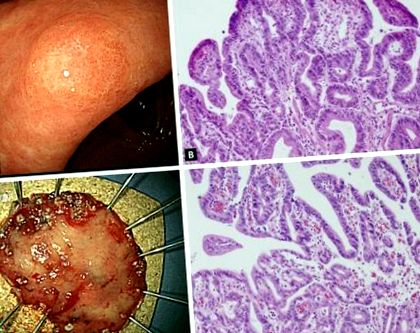
Загриженост относно точната диагноза на стомашна дисплазия е, че пробите от биопсични ендоскопски форцепс не са представителни за цялата лезия; следователно могат да бъдат открити значителни несъответствия между хистологични диагнози, основани на биопсия на форцепс и резецирани проби (фиг. 1). Поредица от проучвания съобщават, че диагностиката на LGD чрез биопсия на форцепс може да бъде надградена до HGD или карцином. Неотдавнашен мета-анализ [27] от 16 проучвания, включващи 3 303 пациенти с доказана биопсия на ендоскопски форцепс, стомашни лезии на LGD показа, че 25% са диагностицирани като напреднали лезии, включително стомашен HGD (16,7%) и стомашен карцином (6,9%) след ендоскопска резекция . С други думи, един от четирите доказани биопсия на форцепс стомашни LGD може да бъде недостатъчно диагностициран и всъщност трябва да бъде HGD или дори стомашен карцином. Този висок процент на недостатъчно диагностициране показва, че само проследяваща стратегия е недостатъчна за пациенти с LGD.
Лезия, чиято диагноза е надградена от стомашна нискостепенна дисплазия до ранен рак на стомаха след ендоскопска резекция. (А) Ендоскопските находки преди ендоскопска резекция показват 0,6 × 0,5 cm повърхностно повишена маса при по-малката кривина на антрума. (B) Хистологични характеристики на дисплазия с ниска степен в първоначалния образец за биопсия на форцепс (H&E, × 200). (C) Образец за ендоскопска субмукозна дисекция (3,7 × 2,7 cm). (D) Хистологични характеристики на резецирания образец. Очевиден е умерено диференциран тубуларен аденокарцином, възникващ от тубуларен аденом. Туморът е с размер 0,5 × 0,4 cm (H&E, × 200).
Повторната ендоскопска биопсия е възможно решение на този проблем. Това обаче има и ограничения, както се вижда от 70,4% степен на хистологично съответствие между повторна ендоскопска биопсия и проби от посттендоскопска резекция [28].
Теоретично, получаването на по-голям образец с помощта на голямата чаша джамбо биопсични форцепси (отворен диаметър 8 mm) може да увеличи точността на диагностиката. Неотдавнашно проучване обаче съобщава, че образците на биопсични дръжки форцепси не увеличават степента на конкордантност в сравнение с конвенционалните образци на форцепс (отворен диаметър 6,8 mm) [29]. Вместо това авторите препоръчват да се получат най-малко четири проби от ендоскопска биопсия, за да се подобри хистологичната точност. Това доведе до повишен процент на съгласуваност при LGD от 76,2% за първата ендоскопска биопсия на 95,2% [29]. Увеличаването на броя или размера на форцепсните биопсии може да промени неопластичната лезия и да причини субмукозна фиброза, което може да направи ендоскопска резекция проблематична. Следователно тези стратегии за подобряване на диагностичната точност имат ограничения по отношение на клиничното приложение.
Важно е да се определи вида на стомашния LGD, който вероятно ще бъде недостатъчно диагностициран. По този въпрос са докладвани различни констатации. Общоприето е, че вероятността от злокачествена трансформация на дисплазия се увеличава с размера на лезията. Аденом с диаметър 2 cm или повече се счита за потенциално злокачествен [30]. Няколко проучвания потвърдиха, че размерът на лезията ≥ 2 cm е независим предиктор за подобрена хистология при LGD лезии. Въпреки това, дори малки проучвания с LGD (12 месеца) показват, че ликвидирането на H. pylori значително променя естествената история на напреднали предракови промени [58]. Установен е значително по-нисък риск от еволюция във високостепенна неинвазивна неоплазия или в инвазивен рак на стомаха при пациенти с нискостепенна неинвазивна неоплазия, унищожена от H. pylori, в сравнение с тези с положителна нискостепенна неинвазивна неоплазия. Към днешна дата предимството на доказателствата предполага, че изкореняването няма ефект върху дисплазията.
Някои изследвания обаче показват, че ерадикацията на H. pylori може да предотврати развитието на метахронни лезии след ендоскопска резекция на стомашна дисплазия. В едно ретроспективно проучване на 1872 пациенти със стомашна дисплазия, претърпели ендоскопска резекция, кумулативната честота на метахронни лезии е била значително по-ниска в групата, унищожена от H. pylori, отколкото групата, устойчива на H. pylori (нерадикирана или неуспешна) [59]. Друго ретроспективно проучване анализира 1007 пациенти с EGC, които са били подложени на ендоскопска резекция, и установява, че ерадикацията на H. pylori намалява метахронния рецидив на стомашната неоплазма [60]. Освен това този резултат остава очевиден в анализ, който включва 480 пациенти с LGD [60]. Друго ретроспективно проучване, което оценява 129 пациенти, положителни за H. pylori, които са подложени на ендоскопска резекция за стомашна дисплазия [61], установи, че ерадикацията на H. pylori е независим рисков фактор за намалена честота на последваща стомашна дисплазия. Следователно ерадикацията на H. pylori може да бъде полезна за профилактика на метахронни лезии след ендоскопска резекция при пациенти със стомашна дисплазия.
Понастоящем европейските насоки препоръчват ерадикация на H. pylori за пациенти с предишна дисплазия след ендоскопска или хирургична терапия [45]. Указанията на ASGE също препоръчват ерадикация на H. pylori при пациенти с дисплазия. В допълнение, те препоръчват системно вземане на проби от околната неполипоидна стомашна лигавица за оценка на H. pylori и метапластичен атропен гастрит при наличие на множество дисплазии [44].
ЗАКЛЮЧЕНИЯ
Точната диагноза, управление и наблюдение на стомашната дисплазия са от решаващо значение за ранното откриване и профилактика на рак на стомаха. Поради значителните диагностични несъответствия между биопсия на форцепс и ендоскопски резецирани проби, ендоскопската резекция трябва да се има предвид не само за диагностика, но и за лечение на стомашна дисплазия. Фигура 2 показва предложена стратегия за лечение на стомашна интраепителна дисплазия, диагностицирана чрез ендоскопска биопсия. Ендоскопското наблюдение е от съществено значение и ерадикацията на H. pylori може да бъде полезна за предотвратяване на метахронни лезии след ендоскопска резекция при пациенти със стомашна дисплазия.
Предложение за стратегия за лечение на стомашна интраепителна неоплазия/дисплазия, диагностицирана чрез ендоскопска биопсия. препоръчва се ерадикация на Helicobacter pylori, ако се идентифицира след ендоскопска резекция при пациенти с дисплазия.
Бележки под линия
Не е докладван потенциален конфликт на интереси, отнасящ се до тази статия.
- Цианоза при котки - симптоми, причини, диагностика, лечение, възстановяване, управление, цена
- Болница за реки на стомаха
- Стомашно байпасно приятелско хранене Диня и пъпеши - Отслабване
- Обучение за отслабване на стомашния байпас за отслабване на мозъка ABC News
- Стомашна лента Орегон Отслабване хирургия