Катедра по медицина V и
Катедра по медицина V и
Институт за експериментални клинични изследвания, Университетска болница в Орхус, DK-8000 Aarhus C; и
Катедра по медицина V и
Катедра по медицина А, Държавна университетска болница, 2100 Копенхаген, Дания
Катедра по медицина А, Държавна университетска болница, 2100 Копенхаген, Дания
Катедра по медицина V и
Резюме
Пропиляването на стероиди е причинено отчасти от увеличаване на разграждането на тъканните протеини и нетното освобождаване на амино N и отчасти от ускорената чернодробна конверсия на амино N в урея N (6, 37, 40). За разлика от това е показано, че растежният хормон (GH) е в състояние да увеличи нетното усвояване на амино N в тъканите, а също и да намали чернодробната конверсия на амино N в урея N (15). Наскоро беше показано, че GH е в състояние да предотврати катаболните странични ефекти на стероидите при хората (25).
Поставяме хипотезата, че този ефект на GH за предотвратяване на стероидния катаболизъм, освен промяна в протеиновия метаболизъм, включва и регулаторни събития в чернодробната функция по отношение на синтеза на урея и това е свързано с регулиране на генните функции.
При плъхове е възможно да се стандартизира синтеза на урея по отношение на задвижването на субстрата чрез измерване на капацитета на синтез на урея N по време на насищане на натоварване с аланин (18), като по този начин се позволяват изследвания за специфични хормонални ефекти върху синтеза на урея.
Изследвахме ефекта от 7 дни лечение с преднизолон и GH еднократно и в комбинация върху капацитета на синтеза на урея N, експресията на нивата на иРНК на ензимите на урейния цикъл в черния дроб, съдържанието на N тъкан в различни тъкани и баланса на N на цялото тяло.
Животни
Женски плъхове Wistar (телесно тегло 200–210 g; Център за разплод Møllegaard, Eiby, Дания) бяха настанени при 22 ± 2 ° C, 55 ± 10% относителна влажност, промяна на въздуха 8–10 пъти в час и в 12:12 -h цикъл светлина-тъмнина (0630–1830 светлина). Животните имаха свободен достъп до стандартна храна (Altromin диета № 1324; Chr. Petersen, Slagelse, Дания) и чешмяна вода.
Всеки плъх се претегля всеки ден по време на лечението и преди експерименталните процедури. Приемът на храна и вода се записва всеки ден за всяка клетка, като всяка съдържа по два плъха. Два дни преди процедурите за изследване, всички плъхове бяха настанени поотделно в метаболитни клетки, за да се определи N баланс.
Протоколи
Имаше пет проучвателни групи: 1) контролни плъхове (н = 20), физиологичен разтвор подкожно два пъти дневно в продължение на 7 дни;2) лекувани с преднизолон плъхове (н = 20), 4 mg/kg преднизолон (Delcortol; LEO) подкожно един път всеки ден в продължение на 7 дни;3) контрол с двойно хранене на лекувани с преднизолон плъхове (н = 20), физиологичен разтвор подкожно два пъти дневно в продължение на 7 дни;4) Плъхове, третирани с GH (н = 20), 1 mg/kg GH подкожно (Novo Nordisk) два пъти дневно в продължение на 7 дни; и5) Плъхове, третирани с GH и преднизолон (н = 20), 4 mg/kg преднизолон и 1 mg/kg GH подкожно.
Проведени са пилотни проучвания за получаване на дози преднизолон, които биха довели до значителна загуба на тегло. Еквивалентът на човешката доза би бил този, използван при, например, възпалителни заболявания на червата. Използваните GH дози са еквивалентни на заместващи дози при хипофизектомирани плъхове. При осем животни от всяка изследвана група концентрацията на а-амино N (AAN) в основната кръв, капацитетът на скоростта на синтез на урея (CUNS) и балансът на N на цялото тяло се определят след гладуване през нощта. Базалният инсулин и глюкозата бяха определени за оценка на инсулиновата чувствителност и общия инсулиноподобен растежен фактор I (IGF-I) за контрол на лечението. Съдържанието на N в черния дроб, бъбреците, солеуса и екстензора дигитурум лонгус (EDL) беше определено заедно с нивата на чернодробните иРНК на петте ензимни цикъла на урея, карбамоил фосфат синтетаза (CPS), орнитин транскарбамоилаза (OTC), аргинино сукцинат синтетаза (ASS), аргинино сукцинат лиаза (ASL) и аргиназа (ARG) при осем животни от всяка група. CUNS и mRNAs бяха измерени при отделни, но иначе третирани животни, което гарантира, че аминокиселинното натоварване на определенията на CUNS не влияе на генната експресия.
Експериментални процедури
Веднага след обезглавяването, органите бяха изолирани и претеглени след попиване върху филтърна хартия, незабавно замразени в тото в течност N и съхранявани при -80 ° C до анализ. Мускулните влакна тип I са предимно в солеус (84% тип I, 16% тип IIa, 0% тип IIb), а влакната тип II са представени главно от EDL (3, 57 и 40%; вж. Реф. 24); немускулен протеин беше изследван по съдържание в черния дроб и бъбреците. N балансът се оценява, както следва. През последните 2 дни от разследвания период животните бяха настанени в метаболитни клетки и беше определено количеството храна, погълнато от всяко животно. Анализирани са проби от количествено събрана урина за общо съдържание на N и урея, а проби от изпражнения - за съдържание на N. От тези измервания се изчислява N баланс (mmol/24 h) като средно значение за тези 2 дни, за да се минимизират ежедневните вариации.
CUNS. След анестезия с подкожна инжекция от 0,75 ml/kg Hypnorm (фентанил/флуанизон; Jansen Pharma, Birkeroed, Дания) и 4 mg/kg мидазолам (Dormicum; La Roche, Базел, Швейцария), катетър (Neoflon 0,6 mm; Viggo- Spectramed, Хелсингборг, Швеция) е вкарана във феморалната вена за непрекъсната инфузия. При всички животни (н = 8 във всички групи), ретроперитонеална двустранна нефректомия (за улесняване определянето на синтеза на урея, виж по-долу) е извършена непосредствено преди началото на изследването (18). Тази процедура сама по себе си не оказва остро влияние върху CUNS (18), която остава непроменена до 12 часа след хистеректомия и е най-много след 24 часа (21). Взети са кръвни проби от ретробулбарен венозен плексус с помощта на хепаринизирани микропипети (Vitrex; Horsens Laboratory Equipment).
За определяне на CUNS се прилага аланин според телесното тегло като болус от 0,7–0,9 ml от разтвор от 1 120 mmol/l в стерилна вода, последван от постоянна инфузия от 2,8–3,5 ml/h от разтвор от 224 mmol/l за 70 мин с помощта на инжектомат (Perfusor Secura; Braun, Melsungen, Германия). AAN в кръвта в стационарно състояние се определя като колебания под 10% по време на поне 50 минути от проучването, а инфузията на аланин е насочена към получаване на обща AAN на кръв в стационарно състояние между 7,3 и 11,6 mmol/l; в този интервал синтезът на урея е най-много при плъхове, т.е. наситен и по този начин независим от концентрацията на субстрата (18). Взема се проба от кръв (100 μl) на интервали от 10 минути след първоначален период на уравновесяване от 20 минути за определяне на карбамид в кръвта и общ AAN. Отстранени са общо 1 ml кръв. Този обем се компенсира чрез инфузия на аланин.
Плазмен IGF-I, глюкоза и инсулин се определят при всички животни веднага след анестезия и нефректомия.
Определяне на иРНК
Около 200 mg чернодробна тъкан от левия лоб на шест отделни, но иначе третирани плъхове от всяка изследвана група веднага се съхраняват в течност N. Общата РНК се изолира с комплект Promega Z 5110 въз основа на метода на тиоцианата, съгласно спецификацията на производител.
Специфичността на всички сонди е установена чрез авторадиография на Northern blots, показваща хибридизационни сигнали в очакваните места. Слот блотове бяха използвани за количествено определяне на нивата на иРНК с помощта на Schleicher и Schuell Minifold. След попиване, филтрите бяха ултравиолетови омрежени в страталинкер (Stratagene). Стандартната грешка при зареждане, изчислена чрез зареждане на същия екстракт в 6–10 ямки, беше средно 7%. При последните измервания тази процедура е променена, така че сега използваме хибридизация на рибозомна РНК като индекс на mRNA сигнал. Тази промяна в процедурата не е повлияла на резултатите.
Хибридизация. Около 25 ng cDNA бяха белязани чрез произволно грундиране, използвайки мултипрайм кит RPN 1601Z (Amersham) и елуирани върху NICK спин колони (Pharmacia). Прехибридизацията се извършва при 42 ° С за 1 h в разтвор на 50% формамид (Merck), 10 × разтвор на Denhart (Sigma), 0,05 M Tris, pH 7,4, 1 M NaCl, 1% SDS (тегло/обем), 0,1 % натриев пирофосфат (тегл./об.) и 0,25 mg/ml ДНК на сперматозоиди от сьомга (Sigma); ултразвук и потопен във вряща вода за 15 минути; и след това се добавя към разтвора. Хибридизацията се извършва при 42 ° С в продължение на 16 часа с разтвора, както по-горе (с изключение на 0,25 mg/ml ДНК от сперма от сьомга) с добавена маркирана сонда. Накрая, филтрите се измиват два пъти с 0,1 × SSC и 0,5% SDS (тегло/обем) при 65 ° С за 30 минути.
Фосфоизобразяването е направено върху образна плака BASIII под щит и хибридизационният сигнал е анализиран в Fujix Bioimaging Analyzer System BAS2000 (Fuji Photo Film).
cDNA сонди. cDNA сондите бяха както следва: CPS I, pCPSr Pst 850 b (8); OTC, pOTC1 Хинd III 388 b (32); ASS, pASr11 Pst I 1450 b (38); ASL, AL-2ЕкоR1 1000 b (4); и ARG, 3B1Pst I 650 b (10).
ДНК фрагменти бяха разделени чрез електрофореза в агарозен гел и елуирани в Spinbind ДНК екстракционни единици (FMC).
Обем на разпределение на карбамид
Обемът на разпределение на урея (VD) се определя при четири нефректомирани животни от всяка изследвана група чрез интравенозна болусна инжекция (D) от ~ 1 mmol урея. След това се проследява концентрацията на урея в кръвта в продължение на 60 минути. След 20 минути разпределението на карбамида завърши. Обемът на разпределение се изчислява като VD = D/(co - ci), където D е количеството инжектирана урея, co е средната концентрация на карбамид в кръвта в интервала 20–60 минути след инжектиране на карбамид и ci е кръвта концентрация на урея непосредствено преди инжектиране на урея. VD спрямо телесното тегло е 64 ± 2% при всички контролни групи, 65 ± 4% при лекувани с преднизолон плъхове, 69 ± 3% при третирани с GH животни и 68 ± 2% при плъхове, лекувани както с преднизолон, така и с GH ( средно ± SE). Нито двамата не се различават от 63%, открити по-рано (2), който е използван при всички настоящи изчисления.
Хидролиза на уреята в червата
Новосинтезирана урея се губи в червата чрез бактериална хидролиза и полученият амоняк се рециклира в черния дроб, за да възпроизведе урея. За да се определи тази фракция (L), четири плъха от всяка група бяха нефректомизирани и инжектирани интравенозно с 2 μCi [14 С] урея. След 20 минути разпределението на [14 С] урея беше завършено. След това се взема проба от кръв на всеки 10 минути в продължение на 70 минути, за да се определи кръвната активност на [14 С] урея. Радиоактивността в кръвните проби беше измерена чрез преброяване в hisafe 2 (Wallac) с помощта на течен сцинтилационен брояч (Wallac 1409-2). Наклонът на разпадане на радиоактивността в кръвта отразява микробиотична уреаза-зависима чревна загуба на урея (L). L е 0,14 ± 0,08 при контролите, 0,13 ± 0,09 при третираните с преднизолон плъхове, 0,12 ± 0,1 при третираните с GH животни и 0,12 ± 0,09 при плъховете, лекувани както с преднизолон, така и с GH (средно ± SE). Контролната стойност беше използвана при всички настоящи изчисления.
Анализи
Концентрацията на урея в кръвта е измерена по метода на уреаза-Бертелот (11), а общата AAN в кръвта по метода на динитрофлуорбензола (13). Серумният IGF-I беше измерен след екстракция с киселинен етанол чрез радиоимуноанализ (RIA), използвайки поликлонално заешко антитяло (Nichols Institute Diagnostics, San Capistiano, CA) и рекомбинантен човешки IGF-I като стандарт (Amersham International, Amersham, Bucks, UK). Серумната глюкоза се измерва в два екземпляра по метода на глюкозооксидазата (Beckman оксидативен глюкозен анализатор 700). Серумният инсулин се измерва чрез RIA, като се използва рекомбинантен човешки 125 I-инсулин като индикатор, пречистен инсулин от плъх като стандарт и поликлонални антитела на морски свинчета (всички реагенти от Novo Nordisk, Bagsværd, Дания). Всички проби бяха анализирани в три екземпляра в един анализ. Съдържанието на орган N се определя по метода на микро-Кьелдал, както е описано по-горе.
Изчисления
N балансът се изчислява като
Статистически методи
Резултатите са дадени като средни стойности ± SE. Статистиката е извършена с помощта на пакета Solo Statistics Software (BMDP Statistical Software, Los Angeles, CA). Данните бяха анализирани с помощта на еднопосочен дисперсионен анализ, последван от метода на Student-Newman-Keuls за множество сравнения, когато е подходящо. Дву опашка P стойност под 0,05 се счита за значима.
Прием на фураж
Лечението с преднизолон в продължение на 7 дни намалява приема на фураж с 20% (P 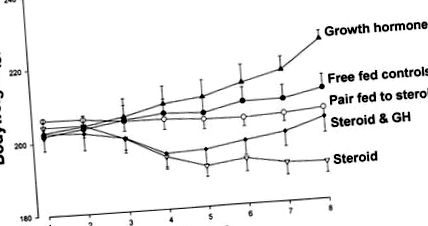
Фиг. 1.Телесно тегло на плъхове, лекувани 7 дни или с плацебо (контроли за свободно хранене, •), 4 mg ⋅ kg −1 ⋅ ден -1 преднизолон (стероид, ▿), плацебо и сдвоени с лекувани с преднизолон животни (двойка, хранена със стероид ○), 1 mg ⋅ kg −1 ⋅ ден -1 растежен хормон (GH, ▴) или преднизолон плюс GH (стероиди и GH, ◆).
Фиг. 2.N баланс като средно за дни 6–8след лечение с което и да е от плацебо (Con,н = 8), 4 mg ⋅ kg −1 ⋅ ден -1 преднизолон (стероид), плацебо и двойка, хранени с третирани с преднизолон животни (Stpf), 1 mg ⋅ kg −1 ⋅ ден −1 GH или комбинирани преднизолон и GH ( ST + GH). Пръчките представляват средно ± SE. * Значителна разлика (P # Значителна разлика (P
Съдържание на орган N (mg N)
Промените в теглото на органи и съдържанието на N органи са били успоредни и е дадено само последното. Преднизолонът намалява съдържанието на N в сърдечните и скелетните мускули, докато съдържанието на N в черния дроб и бъбреците остава същото. Лечението с GH увеличава съдържанието на орган N във всички измерени органи. Комбинирано лечение увеличава съдържанието на N в черния дроб и бъбреците и нормализира съдържанието на N в сърцето и EDL (Таблица 1).
Таблица 1. Съдържание на орган N
Стойностите са средни стойности ± SE; н = 8 плъха във всички групи. Единиците са mg N. EDL, extensor digitorum longus; GH, хормон на растежа.
* P † P
Фиг. 3.Базална концентрация на α-амино N (Горна част,н = 8) и капацитета на синтеза на урея N (CUNS; отдолу) в контролите, лекувани със стероиди плъхове (4 mg ⋅ kg −1 ⋅ ден -1), контролни двойки, хранени с третирани с преднизолон животни (Stpf), третирани с GH плъхове (1 mg ⋅ kg −1 ⋅ ден -1), и плъхове, които са комбинирали лечение с преднизолон и GH. Пръчките представляват средно ± SE. * Значителна разлика (P # Значителна разлика (P
Базална кръв AAN
Преднизолон намалява AAN на базалната кръв с 15 и 33% в сравнение с контролите със свободна и двойна храна, съответно (P
Фиг. 4.Промени в нивата на иРНК за карбамоил фосфат синтетаза (CPS), орнитин транскарбамилаза (OTC), аргинино сукцинат синтаза (ASS), аргинино сукцинат лиаза (ASL) и аргиназа (ARG) в чернодробната тъкан след лечение с преднизолон (4 mg ⋅ kg −1 ⋅ ден −1;A, н= 8), лечение с GH (1 mg ⋅ kg −1 ⋅ ден −1;Б.) и комбинирано лечение с преднизолон и GH (° С). Резултатите са средни стойности за 6 плъхове ± SE, изразени като процент от средните стойности на 6 двойки хранени плъхове. Широчината на излюпената лента е показателна за вариацията в контролните стойности. * Статистически значима разлика (P
Таблица 2. Глюкоза и хормони
Стойностите са средни стойности ± SE; н = 8 плъха във всички групи. IGF-I, инсулиноподобен растежен фактор I.
ЗАБЕЛЕЖКИ НА АВТОРА
Адрес за заявки за повторно отпечатване: T. Grøfte, катедра по медицина V (хепатология и гастроентерология), Aarhus Univ. Болница, DK-8000 Aarhus C, Дания.
- Ефекти от лечението на растежен хормон (GH) върху регулирането на храненето - изглед в пълен текст
- Диетични протеинови ефекти върху растежа и частичния синтез и степен на разграждане на протеина в черния дроб
- Ефект на високо протеинова диета върху 24-часовия профил на Грелин, GH (растежен хормон) и IGF-1
- Хормон на гладно и растеж - Диетичен лекар
- Ефекти от периодичното хранене върху качеството на водата, кожните паразити, консумацията на фураж и растежа
