Жанел Роуъл
1 Служба за тъкани и усъвършенствани терапии, Американска администрация по храните и лекарствата, Силвър Спринг, Мериленд, Съединени щати
Чиа-Юн Ло
1 Служба за тъкани и усъвършенствани терапии, Американска администрация по храните и лекарствата, Силвър Спринг, Мериленд, Съединени щати
Грейм Е. Прайс
1 Служба за тъкани и усъвършенствани терапии, Американска администрация по храните и лекарствата, Силвър Спринг, Мериленд, Съединени щати
Джулия А. Мисплон
1 Служба за тъкани и усъвършенствани терапии, Американска администрация по храните и лекарствата, Силвър Спринг, Мериленд, Съединени щати
Роберта Л. Крим
2 Служба за изследвания и преглед на ваксините, Американска администрация по храните и лекарствата, Силвър Спринг, Мериленд, Съединени щати
Приянка Джаянти
2 Служба за изследвания и преглед на ваксините, Американска администрация по храните и лекарствата, Силвър Спринг, Мериленд, Съединени щати
Джуди Бийлър
2 Служба за изследвания и преглед на ваксините, Американска администрация по храните и лекарствата, Силвър Спринг, Мериленд, Съединени щати
Сузани Л. Епщайн
1 Служба за тъкани и усъвършенствани терапии, Американска администрация по храните и лекарствата, Силвър Спринг, Мериленд, Съединени щати
Свързани данни
Всички съответни данни са в ръкописа.
Резюме
Въведение
Универсалните противогрипни ваксини имат потенциала да намалят тежестта на заболяванията от сезонен и пандемичен грип. Разработихме кандидат-универсална ваксина, базирана на консервирани вируси на грип А (IAV) антигени нуклеопротеин (A/NP) и матрица 2 (M2). Нашите предишни проучвания демонстрираха, че праймирането на ДНК, последвано от усилване със смес от рекомбинантни аденовируси, експресиращи A/NP и M2 (A/NP + M2-rAd) [1, 2] или единична интраназална доза A/NP + M2-rAd [ 3, 4] защита на наивните животни срещу последващо IAV предизвикателство на различни щамове и подтипове, предотвратяване на смърт и тежка загуба на тегло.
При хората влиянието на предишни или продължаващи инфекции върху последващи имунни отговори е изследвано за различни вируси и други патогени [13–15]. Например, цитомегаловирусната инфекция може да повлияе на имунния отговор на грипа [16]. По същия начин отговорите на Т-клетките към епитопите на грипния вирус могат да се припокриват с реактивността към вируса на хепатит С [17] или вируса на Epstein-Barr [18–20]. Последователността на излагане на множество IAV инфекции може също да повлияе на имунния отговор и резултатите. Проучванията показват, че имунното импринтиране се случва с първия срещнат грипен вирус [21–23], повлиявайки чувствителността към различни подтипове IAV, наблюдавани по-късно в живота [24].
Отговорите на ваксините също могат да бъдат повлияни от предишни инфекции. Инфекциите, инициирани в началото на живота, могат да променят отговора на последващи ваксинации, евентуално да намалят способността да реагират на конвенционалните ваксини [15, 25–27]. По-рано демонстрирахме, че историята на ваксинацията влияе върху ефективността на нашата универсална противогрипна ваксина при мишки, което води до подобряване или частично инхибиране на универсалната защита, медиирана от ваксини, в зависимост от естеството на предишните използвани ваксини [28]. Поради това може да е важно да се вземе предвид имунната история, когато се оценяват нови ваксини.
В човешката популация не би било възможно да се каталогизира всяка инфекция на индивида и след това да се оцени въздействието върху ваксинацията. Също така би било трудно да се моделира последователността на вирусни инфекции през целия живот, която е уникална за всеки индивид. Въпреки това, въздействието на предишни инфекции може да бъде изследвано на животински модели, като се използват примери за често срещани патогени, за да се осигури по-реалистичен модел от само наивните животни. В настоящото проучване анализираме ефектите на острата респираторна вирусна инфекция върху ефективността на универсалната противогрипна ваксина, включително защита от IAV предизвикателство и имунни отговори на ваксинални антигени.
Материали и методи
Вируси
Човешки риновирус 1В, щам B632 (RV1B) е получен от American Type Culture Collection (ATCC, Manassas, VA, USA). Вирусът се усилва и пречиства, както е описано по-горе [29]. Накратко, RV1B се амплифицира в H1 HeLa клетки (ATCC, CRL-1958). Клетките се лизират чрез замразяване-размразяване и след това RV1B се утаява, използвайки полиетилен гликол 6000. Вирусът се пречиства и концентрира с помощта на центробежно филтриращо устройство (Amicon Ultra 15 mL Filters (100 000 NMWL), MilliporeSigma, Burlington, MA). Петдесет процента инфекциозна доза от тъканна култура (TCID50) се определя чрез титруване в H1 HeLa клетки. Респираторен синцитиален вирус, щам А2 (RSV-A2) е получен от ATCC, след което е отгледан и приготвен, както е описано по-горе [30]. Доказано е, че RV1B [31] и RSV-A2 [32] се възпроизвеждат в дихателните пътища на мишки.
Използваните щамове на грип A и B са както следва: адаптиран към мишката A/Fort Monmouth/1/47 (H1N1) (A/FM) е предоставен от Earl Brown, University of Ottawa [33], A/Udorn/307/72 (H3N2) (A/Udorn) и B/Ann Arbor/1/86 (B/Ann Arbor) са получени от Брайън Мърфи, Национален институт по алергия и инфекциозни болести, Национални здравни институти. Вирусите се приготвят с помощта на ембрионирани кокоши яйца или белодробни хомогенати на заразени мишки, както беше описано по-рано [34].
Рекомбинантни аденовирусни ваксини
Репликационно-дефицитни (E1 и E3 изтрити) рекомбинантни вектори на аденовирус-5 (rAd), експресиращи консервирани IAV антигени A/NP или M2, са описани по-рано [35, 36]. Рекомбинантен аденовирусен вектор, експресиращ нуклеопротеин на вируса на грип В (B/NP-rAd) [36], беше използван като контрол на специфичността, тъй като не предоставя защита срещу IAV предизвикателство.
Респираторни инфекции
За in vivo проучвания мишките получават интраназална доза от 10 4 TCID50 A/Udorn или 10 5 TCID50 B/Ann Arbor в 50 μL PBS; 5 x 10 5 TCID50 RSV-A2 в 50 μL EMEM (Mediatech, Manassas, VA), съдържащ 1% FBS, 100 mM MgSO4 и 50 mM HEPES [30]; 2 x 10 6 TCID50 или 2 x 10 7 TCID50 RV1B в 50 μL PBS. За RV1B двете различни дози предизвикват имунен отговор при мишки; по-ниската доза е използвана във всички животински групи с изключение на една, както е отбелязано в текста.
Ваксинация и предизвикателство
Мишките бяха имунизирани интраназално под изофлуранова анестезия с 10 10 вирусни частици (vp) на B/NP-rAd или с A/NP + M2-rAd (смес от 5 x10 9 vp A/NP-rAd и 5 x10 9 vp M2 -rAd). Четири седмици по-късно мишките бяха предизвикани с A/FM, използвайки дози, отбелязани във фигурите, и наблюдавани за телесно тегло и оцеляване. Както бе споменато по-горе, 25% загуба на тегло беше използвана като хуманна крайна точка и всички мишки, достигнали тази крайна точка, бяха евтаназирани.
Т-клетъчни отговори на RV1B
Белодробните клетки бяха повторно стимулирани с 106 TCID50 RV1B и интерферон-γ отговорът беше определен чрез ензимно-свързан имуноспот (ELISPOT), както е описано по-рано [35].
Отговори на антитела към RSV-A2
Предимунни серуми и имунни серуми (три седмици след инфекция) са получени от мишки. Серумните IgG антитела към RSV нуклеопротеин (RSV-N) бяха оценени чрез луциферазна имунопреципитационна система (LIPS), използвайки нуклеопротеин RSV-A2, маркиран с Renilla луцифераза, както беше описано по-горе [37]. Серумни проби от всеки експеримент с животни бяха тествани в един анализ. Границата за положителен резултат беше изчислена за всеки анализ на базата на 5 стандартни отклонения над средната стойност за преимунни серуми в този анализ.
Имунни отговори на грипни антигени
Три седмици след като мишките са получили A/NP + M2-rAd, белите дробове и клетките на далака от отделни мишки се оценяват за продукция на IFN-γ в отговор на пептиди, както следва: доминиращият NP CD8 епитоп при мишки BALB/c NP147-155 (NP147), консенсусната последователност на M2 ектодомейн M2e2-24 (M2e) и контрол на SARS M209-221 (SARS) чрез ELISPOT, както е описано по-горе [2, 35]. Серумите са тествани за IgG антитела срещу грип A/NP, B/NP и M2e чрез ELISA с помощта на плочи, покрити с M2e пептид или рекомбинантен NP протеин от щам A/PR/8/34 или B/Ann Arbor [1, 2].
Статистически анализ
Статистическите анализи бяха извършени с помощта на SigmaPlot (Systat Software, Сан Хосе, Калифорния, САЩ). Данните за оцеляване са анализирани чрез log-rank тест с двойни сравнения, използвайки теста на Holm-Sidak. Анализът на телесното тегло след предизвикателство беше извършен с помощта на еднопосочен ANOVA във времева точка (показана със стрелка на фигури), когато се наблюдава 100% оцеляване за всички групи. Post hoc анализите използваха метода на Holm-Sidak или метода на Dunn с A/NP + M2-rAd група като контрола. Данните на ELISPOT бяха анализирани чрез двупосочен ANOVA или t-тест, както е посочено в легендите на фигурите. Бяха направени множество сравнения, използвайки метода на Holm-Sidak с групата A/NP + M2-rAd като предварително определен контрол за животински групи, получаващи различни инокулати, и SARS пептид като контрол за различни стимулиращи пептиди в рамките на една група животни. Стойностите на Р по-малко от 0,05 се считат за статистически значими и са отбелязани на фигурите.
Резултати
Предшестващата грипна инфекция подобрява имунния отговор на A/NP + M2-rAd
Преди това е доказано, че кандидатът за универсална ваксина A/NP + M2-rAd осигурява широка кръстосана защита след еднократна доза. Най-добрата защита е резултат от интраназалната имунизация, път, който генерира ефективно имунитет на лигавицата на Т и В клетките [3] и в момента се използва при хора за живи атенюирани противогрипни ваксини. Ваксинирането срещу A/NP + M2 предизвиква както антитела, така и Т-клетъчни отговори, както е прегледано в [38, 39]. Интраназалната имунизация предизвиква антитела и Т-клетъчни отговори, както системно, така и локално в дихателните пътища. В белите дробове има цитотоксични Т-лимфоцити, които могат да убият инфектирани с грипен вирус цели [40] и специфични за NP147-155 пентамер + или тетрамер + CD8 Т-клетки в белите дробове [2, 3,40].
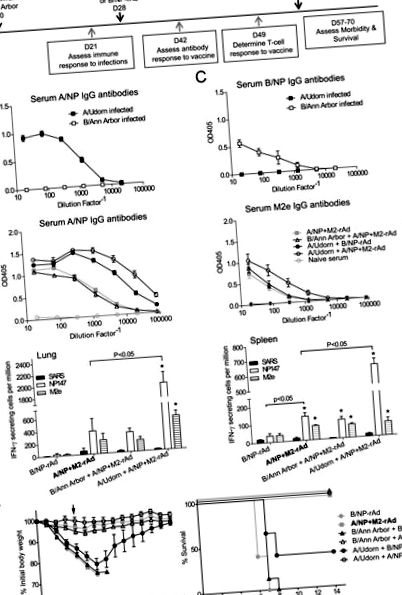
Първо проучихме въздействието на предишната грипна инфекция върху последващите резултати на кандидата за универсална ваксина (Фигура 1А). A/Udorn и B/Ann Arbor се възпроизвеждат добре в белите дробове на мишка [41], но не предизвикват значими клинични симптоми при мишки. Три седмици по-късно мишките са произвели серумни IgG антитела, специфични за A/NP или B/NP (Фигура 1В и 1С). Четири седмици след инфекцията, мишките бяха имунизирани с A/NP + M2-rAd или B/NP-rAd интраназално и още четири седмици по-късно предизвикани с грип A/FM.
Кривите на загуба на тегло и оцеляване са показани на фиг. 1F. При контролни мишки без анамнеза за предишна инфекция, A/NP + M2-rAd самостоятелно защитен от тежка грипна болест, със 100% оцеляване и минимална загуба на тегло. Следователно за оцеляване като крайна точка при тези условия може да се оцени само инхибиране, но не и усилване. Обаче или подобряване или инхибиране на специфичните за ваксината имунни отговори и загуба на тегло ще бъдат откриваеми. Мишките, заразени преди с A/Udorn, последвани от A/NP + M2-rAd имунизация, са имали минимална загуба на тегло след предизвикателство и са оцелели на 100%, резултат толкова добър, колкото A/NP + M2-rAd при наивни мишки. Инфекцията с A/Udorn без универсалната ваксина (A/Udorn, последвана от B/NP-rAd контрол) осигури умерен кръстосан защитен имунитет срещу несъответстващия вирус на A/FM. Мишките показаха значителна загуба на тегло и 40% оцеляване. Предишното излагане на B/Ann Arbor не е повлияло значително резултатите от ваксинацията, последвано от предизвикателство за грип А. Мишките, изложени на B/Ann Arbor и след това A/NP + M2-rAd, показват минимална загуба на тегло след предизвикателство, сравнима с мишки без предварително излагане, и всички мишки са оцелели от IAV предизвикателство. Мишки, на които е дадена B/Ann Arbor и контролната имунизация, B/NP-rAd, са загубили значително тегло след A/FM предизвикателство и всички мишки са се поддали.
RSV-A2 или RV1B вирусите не засягат защитата на ваксината
Инфекциите в по-дълъг интервал преди ваксинацията могат да имат различно въздействие от последните инфекции. Бъдещите проучвания могат да се обърнат към по-дълги интервали от време, за да се определи въздействието върху ваксинацията в различни моменти от развитието на имунната памет към предходна инфекция. Различните патогени могат да представят различни кръстосано реактивни епитопи; избрахме примери за изучаване. Въздействието на инфекциите може също да зависи от генетиката на гостоприемника и дозата на заразяващия патоген или ваксина. Възпалителните ефекти и увреждането на тъканите поради предишна инфекция също могат да играят роля. Бъдещите изследвания могат да отговорят на тези въпроси. Констатациите досега насърчават, че ваксината NP + M2 е ефективна не само при реагиращи без патогени, но и при по-реалистична обстановка на респонденти с опит с респираторна инфекция.
Съгласно стандартните препоръки конвенционалните противогрипни ваксини не трябва да се прилагат, ако предполагаемият реципиент е болен, но тези с скорошна инфекция остават допустими [43]. За да моделираме ваксинация след скорошна инфекция, оценихме ефективността на A/NP + M2-rAd, дадена 7 дни след респираторна инфекция. Както се определя от заболеваемостта и оцеляването след предизвикателство, защитата, предоставена от A/NP + M2-rAd, не е намалена от респираторни вирусни инфекции, възникнали 7 дни преди имунизацията. Също така наблюдавахме сравними серумни отговори на антитела и белодробни Т-клетки въпреки скорошните инфекции.
Нашите открития показват, че предишната инфекция с A/Udorn предизвиква кръстосана защита, наричана също хетеросубтипен имунитет. Хетеросубтипичният имунитет е описан много пъти в литературата за мишки и много други животински видове [38] и вероятно също се индуцира при хора [44–47]. В този случай A/Udorn (H3N2) е частично защитен срещу A/FM (H1N1) (40% от мишките са оцелели, Фиг. 1F). За разлика от това, A/NP + M2-rAd предизвиква по-мощни имунни отговори, които са достатъчни за защита на всички мишки.
Отговорите на антителата към M2e са слаби и променливи при мишки след инфекция с грипен вирус или имунизация с адаптиран към настинка грипен вирус [1, 4,48–50]. По същия начин при хората индукцията на M2e-специфичен отговор на антитела след грипна инфекция е силно променлива [51-53]. В съгласие с тези констатации, M2e-специфичен отговор на антитела не е предизвикан от инфекция A/Udorn, последвана от B/NP-rAd имунизация (Фигура 1D). Въпреки това, фокусираната имунизация, например чрез M2-rAd, предизвиква по-ефективно отговор на антитела. Предишна работа показа, че имунизационните стратегии, използващи конструирани М2 конюгати или експресионни вектори, са ефективни срещу грипното предизвикателство [35, 50, 54]. Докато предишните ни проучвания показаха, че само M2-rAd осигурява защита, A/NP + M2-rAd осигурява защита, превъзхождаща всеки от компонентите [1, 3].
За ваксини с вектори с аденовирус и генни терапии, намесата от съществуващия имунитет към вектора може наистина да представлява проблем [55, 56]. Имунитетът срещу аденовирусен серотип 5 (Ad5) е преобладаващ в човешката популация и може да бъде бариера за последващото използване на Ad5-базирани вектори, като A/NP + M2-rAd кандидат за универсална ваксина, използван в това проучване. Един от начините за преодоляване на тази бариера е използването на аденовирусен вектор, на който хората не са изложени. В предишна работа използвахме PanAd3, нечовешки аденовирусен вектор на примати в същия Ad вид C като Ad5 [57], за да конструираме универсален кандидат за ваксина, изразяващ консервирани грипни антигени NP и M1. Хората имат много малко или никакво серумно антитяло срещу PanAd3 и универсална ваксина с този гръбначен стълб, защитени мишки от грипно предизвикателство [58]. Също така, мукозното приложение на rAd (i.n. или аерозол) изглежда заобикаля блокирането чрез предварително имунитет в някои случаи [59, 60].
Настоящото проучване се фокусира върху вируси, причиняващи остри респираторни инфекции. Хроничните инфекции с вируси, бактерии и паразити също могат да окажат голямо влияние върху имунния отговор на гостоприемника при последваща ваксинация [15, 25–27]. Като се има предвид високата честота на съществуваща хронична инфекция в много части на света, тяхното въздействие върху имунизациите е от голямо значение. Разширявайки случаите, изследвани тук, бъдещите изследвания могат да изследват ефективността на ваксините в модели на хронична инфекция.
В зависимост от вируса и времето на заразяване имунните отговори към универсалната ваксина са непроменени, засилени или умерено намалени в сравнение с отговорите при мишки без предварителна вирусна инфекция. В крайна сметка тестваните от нас вирусни инфекции не отменят защитата, предизвикана от универсалната ваксина. Тези резултати обещават, че ваксината може да се представи добре при хората, въпреки широко разпространения имунитет срещу често срещани респираторни вируси.
Благодарности
Благодарим на Мери Белчър и Антъни Ферин от FDA Vivarium за експертни грижи за животните и експлоатация на съоръжението. Благодарим на Andrew Byrnes и Maryna Eichelberger за проницателни рецензии на ръкописа.
Отчет за финансиране
Това проучване беше подкрепено от вътрешнофирмено финансиране на изследователската дейност на CBER на американската FDA, включително финансиране от инициативата CBER за пандемичен грип. Финансистите не са имали никаква роля в дизайна на проучването, събирането и анализа на данни, решението за публикуване или подготовката на ръкописа, освен процедурите за преглед на клирънса за преглед.
Наличност на данни
Всички съответни данни са в ръкописа.
- Ефектът на пеперудата Въздействието на щитовидната жлеза върху вашето здраве от Марина Тарасова Забележително -
- Клиничният ефект на нова формула за кърмачета при доносени бебета със запек двойно сляп,
- Кой е ефектът Какво е това и реално ли е
- Защо трябва да опитате универсален многокомпонентен протеин GymBeam Blog
- Терапевтичен ефект на високи дози екстракт от зелен чай върху намаляване на теглото Рандомизиран, двойно-сляп,