Александър Миронов
* Катедра по клетъчна биология и онкология, Istituto di Ricerche Farmacologiche Mario Negri, Consorzio Mario Negri Sud, 66030 Санта Мария Имбаро (Chieti), Италия; и ‡ Департамент по биология, Калифорнийски университет в Сан Диего, Ла Хола, Калифорния 92093
Антонино Коланци
* Катедра по клетъчна биология и онкология, Istituto di Ricerche Farmacologiche Mario Negri, Consorzio Mario Negri Sud, 66030 Санта Мария Имбаро (Chieti), Италия; и ‡ Департамент по биология, Калифорнийски университет в Сан Диего, Ла Хола, Калифорния 92093
Мария Джузепина Силета
* Катедра по клетъчна биология и онкология, Istituto di Ricerche Farmacologiche Mario Negri, Consorzio Mario Negri Sud, 66030 Санта Мария Имбаро (Chieti), Италия; и ‡ Департамент по биология, Калифорнийски университет в Сан Диего, Ла Хола, Калифорния 92093
Giusy Fiucci
* Катедра по клетъчна биология и онкология, Istituto di Ricerche Farmacologiche Mario Negri, Consorzio Mario Negri Sud, 66030 Санта Мария Имбаро (Chieti), Италия; и ‡ Департамент по биология, Калифорнийски университет в Сан Диего, Ла Хола, Калифорния 92093
Силвио Флати
* Катедра по клетъчна биология и онкология, Istituto di Ricerche Farmacologiche Mario Negri, Consorzio Mario Negri Sud, 66030 Санта Мария Имбаро (Chieti), Италия; и ‡ Департамент по биология, Калифорнийски университет в Сан Диего, Ла Хола, Калифорния 92093
Aurora Fusella
* Катедра по клетъчна биология и онкология, Istituto di Ricerche Farmacologiche Mario Negri, Consorzio Mario Negri Sud, 66030 Санта Мария Имбаро (Chieti), Италия; и ‡ Департамент по биология, Калифорнийски университет в Сан Диего, Ла Хола, Калифорния 92093
Роман Полищук
* Катедра по клетъчна биология и онкология, Istituto di Ricerche Farmacologiche Mario Negri, Consorzio Mario Negri Sud, 66030 Санта Мария Имбаро (Chieti), Италия; и ‡ Департамент по биология, Калифорнийски университет в Сан Диего, Ла Хола, Калифорния 92093
Александър Миронов-младши.
* Катедра по клетъчна биология и онкология, Istituto di Ricerche Farmacologiche Mario Negri, Consorzio Mario Negri Sud, 66030 Санта Мария Имбаро (Chieti), Италия; и ‡ Департамент по биология, Калифорнийски университет в Сан Диего, Ла Хола, Калифорния 92093
Джузепе Ди Тулио
* Катедра по клетъчна биология и онкология, Istituto di Ricerche Farmacologiche Mario Negri, Consorzio Mario Negri Sud, 66030 Санта Мария Имбаро (Chieti), Италия; и ‡ Департамент по биология, Калифорнийски университет в Сан Диего, Ла Хола, Калифорния 92093
Роберто Вайгерт
* Катедра по клетъчна биология и онкология, Istituto di Ricerche Farmacologiche Mario Negri, Consorzio Mario Negri Sud, 66030 Санта Мария Имбаро (Chieti), Италия; и ‡ Департамент по биология, Калифорнийски университет в Сан Диего, Ла Хола, Калифорния 92093
Вивек Малхотра
* Катедра по клетъчна биология и онкология, Istituto di Ricerche Farmacologiche Mario Negri, Consorzio Mario Negri Sud, 66030 Санта Мария Имбаро (Chieti), Италия; и ‡ Департамент по биология, Калифорнийски университет в Сан Диего, Ла Хола, Калифорния 92093
Даниела Корда
* Катедра по клетъчна биология и онкология, Istituto di Ricerche Farmacologiche Mario Negri, Consorzio Mario Negri Sud, 66030 Санта Мария Имбаро (Chieti), Италия; и ‡ Департамент по биология, Калифорнийски университет в Сан Диего, Ла Хола, Калифорния 92093
Мария Антониета Де Матейс
* Катедра по клетъчна биология и онкология, Istituto di Ricerche Farmacologiche Mario Negri, Consorzio Mario Negri Sud, 66030 Санта Мария Имбаро (Chieti), Италия; и ‡ Департамент по биология, Калифорнийски университет в Сан Диего, Ла Хола, Калифорния 92093
Алберто Луини
* Катедра по клетъчна биология и онкология, Istituto di Ricerche Farmacologiche Mario Negri, Consorzio Mario Negri Sud, 66030 Санта Мария Имбаро (Chieti), Италия; и ‡ Департамент по биология, Калифорнийски университет в Сан Диего, Ла Хола, Калифорния 92093
Резюме
Материали и методи
Клетъчна култура
Базофилна левкемия на плъх (RBL) -2H3 клетки се отглеждат в DME, допълнена с 16% FCS и 1 mM 1 -глутамин. СНО клетки се култивират в DME, допълнен с 10% FCS.
Антитела и други реактиви
NAD +, NADP +, NADH, BFA и GAPDH от скелетни заешки мускули са получени от Sigma Chemical Co. (St. Louis, MO). Материалите за култивиране на тъкани са от GIBCO BRL (Grand Island, NY) и Seromed (Берлин, Германия). GTP и ATP бяха от Boehringer Mannheim (Mannheim, Германия). Заешко анти-α-манозидаза II (Man II) антитяло е предоставено от K. Moremen (Университет на Джорджия, Атина, Джорджия), а заешко анти-β-COP антитяло от J. Donaldson и J. Lippincott-Schwartz (Национални институти на здравето, Bethesda, MD). Всички други химикали са получени от търговски източници с най-висока налична чистота. BFA се съхранява при -20 ° C в основни разтвори в DMSO. Dicumarol се приготвя преди употреба като воден разтвор.
Клетъчна пермеабилизация
RBL (отглеждани в стъкла на стъклена камера) се поставят върху лед и веднага се измиват с пермеабилизиращия буфер (PB: 25 mM Hepes-Koh, pH 6,95, 125 mM KOAc, 2,5 mM Mg [OAc] 2, 10 mM глюкоза, 1 mM DTT, 1 mM EGTA и 0,5 μM таксол). След това клетките се инкубират с 3 U/ml стрептолицин О (SLO) (Biomerieux, Marcy l'Etoile, Франция), предварително активирани за 5 минути при стайна температура в PB за 8 минути върху лед. Несвързаният SLO се отстранява и клетъчният монослой се измива със студен PB и след това се обработва с пермеабилизиращ буфер, допълнен с 1 mg/ml мозъчен цитозол на плъх, 1 mM ATP, 250 μM UTP, 2 mM креатин фосфат, 7.3 U/ml креатин фосфокиназа при 37 ° C за между 20-30 минути (в присъствието на посочените процедури). За да се провери степента на пермеабилизация, клетките се оцветяват с трипаново синьо (и пропидиев йодид) и се измерва изтичането на цитозолния ензим лактатна дехидрогеназа. С приетия график на лечение с SLO, 95% от клетките бяха оцветени с трипаново синьо или пропидиев йодид и> 80% от активността на млечната дехидрогеназа беше възстановена в супернатанта на пермеабилизирания клетъчен монослой. Цитозол на мозъка на плъх е приготвен съгласно Malhotra et al. (1989).
BFA-зависим ADP-рибозилиране
ADP-рибозилиране в пермеабилизирани клетки.
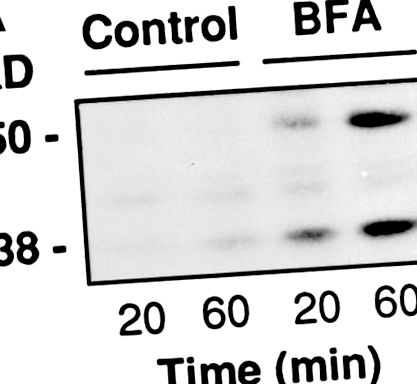
RBL клетките се посяват в 24-ямкови плаки и се използват след 24 часа при 90% сливане (300 000 клетки/гнездо на 250 μl). Те бяха проникнати, както е описано по-горе, и след това изложени за 20 или 60 минути на PB, съдържащ 500 μM тимидин, 30 μM 32 P-NAD + (3 μCi/проба) и, където е посочено, BFA. В края на инкубациите супернатантата и клетъчните протеини се утаяват с 10% TCA, разтварят се в буфер за проби и се разделят на SDS-PAGE. Радиоактивността, свързана с BARS-50 и GAPDH, беше оценена чрез флуорография.
ADP-рибозилиране на цитозол.
Цитозолът и мембраните са получени от мозъка на плъх, както е описано (De Matteis et al., 1994). Цитозолът (10 mg/ml) и измитите със сол мембрани (2 mg/ml) се инкубират в присъствието или отсъствието на 200 μM NAD + или 100 μM BFA или и двете в продължение на 60 минути при 37 ° С. При тези експериментални условия ADP-рибозилирането на BARS-50 (оценено в паралелни експерименти, проведени в присъствието на 32 P-NAD +) беше максимално (> 90%), докато това на GAPDH беше само частично (3-4%). Никакви други протеини не са откриваеми ADP-рибозилирани от BFA (вж. Фиг. Фиг. 3). 3). В края на инкубацията пробите се центрофугират при 100 000 g в продължение на 60 минути и след това супернатантите (цитозол) се диализират в продължение на 16 часа при 4 ° С и се използват в експерименти с имунофлуоресценция в пермеабилизирани клетки, както е описано по-долу.
BFA индуцира ADP-рибозилирането на BARS-50 и GAPDH в пермеабилизирани клетки. (А) RBL клетките се проникват с 3 U/ml SLO и се излагат на 10 μg/ml BFA в присъствието на 32 P-NAD + за 20 или 60 минути при 37 ° С. В края на инкубацията протеините се разделят на SDS-PAGE и радиоактивността, свързана с BARS-50 и GAPDH в присъствието на BFA, се оценява чрез флуорография. Подобни резултати бяха получени в четири експеримента. (B) Цитозолът е ADP-рибозилиран точно както е описано в Материали и методи. Протеините се разделят на SDS-PAGE и радиоактивните ленти се разкриват чрез флуорография. Само BARS-50 и GAPDH са откриваеми ADP-рибозилирани от BFA. GAPDH също е слабо модифициран в отсъствието на токсина, поради неензимно ADP-рибозилиране, различно от това, индуцирано от BFA (De Matteis et al., 1994).
Имунофлуоресценция и оцветяване с лектин
Електронна микроскопия
Клетките се фиксират с 2% глутаралдехид в PBS (рН 7,4), след това се фиксират с редуциран осмий (1% OsO4 и 1,5% калиев фероцианид в 0,1 М какодилатен буфер, рН 7,4) и се влагат в Epon 812, както е описано по-горе (Buccione et ал., 1996).
Приготвяне на обогатени с BARS-50 цитозолни фракции
Цитозол на мозъка на плъх (Malhotra et al., 1989) се утаява с 35% наситен (NH4) 2SO4. Утайката се разтваря в 25 mM Hepes, рН 8,0, съдържащ 5% глицерол, 0,5 M (NH4) 2SO4 и 1 mM DTT (буфер А) и се нанася върху фенил сефароза HP колона (Pharmacia Biotech, Piscataway, NJ), уравновесена с буфер А. Протеините се елуират с линеен градиент на буфер А минус (NH4) 2SO4. Фракциите, съдържащи BARS-50, бяха идентифицирани чрез BFA-зависим анализ на ADP-рибозилиране (De Matteis et al., 1994). Тези фракции (съдържащи 45 пъти обогатен BARS-50 и без GAPDH) се концентрират и диализират срещу буфер В (25 mM Hepes, рН 7,2, 50 mM K и 1 mM Mg ацетат) за една нощ. Крайната концентрация на протеин е 2-3 mg/ml.
Резултати
NAD + се изисква за BFA-индуцирана тръбна ретикуларна трансформация на комплекса Golgi и преразпределението на ензимите на Golgi в ER
NAD + се изисква за BFA-индуцирано преразпределение на маркери на Golgi в пермеабилизирани клетки. Интактните RBL клетки (a и b) се третират с 3 μg/ml BFA в продължение на 15 минути (b) или се проникват с 3 U/ml SLO (c – f) и се инкубират в продължение на 20 минути при 37 ° C, както е описано в Материали и методи в отсъствие (c) или в присъствието на 150 μM NAD + (e), или на 10 μg/ml BFA самостоятелно (d), или на BFA плюс 150 μM NAD + (f). След това клетките се оцветяват с анти-Man II антитяло. Подобни резултати бяха получени с помощта на helix pomatia lectin, маркер на cis Golgi отделението (не е показано). Експериментите бяха повторени четири пъти в два екземпляра със сходни резултати. Лента, 5 μm
Ултраструктура на комплекса Golgi в пермеабилизирани клетки: NAD + е необходим за ефекта на BFA. Интактните RBL клетки (a и b) се третират с 3 μg/ml BFA в продължение на 15 минути (b) или се проникват с 3 U/ml SLO (c – f) и се инкубират в продължение на 20 минути при 37 ° C в отсъствие (c) или в присъствието само на BFA (d), или на 150 μM NAD + (e), или на BFA в комбинация със 150 μM NAD + (f). След това клетките бяха обработени за електронна микроскопия. Експериментите се повтарят поне три пъти в два екземпляра със сходни резултати. Лента, 0,5 μm.
След това беше изследван ефектът от добавянето на NAD + към пермеабилизиращата среда. В присъствието на нуклеотида (15–450 μM) и диализирания цитозол (1 mg/ml), BFA поразително възвърна способността си да индуцира преразпределението на комплекса на Голджи (Фиг. (Фиг. 1 1 f), макар и с по-ниска ефикасност, отколкото в непокътнатите клетки (EC50: μ5 μg/ml). И NAD +, и цитозолът са необходими за BFA, за да изрази своята активност. NAD + няма видим ефект при липса на BFA (Фиг. 1 Фиг. 1 д). Много високи концентрации на BFA (> 50 μg/ml) или дълги инкубации с токсина успяха да предизвикат бавно разглобяване на Golgi дори при липса на NAD + в инкубационната среда (не е показано). Вероятно при високи концентрации на BFA, клетъчният NAD +, вероятно останал след пермеабилизация, може да е достатъчен за поддържане на разглобяването на Golgi. За да се изследва дали този ефект на NAD + може да се дължи на участието на нуклеотида в редокс реакции, NADH (който е неактивен като субстрат на ADP- рибозилиране) се добавя заедно с NAD + при концентрации до два пъти повече от окисления nucl еотид. NADH няма ефект върху морфологията на Golgi както в присъствието, така и в отсъствието на BFA (не е показано).
BFA-зависим ADP-рибозилиране в пермеабилизирани клетки
Тъй като ADP-рибозилирането преди това е било изследвано само в клетъчни хомогенати, беше важно да се провери дали реакцията протича и в пермеабилизирани клетки. Клетките бяха порирани от SLO при същите условия, използвани за морфологични експерименти, изложени на радиоактивни NAD + и BFA при концентрации, удвоени от EC50 в пермеабилизирани клетки, и бе оценено маркирането на GAPDH и BARS-50. Фиг. Фиг. 3 3 А показва, че ADP-рибозилирането (при ~ 10% от максималното ниво) е ясно откриваемо след 20 минути. Липсата на по-силен сигнал може да се дължи на бавен обмен на BARS-50 (естествен Mol Wt: ∼200 kD; Di Girolamo et al., 1995) през индуцираните от SLO пори. Това би довело до дълготрайност на BARS-50 в клетката (в непосредствена близост до ADP-рибозилиращия ензим) и следователно до високи вътреклетъчни концентрации на ADP-рибозилиран протеин, докато извънклетъчният цитозол може да бъде ADP-рибозилиран до много по-ниска степен.
Участие на ADP-рибозилиращите субстрати в ефектите на BFA върху морфологията на Golgi
Предварително ADP-рибозилираният цитозол замества NAD + за поддържане на разглобяващата активност на Golgi на BFA. Ефекти от екстракти, съдържащи BARS-50. RBL клетките се проникват с 3 U/ml SLO и се инкубират с контрол (a – c) или ADP-рибозилиран (d – i) цитозол (1 mg/ml) за 20 минути при 37 ° C в отсъствие (a и d) или в присъствието (b, c и e – i) на 10 μg/ml BFA. Нативният BARS-50 (екстракт, приготвен, както е описано в Материали и методи и разреден 10 пъти в ADP-рибозилиран цитозол) се добавя в i (с NAD +) и в g без NAD +. ADP-рибозилиран BARS-50 (екстракт, идентичен с този, съдържащ естествен BARS-50, но приготвен от ADP-рибозилиран цитозол; вж. Материали и методи) беше добавен към h. Клетките бяха фиксирани и белязани с анти-Man II антитяло. Подобни резултати бяха получени в четири различни експеримента. Лента, 5 μm.
Роля на Коатомер
NAD + не се изисква за BFA-индуцирана косомерна дисоциация от комплекса на Golgi в пермеабилизирани клетки. Интактните RBL клетки (а и b) бяха третирани с 3 μg/ml BFA (b) или бяха проникнати с 3 U/ml SLO и след това изложени на контролен буфер (c), или на буфер, съдържащ 150 μM NAD + (e ), или 10 μg/ml BFA самостоятелно (d), или BFA в комбинация със 150 μM NAD + (f). Клетките бяха фиксирани, проникнати със сапонин и оцветени с анти-β-COP антитяло. SLO пермеабилизацията предизвиква частично откъсване на β-COP от комплекс Golgi (c) в сравнение с непокътнати клетки (a), но BFA е напълно ефективен при индуциране на общото цитозолно преразпределение на β-COP независимо от присъствието на NAD + в буфера за проникване (г и е). Предварително ADP-рибозилираният цитозол (g и h) се държи неразличимо от контролния цитозол. Подобни резултати бяха получени в пермеабилизирани СНО клетки (не са показани). Експериментите бяха повторени четири пъти в два екземпляра със сходни резултати. Лента, 5 μm.
Инхибитори на BFA-зависима ADP-рибозилация Предотвратяват BFA-индуцираното разглобяване на Golgi. Роля на ADP-Рибозилиращите субстрати
Дикумарол предотвратява тръбно-ретикуларната трансформация на апарата на Голджи, индуцирана от BFA. RBL клетките се третират с посочените концентрации на BFA в продължение на 15 минути след 30-минутна предварителна обработка с 200 μM дикумарол. След това бяха обработени за електронна микроскопия. Дикумарол (и илимахинон, не е показан) предотвратява тубуларно-ретикуларната трансформация и изчезването на стековете на Голджи, предизвикани от умерено (а), но не и от високи концентрации на BFA (b). Подобни резултати бяха получени в три независими експеримента, проведени в два екземпляра. Лента, 0,5 μm.
Предварително ADP-рибозилираният цитозол предотвратява и естественият BARS-50 спасява анти-BFA ефектите на дикумарол върху комплекса на Голджи в пермеабилизирани клетки. RBL клетките се проникват с 3 U/ml SLO и се инкубират в продължение на 20 минути при 37 ° C в среда, съдържаща BFA (10 μg/ml) и NAD + (150 μM) без (a, c, e и g) или с 200 μM дикумарол (b, d, f и h) в присъствието на контрола (a и b) или предварително ADP-рибозилиран (c – h) цитозол (1 mg/ml). Естествен обогатен с BARS-50 екстракт (вижте фиг. Фиг. 4 4 легенда) беше добавен към (e) и (f), докато ADP-рибозилиран BARS-50 беше добавен към (g) и (h). Клетките бяха фиксирани и белязани с анти-Man II антитяло. Подобни резултати бяха получени в три независими експеримента. Лента, 5 μm.
Дискусия
NAD + се изисква за разглобяване на Golgi от BFA
ADP-рибозилираният цитозол замества NAD + в подкрепа на BFA-индуцирано разглобяване на Golgi
Инхибиторите на ADP-рибозилирането предотвратяват ефектите на BFA върху структурата на Golgi и действат чрез цитозолните ADP-рибозилиращи субстрати
ADP-рибозилирането на субстратните протеини се случва в пермеабилизирани клетки
Като цяло, горните констатации относно ролята на NAD + и ADP-рибозилиран цитозол силно подкрепят ролята на NAD + и ADP-рибозилиране в BFA-чувствителните машини, контролиращи архитектурата на Golgi. ADP-рибозилирането обаче не е достатъчно, за да обясни морфологичните ефекти на токсина, тъй като ADP-рибозилираният цитозол не е в състояние да индуцира само BFA фенотип. Допълнителни механизми, най-вероятно включващи BFA-индуцирана дисоциация на коатомера от мембраните на Golgi, трябва да бъдат необходими за разрушаването на Golgi.
Роля на коатомера и на NAD + -зависими механизми при разглобяването на Golgi
Апаратът на Голджи, въпреки своята сложност, е много динамична органела, както се наблюдава най-драматично от бързите и обратими ефекти на BFA. Това проучване предполага, че NAD + и ADP-рибозилирането са нови фактори в машината, контролираща структурата на комплекса на Голджи и по-специално на неговата тръбно-ретикуларна трансформация в отговор на BFA. Той също така отваря нови въпроси относно значението на NAD + -зависимата регулация във физиологията на тази органела и точната (ите) роля (и) на ADP-рибозилиращите протеинови субстрати.
- Лечението на затлъстяването роля за трудовите терапевти Скандинавски вестник по трудова терапия
- Успешно поддържане на загуба на тегло Систематичен преглед на регистрите за контрол на теглото - Paixão - 2020
- Намаляване на детското затлъстяване Ролята на плуването
- Renee Dhyani за загуба на роля, защото е отслабнала Ще има още предавания и
- Силиций Преглед на неговата потенциална роля в превенцията и лечението на постменопаузата