Даниела Фраска
1 Катедра по микробиология и имунология, Медицински факултет на Университета в Маями Милър, Маями, Флорида, САЩ
Бони Б. Бломберг
1 Катедра по микробиология и имунология, Медицински факултет на Университета в Маями Милър, Маями, Флорида, САЩ
Роберто Паганел
2 Dipartimento di Medicina e Scienze dell’Invecchiamento, Università degli Studi ‘G. d’Annunzio ’Chieti-Pescara, Chieti, Италия
Резюме
Въведение
Увеличението на разпространението на наднорменото тегло и затлъстяването представлява световен феномен, който е свързан с няколко хронични заболявания като диабет тип 2 (T2D), рак, ревматоиден артрит и остеоартрит (ОА), когнитивни нарушения и деменция, както и тези, засягащи сърдечно-съдовата система (CV) система.
Глобалната пандемия на затлъстяването засяга всички възрастови групи. Последните проучвания, изследващи данните за индекса на телесна маса (ИТМ) при 68 милиона души в 195 страни, показват както увеличено разпространение, така и тежест на заболяванията при субекти с висок ИТМ в световен мащаб през последните 20 години (1). Въпреки че разпространението на затлъстяването сред децата е по-ниско, отколкото при възрастните, темпът на нарастване надвишава този на възрастните (2). Глобалната тежест на заболяванията, свързани с висок ИТМ, се изчислява при индивиди без основни състояния и се увеличава с по-бавни темпове при възрастни главно поради намаляването на други рискови фактори за сърдечно-съдови заболявания и за ефективна клинична намеса. Доказано е обаче, че повишеният ИТМ е патогенетично свързан с няколко заболявания. Сред тях инсулиновата резистентност (IR) и T2D имат силна връзка със затлъстяването, а метаболитният синдром представлява група от рискови фактори за тежки сърдечно-съдови събития (коронарна артериална болест, инсулт). Затлъстяването, наложено върху стареенето, представлява допълнителен рисков фактор за по-възрастните възрастови групи, при които разпространението на хроничните заболявания, както и появата на усложнения се увеличават (3-5). Тежестта на заболяването при висок ИТМ при деца (на възраст ≤18 години) не е разгледана със същите подробности.
Процесът на стареене се характеризира със състояние на хронично възпаление, известно като възпаление. Няколко фактора допринасят за възпалението, включително полиморфизми в промоторните области на провъзпалителни гени, хронично стимулиране на имунните клетки с вируси като цитомегаловирус, промени в чревния микробиом и повишена пропускливост от червата [прегледано в Реф. (6)]. Наскоро беше предложено, че непрекъснатото ангажиране на вродените рецептори чрез ендогенни сигнали като свързани с увреждане молекулни модели води до хронично състояние на фоново възпаление, което трябва да се компенсира от противовъзпалителни механизми. Клетъчното стареене и придобиването на свързания със стареенето секреторен фенотип (SASP) от фибробласти (7) и ендотелни (8) и имунни клетки (9-11) също са определени като важен принос за възпалението. Клетъчното стареене индуцира натрупването на окончателно диференцирани B, T и NK клетки с дисрегулирана функция чрез активиране на пътища, интегриращи стареене и енергийно-чувствителни сигнали.
Възпалението е важна връзка между затлъстяването, IR, стареенето и свързаните с възрастта заболявания като когнитивно увреждане, атеросклероза, рак и автоимунитет. Повишените провъзпалителни цитокини са свързани с намалена инсулинова чувствителност. Хроничното нискостепенно (стерилно) възпаление причинява IR, което води до преход от метаболитно нормално затлъстяване към метаболитен синдром. Това се случва както чрез системно възпаление, така и чрез метавъзпаление (12), процес, при който излишните хранителни вещества насърчават хронично нискостепенно възпаление и чиито метаболитни отличителни белези са високите нива на липиди, свободни мастни киселини (FFA), глюкоза и реактивни кислородни видове (ROS).
Имунните клетки на вродената и адаптивна имунна система инфилтрират тъкани, отговарящи на инсулина, като висцералната мастна тъкан (ДДС) и със затлъстяване предизвикват възпалителни реакции. Имунните клетки (макрофаги, Т, В, NK, NKT клетки и неутрофили) са замесени в възпалението на мастната тъкан (AT) и IR (13-17). Възпалението води до локално и системно увеличаване на провъзпалителните молекули, като фактор на туморна некроза (TNF) -α, интерлевкин (IL) -1β, IL-6, интерферон (IFN) -γ, възпалителни адипокини, хемокини и FFA [ разгледано в Реф. (16)].
Връзки на затлъстяването с инсулинова резистентност (IR) и T2D
IR е липсата на подходящ отговор на циркулиращия инсулин в няколко тъкани, включително черен дроб, мускули и AT (18). Често се асоциира със затлъстяване, хипертония (интегриращи характеристики на метаболитния синдром) и CV болест и обикновено предшества появата на T2D. В панкреаса β-клетките се адаптират към хипергликемия с разширяване на общата β-клетъчна маса и с повишена секреция на инсулин (хиперинсулинемия), който е в състояние не само да контролира нормалните нива на гликемия, но също така може да индуцира β-клетъчен стрес, причиняващи β-клетъчна недостатъчност и след това T2D (19). Лошият гликемичен контрол при индивиди с T2D води до тежки усложнения, като бъбречна недостатъчност, слепота, невропатия и сърдечни нарушения (20).
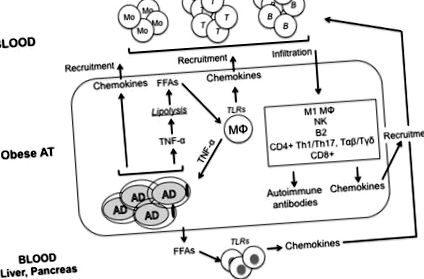
Не е напълно ясно как затлъстяването причинява развитието на IR. Въпреки че са предложени много молекулярни механизми, включително ER стрес, оксидативен стрес, дисрегулация на липидната хомеостаза, митохондриална дисфункция, хипоксия и увреждане на инсулиновия сигнален път в клетките, реагиращи на инсулин, има доказателства, че предизвиканото от затлъстяването възпаление може да бъде ключ коефициент за IR (21). Фигура Фигура1 1 обобщава основните пътища, водещи до възпаление в AT със затлъстяване.
Производство на противовъзпалителни медиатори в AT със затлъстяване
Високите нива на TNF-α в AT са свързани с хронично повишена базална липолиза, процесът на хидролиза на триглицериди за освобождаване на FFA и липиди (22). Те осигуряват хронична стимулация на макрофагите, водеща до индуцирана от FFA продукция на TNF-α, причинявайки IR. Предполага се, че произведеният от адипоцити TNF-α допринася за повишени нива на FFAs в кръвта на затлъстели индивиди (22), а неутрализацията на TNF-α in vivo при затлъстели мишки намалява циркулиращите нива на FFA (23). Доказано е също така, че TNF-α намалява експресията на протеини, стабилизиращи липидна капка (перилипини) (24), което води до ектопично отлагане на липиди в чувствителни към инсулин тъкани. Липидите и получените от липиди молекули имат директен ефект върху чувствителните към инсулин тъкани и индуцират IR (25).
Други основни провъзпалителни цитокини, освободени от AT със затлъстяване, са IFN-γ, секретиран от CD8 + Т клетки (26) и NK клетки (27) и IL-17, секретиран от CD4 + Т клетки (28).
Хипоксия и освобождаване на "Self" антигени в AT със затлъстяване
По време на развитието на затлъстяването доставката на кислород към разширяващата се АТ става недостатъчна, което води до зони на хипоксия (29, 30). Този феномен на лошо оксигениран AT не само активира транскрипционния фактор, индуциран от хипоксия фактор-1α (HIF-1α) и по-нататъшното освобождаване на провъзпалителни цитокини (31), но също така предизвиква клетъчна смърт и освобождаване на „самостоятелни“ антигени, които стимулират клас превключване и производството на IgG патогенни антитела. Досега хипоксията в AT е единственият механизъм, предложен за освобождаване на „самостоятелни“ антигени в AT със затлъстяване.
Инфилтрация на имунни клетки в AT със затлъстяване
Данни от затлъстели мишки и хора показват, че хипертрофираният AT става силно инфилтриран от различни имунни клетки, проявяващи провъзпалителен фенотип, характеризиращ се със секреция на SASP маркери (32), а броят им обратно корелира с инсулиновата чувствителност. Клетки с противовъзпалителен фенотип също са докладвани в AT със затлъстяване, но тези клетки присъстват на ниски честоти. Това са В1 В клетки, продуциращи IL-10 (15, 33) и вродени лимфоидни клетки тип 2, които произвеждат големи количества Th2 цитокини като IL-4, IL-5 и IL-13 (34). Треги също са докладвани, но само в постно AT (35).
Инфилтрацията на макрофаги в AT се счита за основен двигател на възпалението поради секрецията на провъзпалителни цитокини и хемокини, участващи в набирането на имунни клетки към AT. Адипоцитите обаче секретират и провъзпалителни медиатори (цитокини, хемокини и адипокини) и в по-големи количества в сравнение с имунните клетки (36). Следователно, при затлъстяване, кръстосана връзка между адипоцитите и имунните клетки, инфилтриращи АТ, допринася за установяването на хронично възпаление, което е предпоставка за IR. Макрофагите в AT са почти изключително M1, те зависят от гликолизата за тяхната възпалителна функция и тяхното стимулиране в AT индуцира експресия на глюкозен транспортер и прием и използване на глюкоза (37). Хипоксията (чрез HIF-1α) потенцира гликолизата и стабилизира възпалителния фенотип (38). В M1 макрофагите, инфламазомният NLRP3 активира каспаза 1 и секрецията на IL-1β (39), който е директно токсичен за β-клетките на панкреаса и индуцира IR (40). Съобщава се за повишена възпалителна активност при получени от моноцити макрофаги от пациенти с T2D (41).
Т клетките в AT са Th1 CD4 + и IFN-γ-продуциращи CD8 + Т клетки (26). Те насърчават секрецията на провъзпалителни цитокини от M1 макрофаги, водещи както до локална, така и до системна IR (42). Подобно на макрофагите, изкривяването на Т-клетъчната подгрупа в АТ се осъществява чрез модулация на метаболизма на субстрата, регулиран от хормони (лептин) и вътреклетъчни хранителни чувствителни кинази, като AMPK/mTOR (43). Th1 CD4 + Т клетки експресират високи нива на мембранни глюкозни транспортери и са силно гликолитични (44), черта, поддържаща възпалителните реакции.
Интерферон-γ, подписаният Th1 цитокин, индуцира макрофагите и Т клетките да секретират хемокини, които набират имунни клетки към затлъстелите AT (45, 46). Освен това, IFN-γ улеснява поляризацията от M2 до M1 (47) и намалява сигнализирането на инсулиновия рецептор чрез намаляване на експресията на инсулиновите рецептори и глюкозните транспортери (48). Производството на IFN-γ се регулира от T-bet, фактор за транскрипция на семейството на T-box, идентифициран за първи път като транскрипционен индуктор на IFN-γ в CD4 + Т клетки (49). T-bet играе критична роля за развитието на IR при животински модели на затлъстяване, а мишките с дефицит на T-bet, хранени с диета с високо съдържание на мазнини, са огнеупорни към индукцията на IR (50). Тези мишки показват подобрена инсулинова чувствителност и глюкозен толеранс, намален брой имунни клетки в AT (CD4 +/CD8 + Т клетки, NK клетки и макрофаги) и намалено производство на противовъзпалителни цитокини на грам мазнина (IFN-γ, TNF-α, IL-1β и IL-6).
Пациентите със затлъстяване и T2D имат промени в състава на своя микробиом, с намалени пропорции на Bacteroidetes (полезни бактерии) при затлъстели в сравнение с слаби индивиди (51). Освен това се съобщава, че чревната микрофлора регулира развитието на затлъстяване при животински модели (52). T-bet регулира активирането на Т-клетки на лигавицата (53), а дефицитът на T-bet променя състава на микрофлората (54). Дефицитът на T-bet може също да промени микробиома при лица със затлъстяване, което води до възпалителни и метаболитни процеси, които регулират T2D.
В клетките се натрупват и в AT със затлъстяване (15, 55, 56). Набирането на В клетки може да инициира индуцирана от Т клетки поляризация на М1 и IR. Затлъстяването и хипергликемията оказват пряко влияние върху производството на антитела, а секрецията на IgG от възпалено ДДС модулира функцията на резидентните макрофаги. Съобщава се, че В клетките в АТ се индуцират да произвеждат патогенни IgG автоантитела, поради нерегулираната експресия на автоантигени от хипоксични адипоцити. В клетките също подпомагат активирането на възпалителни Т клетки, които са основните патогенни двигатели при системно възпаление и IR.
Наскоро в мезентериалната AT на мишки и хора е идентифицирана нова лимфоидна тъкан, наречена лимфоидни клъстери, свързани с мазнини (FALC). FALC се индуцират бързо след възпалителни стимули и подпомагат пролиферацията и диференциацията на В-клетките, регулиращи производството на антитела в AT (57).
Затлъстяването и ревматоидният артрит (RA): Доказателства и механистични връзки
„Парадоксът на затлъстяването“ в RA
Затлъстяването представлява важна връзка със съпътстващите заболявания като метаболитен синдром (71) и сърдечно-съдови заболявания (72); обаче в някои проучвания повишеният ИТМ е имал обратния ефект на намалената смъртност (70, 73), който е описан като „парадокс на затлъстяването“ (74). Нещо повече, при пациенти с RA с наднормено тегло прогресията на костната деструкция е намалена (75, 76), броят на подутите стави не се увеличава и се съобщава за по-добро качество на живот (77). Загубата на тегло и кахексията са основни фактори за по-голям риск от смърт (78) и по-лошо качество на живот (77), като по този начин засилват парадоксалното наблюдение на по-ниската смъртност при пациенти със затлъстяване. Последващи проучвания обаче показват, че при пациенти с РА с анамнеза за затлъстяване намаленият ИТМ е силно свързан със смъртта. Следователно „парадоксът на затлъстяването“ не води до биологично защитна роля на затлъстяването (73), повдигайки въпроса дали използването на ИТМ е валиден инструмент за оценка на затлъстяването при RA (65).
Роля на В клетките в RA патогенезата
Ключовата роля, която играят автореактивните В-клетки, се подчертава от наличието на диагностични автоантитела, а ревматоидният фактор (RF) (99) и антициклично-цитрулинираните пептидни антитела (ACPA) (100) са добре установени показатели за тежестта на заболяването и може да предшестват началото на заболяването. Ролята на В клетките в патогенезата на RA в контекста на наднорменото тегло/затлъстяването все още не е разгледана и заслужава задълбочено внимание. Открит е първичен дефект в ранната толерантност на В-клетките, тъй като повечето наивни В-лимфоцити експресират полиреактивни автоантитела, включително RF и ACPA. Тези В клетки са устойчиви на Fas-индуцирана апоптоза и следователно не се потискат от Treg (101). В-клетките обаче участват в RA чрез други механизми, в двупосочна подкрепа на помощни Т-лимфоцити, като само-антиген-представящи клетки, с освобождаване на възпалителни медиатори и с насърчаване на лимфоидната неогенеза (което е видно при RA синовит ). RF + B клетките са способни да поемат IgG-съдържащи имунни комплекси и да представят антиген на Т клетките, като по този начин активират взаимно подсилен отговор (102).
Остеоартрит (ОА), стареене и затлъстяване
При възрастните хора артритът често се свързва с други заболявания с многократно стареене или дегенеративни характеристики (109). OA и RA споделят общи черти при пациенти в напреднала възраст и значително допринасят за увреждане (110). ОА обикновено се диференцира от RA по възраст при диагностициране, продължителност на сутрешната скованост, модел на засягане на ставите и рентгенографски находки. Разграничаването между болестите може да бъде предизвикателство, но във възрастовата група> 60 години ОА е далеч по-често. Въпреки факта, че ОА директно корелира с възрастта, истинската причина за тази асоциация не е ясна и развитието на ОА може да бъде разделено на зависими от стареенето и независими от стареенето процеси (111–114). Както увеличеното производство на матрични металопротеинази и цитокини, намалените нива на синтез на колаген тип II, така и увеличеното производство на ROS предизвикват възрастови промени в хондроцитите (114). Тези промени променят хрущялната функция, а саркопенията допълнително води до намалена ставна стабилност (115). Клетъчното стареене, нарушената регенерация и възстановяването са признати фактори, допринасящи за увреждане на хрущяла при стареене (115, 116).
Когнитивно увреждане, деменция и връзка с свързани с възрастта заболявания и затлъстяване
Заключителни бележки
Имунитетът и метаболизмът са силно интегрирани фактори при стареенето и свързаните с възрастта заболявания. Това е разширяващо се поле на разследване. Затлъстяването и свързаните с него усложнения са голяма глобална епидемия. Научните изследвания трябва да бъдат решаваща част от решението, за да се разберат всички последици от затлъстяването, но това изследване все още е в началната си фаза. Изследването на механизмите, при които възпалението и имунната активация нарушават функционален имунен отговор, добавя нови прозрения към разбирането на връзката между възпалението и дългосрочните резултати от метаболитно заболяване и отваря нови начини за ефективни терапевтични интервенции.
Принос на автора
Всички автори са участвали в написването на статията и са получили окончателно одобрение на изпратената версия.
Изявление за конфликт на интереси
Изследването е проведено при липса на каквито и да било търговски или финансови отношения, които биха могли да се тълкуват като потенциален конфликт на интереси.
- Институтът за стареене Арнолд запалва усилията за подобряване на здравословното стареене с акцент върху превенцията на затлъстяването
- Стареене, диабет, затлъстяване и когнитивен спад Проучване, основано на населението - Ganguli - 2020 - Journal
- Резюме 51 Дефицитът на възпалителен фактор 1 на алографта предотвратява затлъстяването и инсулиновата резистентност от
- Диетите за ограничаване на калориите могат да подобрят рисковете за свързаните с възрастта заболявания
- Бариатричната хирургия е безопасна и ефективна възможност за пациенти с възпалителни чревни заболявания A