1 Институт Лигинс и Националният изследователски център за растеж и развитие, Университет в Окланд, Окланд 1142, Нова Зеландия
Резюме
1. Предистория
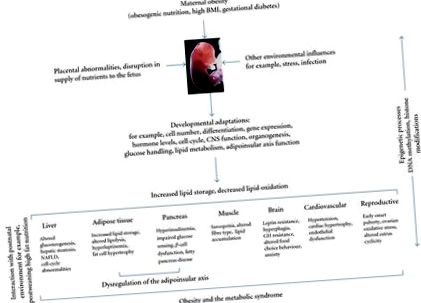
Настоящата епидемия от затлъстяване и свързаните с него метаболитни нарушения се разглежда като симптом на изобилие от основната причина, свързана с развитието на обезогенна среда и лесен достъп до висококалорични храни и намален разход на енергия в работата и развлекателните дейности [1]. Метаболитният синдром се характеризира с натрупване на сърдечно-съдови рискови фактори, включително диабет, затлъстяване, хиперлипидемия и хипертония и вероятно е резултат от сложни взаимодействия между гени, хранителен прием, физическа активност и околната среда. В рамките на групата рискови черти за метаболитния синдром инсулиновата резистентност и висцералното затлъстяване са признати за най-важните причинни фактори [2]. Идентифицирани са редица гени, които са свързани със затлъстяването и метаболитния синдром при хората [1, 3], но генетичният компонент на това състояние не може да обясни значително увеличение на разпространението на затлъстяването и метаболитния синдром през последните години. В този контекст хипотезата за развитието на здравето и болестите (DOHaD) подчертава връзката между периконцептуалната, феталната и ранната фаза на живота и последващото развитие на затлъстяването при възрастни и метаболитния синдром [4–6].
Механизмите, които са в основата на рамката за програмиране на развитието и ролята на генетичните фактори спрямо факторите на околната среда, остават спекулативни. Една обща теза е, че в отговор на неблагоприятна вътрематочна среда плодът адаптира своето физиологично развитие, за да увеличи своите непосредствени шансове за оцеляване. Тези адаптации могат да включват нулиране на зададените точки за метаболитна хомеостаза, ендокринни системи и понижаване на регулирането на растежа, обикновено проявяващо се в променен фенотип на раждането. Съвсем наскоро хипотезата за „предсказуем адаптивен отговор“ (PARs) предполага, че степента на несъответствие между пре- и постнаталната среда е основен определящ фактор за последващ риск от заболяване [7, 8]. По този начин се смята, че докато адаптивните промени във физиологията на плода могат да бъдат от полза за краткосрочното оцеляване вътреутробно, те могат да бъдат неадаптивни в по-късен живот, допринасяйки за неблагоприятни здравни резултати, когато потомството е изложено на наваксващ растеж, индуцирано затлъстяване и други фактори [8, 9].
2. Животински модели на майчиното затлъстяване
2.1. Модели за гризачи
Гризачът е най-често използваният моделен вид за изследване на програмирането на развитието чрез майчина обезогенна хранителна среда. Доказано е, че кафенето на майката или диетата с високо съдържание на мазнини (HF) предизвиква затлъстяване, резистентност към инсулин и лептин [15–17], хипертония [18–21], заболяване на мастната панкреас [22], чернодробна стеатоза и безалкохолна мастна чернодробна болест при потомство [23–26] (Фигура 1). Съобщено е също, че майчиното затлъстяване, а не хранителните мазнини сами по себе си, индуцира хиперлептинемия и инсулинова резистентност при потомството, както и повишено телесно тегло, което продължава и до зряла възраст [27]. Доказано е дори, че прекомерното хранене на майката предизвиква повишено затлъстяване, непоносимост към глюкоза и променени регулатори на мозъчния апетит при потомството [28]. Нашата собствена предишна работа показа, че умерената високочестотна диета при майките води до значително затлъстяване и хиперинсулинемия при мъжкото и женското потомство, независимо от нивото на предзачатъчното затлъстяване [29] (Фигура 2).
2.2. Модели на овце
Моделите на овцете са по-малко проучени от гризачите, но има силни доказателства от модели на овце, че майчиното затлъстяване предразполага към променен растеж и метаболитни последици при потомството, данни, които са точно подобни на наблюдаваните при малките животински модели. В проучване на Zhang et al. Е използван модел на овче майчино затлъстяване, при който овцете са били прехранвани, за да предизвикат затлъстяване при зачеването и по време на бременността. В средата на бременността плодовете от овце със затлъстяване бяха макрозомични, хипергликемични и хиперинсулинемични и демонстрираха значително повишено тегло на панкреаса и β-брой клетки в сравнение с фетусите на овце-майки, хранени според изискванията. Тези данни също демонстрират диференциално въздействие на затлъстяването при майките върху растежа на панкреаса на плода и β-брой клетки по време на ранна и късна бременност. През първата половина на бременността се забелязва значително увеличаване на растежа на панкреаса, β-клетъчна пролиферация и секреция на инсулин, последвано от намаляване на растежа на панкреаса и β-брой клетки в края на бременността, което води до намаляване на циркулиращия инсулин в срока [38].
Известно е, че затлъстяването на майките и увеличеният прием на хранителни вещества преди и по време на бременността в овцете водят до променен растеж, затлъстяване и глюкозен толеранс при възрастни потомци [39]. Както при проучванията с гризачи, различните нива на прекомерно хранене и наддаване на тегло по време на бременност имат различен ефект върху растежа на плода и развитието на органите [40]. Прекомерното хранене на майката в края на бременността води до повишено регулиране на PPARγ-активирани гени във феталната висцерална мазнина и последващо увеличаване на масата на подкожната мастна тъкан в постнаталното агне. Излагането на майчино прекомерно хранене само през периконцептивния период обаче показва, че води до увеличаване на общата телесна мастна маса само при женски агнета с доминиращ ефект върху висцералните мастни депа. Следователно беше предложено ранното програмиране на по-късното затлъстяване да е резултат от „два удара“, първият настъпил в резултат на прехранване на майката през периконцептивния период, а вторият - в резултат на повишено хранене на плода в края на бременността [40].
За разлика от литературата за гризачите, където е доказано, че затлъстяването при майките води до усилен и продължителен неонатален лептинов скок [41], данните при овцете показват, че майчиното затлъстяване елиминира пика на лептина на плазмата на новороденото агнешко месо [39]. Тези разлики могат да бъдат обяснени чрез относителната незрялост на плъха при раждането в сравнение с агнешкото, като новороденото агне се ражда на по-напреднало ниво на зрялост, еквивалентно на хората [39].
2.3. Нечовешки примат
При японския макак консумацията на високочестотна диета, независима от майчиното затлъстяване, повишаване на плацентарните възпалителни цитокини и експресията на Toll-подобен рецептор 4 [47]. Консумацията на високочестотна диета също намалява обемния кръвен поток от феталната страна на плацентата и значително увеличава честотата както на инфаркти на плацентата, така и на мъртво раждане. Тези резултати предполагат, че високочестотната диета, независимо от затлъстяването, намалява обема на матката в кръвния поток с майчино затлъстяване и инсулинова резистентност, което допълнително изостря плацентарната дисфункция и води до повишена честота на мъртво раждане [47]. Това е в съответствие с данните за гризачите, при което е доказано, че високочестотната диета на майката води до намалено тегло на феталните и плацентарните съединителни зони [48].
3. Механизми
Механизмите, подкрепящи затлъстяването при майките и програмирането на риска от затлъстяване при потомството, не са добре дефинирани. Ограничените данни до момента подчертават ролята на промененото производство и регулиране на лептин и промените в хипоталамусната регулация на ключови гени, участващи в контрола на апетита и енергийния баланс. Съществуват също доказателства за променен метаболизъм на скелетната мускулатура и индуцирани от майчината СН диета върху структурата и функцията на плацентата.
3.1. Лептин и регулирането на енергийния баланс
3.2. Препрограмиране на хипоталамуса
Въпреки нарастващите доказателства за невротропна роля на лептина в гризача, потенциалната роля при хората и времето на възможния скок на лептин са по-малко дефинирани. Кърк и сътр. са показали, че индуцираното от майката затлъстяване трайно влияе върху централните процеси, регулиращи приема на храна при потомството чрез програмиране на лептинова резистентност и променени хипоталамусни функции, включващи дъговидното ядро и паравентрикуларното ядро. Освен това, вътрематочното и ранното постнатално прехранване програмират хипоталамусни неврони, експресиращи стимулатора на апетита невропептид Y (NPY) и супресор проопиомеланокортин (POMC) при потомството при отбиване [15]. Въпреки това дългосрочните ефекти на такова програмиране и взаимодействието му с консумацията на HF диета след отбиване остават неясни. Няколко проучвания подчертават промени в експресията на гена, активиран от пероксизомен пролифератор (PPAR) при потомството на затлъстели майки, които могат да допринесат за нарушената липидна хомеостаза. HF потомството е намалило чернодробния PPARγ експресия в сравнение с контролите и намален чернодробен PPARα експресия, която отрицателно корелира със серумните нива на триглицеридите [57].
3.3. Скелетна мускулна и двигателна активност
Работа на Simar et al. при възрастни плъхове разкрива взаимодействие между майчиното затлъстяване и постнаталното прехранване върху метаболизма на скелетната мускулатура, HF диетата след отбиване упражнява адитивен ефект върху тази на майчиното затлъстяване върху телесното тегло и скелетните мускулни маркери на глюкозния и липидния метаболизъм, но не и на плазмената глюкоза и инсулина нива, предполагащи, че майчиното затлъстяване и постнаталното прехранване нарушават функцията на скелетните мускули чрез различни механизми [58]. Намалена мускулна маса също е докладвана при 3- и 6-месечно мъжко и женско потомство от затлъстели мишки [31] и намалена мускулна сила при потомство на майки, хранени с диета с нездравословна храна [59]. Работете в овчи кибрит отблизо, отчетени за плъховете; агнетата, родени от затлъстели майки, имат нарушена инсулинова сигнализация в мускулите в сравнение с контролните агнета, което корелира с повишени интрамускулни триглицериди и по-висока експресия на транспортери на мастни киселини и PPAR-γ [60].
Въпреки че няколко проучвания са изследвали промени в двигателната активност в условията на недохранване на майката [61–63], данните за енергийните разходи и физическата активност в моделите на майчиното затлъстяване все още не са предприети, въпреки многобройните проучвания, които наблюдават различия в мускулното развитие в потомство на затлъстели майки.
3.4. Функция на плацентата
Променената функция на плацентата в условията на майчиното затлъстяване също е във фокуса на няколко изследвания. Нашата група и други хора съобщават за промяна на структурата и функцията на плацентата в резултат на високочестотна диета на майката в редица експериментални модели. При бременни плъхове е доказано, че майчината СН диета намалява растежа на плода и плацентарната зона, но не и растежа на плацентарния лабиринт [48]. При бременните овце затлъстяването при майките значително увеличава експресията на плацентарния транспортер на мастна киселина и възпалителните сигнални пътища и засилва експресията на цитокини в средата на бременността [57]. По същия начин затлъстяването на майката при павиана е свързано с възпалително състояние на майката и индуцира структурни и функционални промени в плацентата [44].
3.5. Интервенции
До относително наскоро програмирането за развитие се разглеждаше като необратима промяна в траекторията на развитие. Извън ранната работа за обръщане на таурина при определянето на модела на майките с ниско съдържание на протеин [64], има оскъдни данни за стратегиите за интервенция, независимо дали става въпрос за хранителен или целенасочен фармакологичен подход. Наскоро беше показано, че интервенциите с лептин, фолиева киселина и екзендин-4 в ранните фази на пластичността на развитието могат да подобрят или обърнат някои от ефектите, свързани с програмирането на развитието [65–67]. Въпреки това, тези агенти са изследвани в контекста на майчината хранителна депривация и не са изследвани в условията на майчино прехранване, въпреки общите черти на фенотипите на потомството в различните хранителни модели. По подобен начин е доказано, че упражненията имат благоприятен ефект при предразположено към затлъстяване потомство на недохранени майки [62, 68], но досега няма проучвания, в които да се изследват упражнения при потомство на HF-хранени майки.
Има доказателства за ролята на обръщане на диетата за подобряване на ефектите от затлъстяването на майката върху резултата от потомството. При нечовешкия примат обръщането на диетата от СН, за контролиране на диетата по време на бременност, доведе до нормализиране на нивата на меланокортин, подобрения в феталните чернодробни триглицериди и частично нормализиране на експресията на глюконеогенни ензими. Тези резултати предполагат, че простото преминаване към нормална диета с ниско съдържание на мазнини, особено по време на бременност, може да намали, но не и да елиминира риска от фетална чернодробна стеатоза [43]. Подобни резултати са показани при плъхове, при които диетичната интервенция преди бременността е обърнала метаболитното програмиране при мъжки потомци на затлъстели плъхове [69].
4. Роля на епигенетиката
Епигенетичните процеси водят до наследствени промени в генната функция, като променят химията на ДНК, независимо от последователността и могат да бъдат отговорни за специфичната за тъканите генна експресия по време на диференциацията. Епигенетичните модификации могат да бъдат един механизъм, чрез който излагането на променена вътрематочна среда или метаболитни смущения може да повлияе на фенотипа на организма много по-късно в живота [70]. Въпреки това, как четирите епигенетични модалности - ДНК метилиране, некодираща РНК, транскрипционни фактори и модификации на хистона - допринасят за епигенетичната памет и как епигеномните промени могат да медиират променения контрол върху феталната експресия на гени като последица от майчиното затлъстяване, не са добре характеризирани.
Експериментални данни при гризачи и неотдавнашни наблюдения при хора показват, че епигенетичните промени в регулаторните и свързаните с растежа гени играят съществена роля в медиацията на патофизиологичните фенотипи, получени от програмирането на развитието [71, 72]. Модификациите на хистон във връзка с метилирането на ДНК регулират хроматиновата структура и генната експресия. Все още се обсъжда къде ранният живот и/или факторите на околната среда могат да повлияят на кода на "хистона" по начин, подобен на влиянието им върху метилирането на ДНК [73].
Неблагополучията по време на бременност или ранен неонатален живот в експериментални модели за програмиране водят до промени в метилирането на промотора, поради което пряко или косвено влияят върху генната експресия в пътища, свързани с редица физиологични процеси [74]. Например, при плъхове са показани променено метилиране на промотора и промени в генетичната експресия за чернодробния глюкокортикоиден рецептор (GR) и PPAR-α [66, 75], влияещи върху въглехидратния и липидния метаболизъм. Фенотипните ефекти на епигенетичните модификации по време на развитието може да не се проявят по-късно в живота, особено ако засягат гени, модулиращи отговорите на по-късни предизвикателства на околната среда, като диетични предизвикателства с високочестотна диета. Времето на прозорците на развитието и индуцирането на епигенетични промени в ключови физиологични системи не е добре характеризирано, но изглежда се простира от периконцептивния период [76] до постнаталния живот [77, 78]. Много от гените, регулирани от епигенетична промяна, не изглежда да са класически отпечатани (изразени според родителския произход на алела), въпреки че някои отпечатани гени могат да покажат променена експресия след смущения по време на ранното развитие, като например култура на бластоцисти инвитро се удължава [79].
Доказано е, че промоторът в лептиновия ген подлежи на епигенетично програмиране и експресията на лептинов ген може да бъде модулирана чрез ДНК метилиране [80–82]. Последните проучвания съобщават, че нарушената глюкозна толерантност по време на бременност е свързана с адаптации в метилирането на ДНК на лептинов ген, въпреки че функционалното значение на тези промени все още не е ясно [83]. Yokomori et al. демонстрира, че метилирането на специфични CpG места и чувствителния към метилиране протеин могат да допринесат за промени в експресията на лептинов ген по време на диференциация на адипоцитите в 3T3-L1 клетки [84]. В допълнение, диференциално метилиране на ДНК се наблюдава при промотори на гени, участващи в метаболизма на глюкозата, включително GLUT4 [85] и разединяващ протеин (UCP) -2 [86], и двата основни фактора за развитието на T2DM.
Смята се, че епигенетиката за развитие установява „адаптивни фенотипове“, за да отговори на изискванията на средата в по-късния живот [73, 87]. Имплицитно в тази концепция е важен процес на причинно-следствена връзка на клетъчно ниво, регулиращ растежа и диференциацията на тъканите и включващ химични промени в ДНК или свързаните с тях протеини. След като се разбере механистичната основа на заболяването, епигенетичните процеси са потенциално обратими и могат да бъдат измислени и приложени интервенции и стратегии, насочени към обръщане. Неотдавнашно проучване предполага, че съществен компонент на риска от метаболитни заболявания има пренатално развитие и че перинаталният епигенетичен анализ може да бъде полезен при идентифициране на индивидуалната уязвимост към по-късно затлъстяване и метаболитно заболяване [88]. В това проучване те съобщават за връзка между метилирането на генния промотор на ретиноиден х-рецептор алфа (RXRA) в тъканта на пъпната връв и по-късния риск от детско затлъстяване.
5. Предаване по бащина линия
6. Обобщение
Благодарности
Авторите признават подкрепата на Националния изследователски център за растеж и развитие, Съвета за здравни изследвания на Нова Зеландия, Фонда Марсден на Кралското общество на Нова Зеландия и Фондацията за научни изследвания и технологии.
Препратки
- Резултати от метаболизма през целия живот на затлъстяването при майките за потомство от лоши траектории на развитие
- Затлъстяването при майките увеличава риска от метаболитни заболявания при потомството, показва проучване на плъхове
- Хранене на майката и програмиране на затлъстяването
- Има ли място за коензим Q при лечението на метаболитни нарушения, свързани със затлъстяването
- Програмирането на майката по време на бременност предизвиква дългосрочно следродилно затлъстяване