Бевърли Сара Мюлхауслер
1 Ранен произход на изследователската група за здравето на възрастни; Институт Сансъм; Университет на Южна Австралия; Аделаида Австралия
Клер Л Адам
2 Отдел за затлъстяване и метаболитно здраве; Роует изследователски институт; Бъксбърн; Абърдийн, Шотландия, Великобритания
Аз Каролайн Макмилън
1 Ранен произход на изследователската група за здравето на възрастни; Институт Сансъм; Университет на Южна Австралия; Аделаида Австралия
Резюме
Нарастващата честота на затлъстяване в развития и развиващия се свят през последното десетилетие доведе до необходимостта да се дефинира нашето разбиране за физиологичните механизми, които могат да предразположат индивидите към напълняване в бебешка, детска и зряла възраст. Понастоящем съществуват значителни доказателства, които показват, че пътят към затлъстяването може да започне много рано в живота и че излагането на неподходящо ниво на хранене по време на пренаталното и/или ранното постнатално развитие може да предразположи хората към затлъстяване в по-късния живот Мозъкът е в основата на регулирането на апетита и хранителните предпочитания и все повече се признава, че развитието на централните апетитни структури е силно чувствително към хранителната среда както преди, така и непосредствено след раждането. Този преглед ще обобщи работата, която подчертава критичната роля на мозъка в ранния произход на затлъстяването и представя някои перспективи по отношение на потенциалното приложение на тези резултати от изследванията в клиничната обстановка.
Въведение
Регулирането на апетита при възрастни
Подробно резюме на тази мрежа е извън обхвата на настоящия преглед и затова ще бъде разгледано накратко тук. Сега обаче има серия от съвременни и изчерпателни прегледи, описващи сложната невронна мрежа, която е отговорна за регулирането на апетита и метаболизма при възрастни. 7 - 9
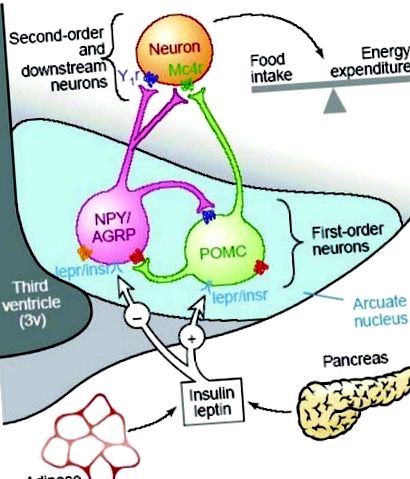
Контролът на апетита и енергийния баланс се осъществява чрез колекция от хипоталамусни невропептиди, които се експресират главно в дъгообразното ядро (ARC) на хипоталамуса (фиг. 1). 7, 8, 10, 11 Тази невронна мрежа на хипоталамуса интегрира сигнали, свързани с енергоснабдяването, енергийното оползотворяване и общите енергийни резерви, за да регулира по подходящ начин приема на храна и енергийните разходи, за да поддържа енергийния баланс. 8 Невроните, които експресират тези невропептиди, имат широки проекции към други хипоталамусни ядра, включително дорзомедиалния хипоталамус (DMH), страничния хипоталамус (LHA) и паравентрикуларното ядро (PVN), където се набират допълнителни орексигенни сигнали. 7 Хормоналните и метаболитни сигнали, свързани с енергийния прием, усвояването на енергията и общите енергийни резерви, се получават от невроните от първи ред в ARC, а от тук се предават към невроните от втори ред в други ядра на хипоталамуса. Терминалите от всички орексигенови и анорексигенни сигнали се сближават окончателно на PVN и се предполага, че този хипоталамусен регион е отговорен за интегрирането на тези сигнали и за иницииране на подходящи метаболитни корекции за поддържане на енергийния баланс. 12
Схематичен преглед на пътищата за регулиране на апетита при възрастен хипоталамус. (От реф. 9 с разрешение.)
Сред регулаторите на апетита на хипоталамуса най-добре са описани орексигенните невропепетиди, невропептид Y (NPY) и свързаният с агути пептид (AGRP) и анорексигенните невропептиди, произведен от про-опиомеланокортин (POMC) α-меланоцит-стимулиращ хормон (α-MSH) и кокаин и амфетамин регулиран транскрипт (CART), всички от които са изразени в ARC. NPY е най-мощният стимулатор на апетита досега идентифициран, а централното приложение на NPY в PVN води до значително увеличаване на апетита и приема на храна. 13 - 16 Както експресията на NPY иРНК в ARC, така и освобождаването на NPY в PVN са значително повишени в отговор на гладно или ограничаване на храните, както in vivo, така и in vitro. 17 Обратно, експресията на NPY е регулирана надолу в отговор на сигнали за увеличени енергийни запаси, включително лептин, инсулин и глюкоза. 8, 18, 19
Сигнализиращата система за меланокортин осигурява противоположния анорексигенен стремеж, базиран на получени от POMC α-MSH, който действа чрез меланокортиновите рецептори (MC3R и MC4R), за да потисне приема на храна. 20 - 23 Експресията на POMC иРНК в ARC се регулира нагоре по време на периоди на висок енергиен прием и се намалява чрез гладуване или ограничаване на храната. 24, 25 Свързаният с Agouti протеин (AGRP) действа като ендогенен антагонист на MCRs и увеличаването на експресията на AGRP следователно инхибира сигнализирането за меланокортин и повишава апетита. 26 По този начин физиологичните ефекти на сигнализирането за меланокортин зависят от баланса между POMC (α-MSH) и експресията на AGRP в ARC.
CART е друг важен компонент на централната мрежа за регулиране на апетита, действайки като мощен инхибитор на храненето. Централното приложение на CART пептид драстично намалява храненето при гризачи, докато блокирането на действията на CART с CART антитела води до значително увеличаване на приема на храна. 27 При гризачите CART се експресира съвместно с POMC в ARC, което предполага, че CART може да взаимодейства със сигналната система за меланокортин. Рецепторите за лептин присъстват върху CART позитивните неврони в хипоталамуса, а лептинът увеличава c-Fos активността в CART пептид-позитивните неврони. 28, 29 Освен това, експресията на CART mRNA в ARC е намалена по време на гладуване при гризачи. 30
Регулирането на апетита вътреутробно
Както беше посочено по-рано, невронната верига, свързваща различните региони на хипоталамуса и която е от решаващо значение за интегрираното регулиране на поведението при хранене, е налице преди раждането при овцете и приматите, които не са хора, както и при хората. 32 - 34, 36 При гризача обаче тази невронална верига не е напълно установена до 16 дни след раждането. 33, 37, 38 Следователно е ясно, че критичните прозорци на развитие, през които излагането на променени нива на хранителни вещества ще има дългосрочни ефекти върху развитието на тази ос, са различни при гризачите, отколкото при големите животински модели и хората, и че това става важно при разглеждане на потенциалните клинични последици от констатациите на текущите изследвания.
Функционира ли централната невронна мрежа за регулиране на апетита преди раждането?
В исторически план плодът се разглежда като пасивен реципиент на трансплацентарно хранене, с ограничен капацитет да реагира на периферни сигнали за текущ хранителен статус. Сега обаче става все по-ясно, че системата, която регулира апетита в постнаталния живот, вече реагира на сигнали за хранителен статус, т.е. глюкоза и инсулин, преди раждането. Преди повече от десет години Сингх и колеги показаха, че излагането на хипергликемия и хиперинсулинемия преди раждането при плъхове намалява експресията на NPY във феталния хипоталамус в края на бременността. 39 Също така е демонстрирано, че лишаването на малките плъхове от достъп до майчиното мляко за 24 до 36 часа води до значително увеличение на експресията на NPY mRNA в ARC от още след постнаталния ден 2, което предполага, че системата за регулиране на апетита е реагира на лишаване от хранителни вещества в началото на постнаталния живот, преди невроналната верига да бъде напълно установена. 33 Оттогава се провеждат подобни проучвания при големи животински модели, като овцете, при които тези системи се развиват преди раждането, както при човека.
За да установим дали и до каква степен невронната верига може да реагира на увеличеното снабдяване с глюкоза преди раждането при овцете, ние определихме ефекта от феталната хипергликемия и хиперинсулинемия в края на бременността върху експресията на невропептидите, регулиращи апетита. Интрафеталната инфузия на глюкоза (при бременност 130–140 дни; срок = ∼150 дни) е свързана с 2,5-кратно увеличение на плазмената глюкоза и ∼ 2-кратно увеличение на плазмените концентрации на инсулин във феталната циркулация, докато плазмените концентрации на лептин не са засегнати . 40 Важното е, че тази пренатална хипергликемия доведе до значително увеличаване на експресията на POMC иРНК в ARC (фиг. 2). Експресията на анорексигенния невропептид, CART и орексигенните пептиди, NPY и AGRP, не се променя при инфузирани с глюкоза плодове. 40 Тези открития предоставят доказателства, че съдържащите POMC неврони във феталния хипоталамус, но не и тези, съдържащи NPY, AGRP или CART, могат да реагират директно на променените концентрации на глюкоза и/или инсулин във феталната циркулация в края на бременността. По-нататъшни проучвания на овце плодове в средата на бременността (81 дни) също установяват положителна връзка между POMC иРНК в ARC и фетална гликемия на този по-ранен етап (C.L. Adam, et al., Непубликувани данни).
Инфузията на лептин при фетални овце от 131–134 d бременност води до шесткратно увеличение на плазмените концентрации на лептин, но не и промяна в експресията на анорексигенните (POMC и CART) или орексигенните (AGRP и NPY) невропептиди във плода хипоталамус в края на инфузионния период. 49 В същото това проучване обаче има някои доказателства за обратна връзка между концентрациите на лептин в деня на събиране на тъканите и експресията на NPY mRNA във феталния ARC. Въпреки че по-нататъшните проучвания са ясно оправдани, ние предполагаме, че това може да е следствие от появата на реакция на лептин в популацията на NPY-експресиращи неврони при бременност 134 d при овцете. 49 Интересното е, че Proulx и колеги преди това са показали, че лечението с лептин при новородени гризачи, време, еквивалентно на късната бременност при овцете и хората, може да промени експресията на регулиращи апетита невропептиди NPY и POMC в ростралния ARC, но е било без никакви влияят върху приема на храна, което предполага, че чувствителността към лептин може да се появи преди завършване на невронните връзки между дискретни хипоталамусни области. 50
Ограничената реакция на невропептидите, регулиращи апетита към лептин в началото на развитието, е в съответствие с резултатите от проучвания върху гризачи 51 и предполага, че чувствителността на регулиращите апетита невропептиди към лептин се проявява относително късно в развитието на тази мрежа. Нашата работа при фетални и новородени овце ни накара да предположим, че причината за ограничения капацитет за реагиране на лептин вътреутробно може да е следствие от относително ниското ниво на генна експресия за сигналната форма на лептиновия рецептор (OBRb) в ARC неврони. При възрастните овце рецепторите за лептин се експресират обилно в ARC и на по-ниско ниво във вентромедиалния хипоталамус (VMH) 52, докато по време на феталния и ранния постнатален живот това разпределение е обърнато. 35, 40 Освен това, изобилието на експресия на OBRb в ARC спрямо VMN се увеличава по време на бременността и в ранния постнатален живот; OBRb е неоткриваем в ARC при 134 d бременност (Muhlhausler et al., Непубликувани наблюдения), но се увеличава спрямо експресията в VMH при 141 d бременност, 40 и допълнително се увеличава с 30 d след раждането (фиг. 3). 53
Авторадиографии, изобразяващи типични модели на експресия на OBRb при фетални овце при (A) 134 d бременност (B) 141 d бременност и (C) 30 d след раждането. (D) Графика, изобразяваща съотношението на експресия на OBRb в дъговидното ядро (ARC) и вентромедиалния хипоталамус (VMH) при 134 d бременност, 141 d бременност и 30 d след раждането. Различните букви означават значителни разлики между възрастовите групи p 54 Тези наблюдения са потвърдени от Plagemann и колеги, които показват, че излагането на прекомерно хранене (т.е. хипергликемия и хиперинсулинемия) или преди раждането, или в ранния постнатален период води до постоянна хиперфагия и развитие на затлъстяване до 3-седмична възраст. 55 Важното е, че продължаващата работа в лабораторията на Plagemann през последното десетилетие сега убедително демонстрира, че излагането на пренатално или постнатално прехранване при гризачите води до съществени промени в развитието на хипоталамусната архитектура. 55, 56
Преглед на настоящата ни работна хипотеза за пътя, през който преяждането на майките води до програмиране на затлъстяването в постнаталния живот.
Намаленото снабдяване с хранителни вещества по време на пренаталното и ранното постнатално развитие също показва, че програмира апетита и състава на тялото. Малките, родени от язовири със силно ограничени хранителни вещества, имат ограничен растеж при раждането, хиперфагични са в постнаталния живот и развиват затлъстяване, инсулинова резистентност и хиперлептинемия в зряла възраст. 63, 64 Тази хиперфагия се усилва, когато потомството се храни с хиперкалорична диета в периода след отбиването, 63 което предполага, че зададената точка на регулиране на апетита при тези потомци е постоянно нулирана на повишено ниво. Въпреки това, Plagemann et al. установи също, че специфичното ограничаване на майчиния протеин по време на бременност и кърмене води до хипофагия и намалено телесно тегло при потомството; това изглежда е последица от хипоплазия на неврони, експресиращи NPY и галанин в ARC, PVN и LHA при отбиване. 65, 66
Въпреки че основните механизми за програмиране на невронната мрежа за регулиране на апетита все още не са напълно разбрани, изследванията на Plagemann включват инсулина като ключов регулатор на тези адаптации. Както диабетът на майката, така и ранното постнатално прехранване водят до перинатална хиперинсулинемия, а периферното или интрахипоталамусното лечение с инсулин през перинаталния период също води до хиперфагия, повишено наддаване на тегло, затлъстяване, хиперинсулинемия и инсулинова резистентност в зрял живот. 67, 68 При модели на гризачи на майчински диабет, леченията, които нормализират концентрациите на глюкоза при майките, също предотвратяват развитието на затлъстяване и метаболитни нарушения при потомството. 69 Концентрациите на инсулин и глюкоза в плода и перината са очевидно важни, но скорошните проучвания вече показват критична роля на лептина в развитието на апетитни структури.
Лептин и развитието на невронната мрежа, регулираща апетита
Добре установено е, че лептинът играе централна роля в регулирането на експресията на регулиращите апетита невропептиди и следователно регулирането на приема на храна при възрастни. Дългата форма на лептиновия рецептор (OBRb) се експресира върху NPY/AGRP и POMC/CART неврони в хипоталамусния ARC и е демонстрирано, че централното 70 или периферно 71 приложение на лептин намалява експресията на NPY/AGRP гена и увеличава POMC/Експресия на мРНК на CART в ARC невроните. 72, 73 Наскоро стана ясно, че лептинът може да играе критична роля в регулирането на развитието на апетитните структури много по-рано в живота, както преди, така и след раждането.
Участието на лептин в нормалното развитие на хипоталамусните апетитни структури може да бъде от основно значение за програмирането на затлъстяването в модели на ограничаване на растежа на плода. Викерс и колеги съобщават, че подкожното доставяне на лептин на ограничено за растеж потомство на язовири с ограничени хранителни вещества в ранния постнатален период нормализира постнаталната хиперфагия и предотвратява по-късното развитие на затлъстяване и хиперлептинемия при потомството. 76 Поради това се предполага, че нивата на лептин в циркулацията по време на феталния и ранния неонатален живот могат да имат последици за развитието на системите за регулиране на енергийния баланс в постнаталния живот. Основният механизъм и критичният прозорец, през който лечението с лептин може да бъде ефективно, все още не са ясно дефинирани, а подобни проучвания на Yura и колегите не са успели да покажат сравними ефекти. 77
Тези открития очевидно имат потенциално клинично приложение и вече е издигната перспективата за добавки с лептин за кърмачета като потенциална стратегия за намаляване на тежестта на детското затлъстяване. 79 Както при всички сравнително нови области на изследване, също така е важно да се разберат биологичните последици от такова лечение и да се внимава при екстраполиране на резултатите от високопоставени видове към новороденото при човека. Също така е така, че има няколко проучвания, които не са успели да покажат какъвто и да е ефект от лечението с новородени лептини при гризачи върху наддаването на тегло, апетита или телесния състав на потомството. 77, 81 Следователно, докато лептинът изглежда има важна роля в развитието на хипоталамусните вериги, все още има нужда от допълнително проучване на потенциалната роля на лептина в програмирането на затлъстяването.
Предпочитания за храна: Вкусът за нездравословна храна се предава на следващото поколение?
Една от най-важните концепции, които възникват в областта на програмирането на апетита и приема на храна, е схващането, че предпочитанията към храната, а не само контрол на апетита сами по себе си, могат да бъдат установени преди раждането. 82 Става все по-ясно, че въздействието на определени храни върху регулирането на ситостта зависи не само от количеството погълната храна, но и от качеството. 83 По този начин силно вкусните храни (с високо съдържание на наситени мазнини и/или прости захари) насърчават прекомерното хранене и бързото наддаване на тегло в по-голяма степен от другите храни. Съществуват нови доказателства, че предпочитанието към храни с високо съдържание на мазнини и високо съдържание на захар може да бъде програмирано още в утробата.
Групата на Langley-Evan представи първите доказателства, че излагането на смущения на хранителната среда в утробата може да промени хранителните предпочитания на потомството. В тези проучвания на потомството на майки, изложени на диета с ниско съдържание на протеини по време на бременност и кърмене, е осигурен ad libitum достъп до селекция от високо протеини, мазнини и контролна чау след отбиване, което позволява измерване на относителния прием на съответните диети . Излагането на диета с ниско съдържание на протеини вътреутробно води до повишено предпочитание към храни с високо съдържание на мазнини при женското потомство. 84 Това осигурява потенциален механизъм за програмиране на затлъстяването при тези потомци, който е широко демонстриран от тази и други групи. 82, 85 Въпреки че е доказана връзка между храненето на майките с ниско съдържание на протеини и предпочитанията към храни с високо съдържание на мазнини, може би е уместно диетата с ниско съдържание на протеини да е и диета с високо съдържание на въглехидрати, тъй като нивото на мазнини се поддържа на постоянно ниво. Следователно наблюдаваната връзка може да се дължи на влиянието на високо въглехидрати, а не на ниско съдържание на протеини.
Заключение и перспектива
- Диетата с високо съдържание на мазнини и затлъстяването на майката компрометира феталната хемопоеза - ScienceDirect
- Как затлъстяването при майките влияе на рутинния фетален анатомичен ултразвук PubMed
- Затлъстяването на майките при високорискови бременности и следродилни инфекциозни усложнения - ScienceDirect
- Затлъстяването при майки нарушава развитието на хипоталамуса Природни отзиви Ендокринология
- Затлъстяване при майките и програмиране на развитието на метаболитни нарушения при потомство