Рейчъл К. Троке
Катедра по разследваща медицина, Отдел по диабет, ендокринология и метаболизъм, Империал Колидж Лондон, Лондон, Великобритания
Триша М. Тан
Катедра по разследваща медицина, Отдел по диабет, ендокринология и метаболизъм, Империал Колидж Лондон, Лондон, Великобритания
Стив Р. Блум
Катедра по разследваща медицина, Отдел по диабет, ендокринология и метаболизъм, Империал Колидж в Лондон, 6-ти етаж, сграда на Британската общност, Лондон W12 0HS, Великобритания
Резюме
Пандемията от затлъстяване представлява значителна тежест както по отношение на здравеопазването, така и по отношение на икономическите резултати, а настоящите медицински терапии са недостатъчни за справяне с това предизвикателство. Понастоящем бариатричната хирургия е единствената налична терапия за затлъстяване, която води до продължителна, продължителна загуба на тегло. Счита се, че благоприятните ефекти от тази операция, поне отчасти, се медиират чрез промените на чревните хормони като GLP-1, PYY, PP и оксинтомодулин, наблюдавани след процедурата. Впоследствие тези хормони се превърнаха в привлекателни нови цели за разработване на терапии за затлъстяване. Тук ние правим преглед на развитието на тези чревни пептиди като настоящи и нововъзникващи терапии за лечение на затлъстяване.
Заден план
Настоящата пандемия от затлъстяване представлява голямо предизвикателство за доставчиците на здравни услуги. Според световната статистика на Световната здравна организация (СЗО) през 2008 г. 10% от мъжете и 14% от жените са класифицирани като затлъстели, а още 35% от възрастните са категоризирани като с наднормено тегло [WHO, 2012] Този проблем е преувеличен в западните страни и само до 2011 г. в Англия делът на наднорменото тегло и затлъстяването се е увеличил до 65% от мъжете и 58% от жените [Информационен център за здравни и социални грижи, 2013]. Тази нарастваща епидемия от затлъстяване представлява огромна тежест както по отношение на здравето, така и по отношение на икономическите резултати. През 2007 г. разходите за NHS, пряко свързани с наднорменото тегло и затлъстяването, възлизат на 4,2 милиарда британски лири [Суонтън, 2008] и се очаква да се увеличат до 8,3 милиарда британски лири до 2025 г., достигайки почти 12% от общия бюджет на NHS [Foresight, 2007]. В допълнение, затлъстяването е важен рисков фактор за редица други медицински състояния, включително диабет тип 2, исхемична болест на сърцето, инсулт и рак и носи повишен риск от смъртност от всички причини и специфична причина [Ringbäck Weitoft et al. 2008; Уитлок и др. 2009; Zheng et al. 2011].
Изправени пред тази нарастваща вълна на затлъстяване, има нужда от ефективни стратегии за медицинско лечение. Въпреки това, терапевтичните възможности, особено медицинските терапии, са ограничени. Само начинът на живот и модификацията на диетата, макар и първоначално обещаващи, не осигуряват дългосрочна възможност за лечение на повечето затлъстели индивиди. Орлистат е единственото разрешено в момента медицинско лечение за затлъстяване във Великобритания. Това е инхибитор на панкреатичната липаза, който предотвратява абсорбцията на мазнини, но постига само умерена загуба на тегло от 2,9 kg в сравнение с плацебо [Rucker et al. 2007]. Терапии като сибутрамин и римонабант, които преди това са били лицензирани за затлъстяване, са оттеглени поради опасения по отношение на сърдечно-съдовото и психиатричното здраве съответно [Christensen et al. 2007; Джеймс и сътр. 2010].
Понастоящем успешното лечение на затлъстяването е ограничено до бариатрична хирургия. Това е единствената терапия, която демонстрира способността да се постигне продължителна, дългосрочна загуба на тегло и да се постигне намаляване на смъртността и заболеваемостта [Sjostrom et al. 2007]. Най-често срещаната бариатрична процедура е стомашният байпас на Roux-en-Y (RYGB), представляващ до 75% от всички операции за отслабване [Smith et al. 2008]. Понастоящем е добре установено, че след байпас на стомаха има промяна в секрецията на различни чревни хормони, свързани с апетита и ситостта, както и енергийните разходи (EE) [Beckman et al. 2011; Le Roux et al. 2006, 2007; Pournaras и сътр. 2010]. Смята се, че тези промени допринасят за превъзходната загуба на тегло и подобряване на кръвната захар, наблюдавани след RYGB. Тези констатации доведоха до предположението, че чревните хормони могат да бъдат мишени за нови терапии за затлъстяване и диабет и има голям последващ интерес към тези пептиди.
Чревни хормони
Пептид YY
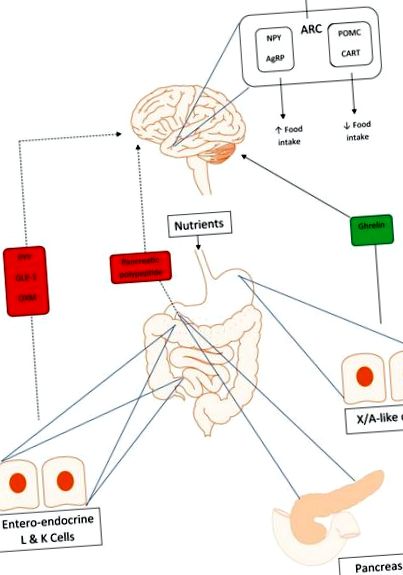
Пептидът YY (PYY) е 36-аминокиселинен пептид, секретиран от ентеро-ендокринни L клетки на дисталното черво в отговор на орално хранително натоварване (Фигура 1). PYY принадлежи към семейството на пептидите ‘PP fold’, което включва панкреатичен полипептид (PP) и невропептид Y (NPY). Те са наречени така, защото тяхната третична структура образува подобна на фиби U-образна гънка.
Взаимодействия между оста на червата и мозъка. Плътна линия показва положителна обратна връзка, а прекъсната линия показва отрицателна обратна връзка. Пептидът YY (PYY), глюкагоноподобният пептид-1 (GLP-1) и оксинтомодулинът (OXM) осигуряват отрицателна обратна връзка в зоните за регулиране на апетита в хипоталамуса при усещане на перорално хранително натоварване. Панкреатичният полипептид (PP) от панкреатичните островчета също е аноректичен, сигнализирайки чрез централните апетитни центрове в хипоталамуса. Грелинът е орексигенен, осигуряващ положителна обратна връзка на ядрата на хипоталамуса и активиращ невропептид Y (NPY) и свързани с аготи пептид (AgRP) неврони за увеличаване на приема на храна.
Секрецията на PYY се стимулира от поглъщането на всички хранителни вещества, но мненията са различни за това кой макронутриент причинява най-голямо стимулиране на освобождаването на PYY. При гризачите изглежда, че протеинът осигурява най-мощния стимул за освобождаването му [Batterham et al. 2006], докато е показано, че диетата с високо съдържание на въглехидрати и ниско съдържание на мазнини дава най-високи нива при затлъстели хора [Essah et al. 2007]. Интересното е, че нивата на PYY започват да се покачват в рамките на около 15 минути от приема на калории [Gibbons et al. 2013], много преди самите хранителни вещества да достигнат до дисталното черво, което предполага други невронни или хормонални механизми за освобождаването му. Той се секретира като PYY1-36 и след това се разцепва от ензима DPP-4, за да даде активната форма, PYY3-36. PYY, заедно с други чревни хормони като оксинтомодулин (OXM) и глюкагон-подобен пептид-1 (GLP-1), показват увеличени нива след хранене при субекти, претърпели операция на стомашен байпас [Borg et al. 2006; Laferrère и сътр. 2010; Le Roux et al. 2006]. Счита се, че този ръст на PYY, поне отчасти, е отговорен за забележимата и продължителна загуба на тегло, наблюдавана при тази група пациенти.
Панкреатичен полипептид
PP принадлежи към същото семейство пептиди ‘PP fold’ като PYY. Подобно на PYY, той също е 36-аминокиселинен пептид, произведен след хранене. Въпреки това, докато PYY идва от ентеро-ендокринни L клетки в дисталното черво, PP се секретира от PP клетките на островчетата Langerhans в панкреаса (Фигура 1) [Adrian et al. 1976; Larsson et al. 1975]. Подобно на PYY, се установява, че нивата на РР са намалени при затлъстели лица и показват по-малко покачване след хранене [Marco et al. 1980].
Известно е, че РР намалява приема на храна при гризачи [Asakawa et al. 2003b], при хора с нормално тегло [Asakawa et al. 2006; Batterham et al. 2003a; Jesudason et al. 2007] и при синдром на Prader – Willi, състояние, характеризиращо се със затлъстяване и хиперфагия [Berntson et al. 1993]. PP има висок афинитет към Y4 рецепторите, подтип на NPY рецептора, който се среща широко в мозъка, включително в хипоталамуса и мозъчния ствол, области, които са ключови за централния контрол на апетита [Parker and Herzog, 1999]. Важността на този централен механизъм на действие на PP се подкрепя от факта, че при мишки с делеция на хипоталамусния Y4 рецептор PP не е в състояние да индуцира активиране на c-fos (маркер за невронално активиране) [Lin et al. 2009].
В допълнение към намаляването на приема на храна, PP също намалява изпразването на стомаха [Asakawa et al. 2003b; Schmidt et al. 2005], потенциално предоставяща обратна връзка на централните центрове за ситост чрез блуждаещия нерв. Вагусните аферентни сигнали се задействат при хранене чрез разтягане на стомашни рецептори в стомаха [Wang et al. 2008]. Интересното е, че Asakawa и колеги, както и демонстриращи намаляване на изпразването на стомаха, показаха, че ваготомията отслабва инхибиторния ефект на PP върху приема на храна. Това дава доказателства, че поне някои от действията му за пресищане са вагиално медиирани, може би чрез стомашно разтягане, но също така потенциално чрез РР рецептори на вагусните аферентни сигнали за центрове за ситост в мозъчния ствол и хипоталамуса [Asakawa et al. 2003b]. Същата група също постулира увеличение на ЕЕ с PP. Увеличаването на ЕЕ, съчетано с намаляване на приема на храна, би увеличило всяка загуба на тегло, причинена от прилагането на PP на затлъстели пациенти [Asakawa et al. 2003b], което го прави привлекателен вариант като терапия за затлъстяване.
Следователно единственото клинично изпитване на терапия на базата на РР е това, проведено от Bloom и колеги, споменати по-горе [Tan et al. 2012]. Всички други данни за употребата на PP при хора са генерирани с помощта на нативния пептид с присъщите му къси t1/2. Необходими са по-нататъшни проучвания in vivo с използване на модифицирани форми на РР, за да се оцени пълният му потенциал като средство против затлъстяване.
Подобен на глюкагон пептид-1
GLP-1 е пептиден хормон, който действа като инкретин, стимулиращ отделянето на инсулин от β клетките на панкреаса в отговор на перорално натоварване с хранителни вещества. GLP-1 се освобождава главно от ентеро-ендокринните L клетки в тънките черва (Фигура 1) [Herrmann et al. 1995]. Той е продукт на пост-транслационна обработка на предшественика на глюкагона, проглукагона [Orskov et al. 1989].
GLP-1 има две основни биологично активни форми, GLP-1 (7-36) амид и GLP-1 (7-37), като преобладаващата е GLP-1 (7-36) амид. GLP-1 се разгражда бързо in vivo от ензима дипептидил пептидаза-4 (DPP-4) до неактивни метаболити и следователно има кратко циркулиращ t1/2, което прави естествения GLP-1 неподходящ за терапевтична употреба. GLP-1 действа чрез свой собствен различен рецептор, свързан с G протеин рецептор, който има разнообразно тъканно разпределение при хората. Наред с други, GLP-1 рецепторите се намират в панкреаса, червата и мозъка, по-специално в хипоталамуса, NTS и областта на пострема (AP), всички области, тясно свързани с регулирането на апетита [Merchenthaler et al. 1999]. В допълнение към неговия инкретинов ефект, действията на GLP-1 включват потискане на секрецията на глюкагон от α клетки на панкреаса [Creutzfeldt et al. 1996], забавяне изпразването на стомаха [Schirra et al. 2006] и потискане на апетита [Punjabi et al. 2011].
В момента GLP-1 е най-успешният чревен хормон, който се използва за терапевтични цели при хората. Използва се за лечение на диабет тип 2 поради неговия инкретинов ефект и към днешна дата има няколко препарата. Първата молекула, разработена като лекарство, е екзенатид (Byetta®). За първи път е одобрен от Американската администрация по храните и лекарствата (FDA) през 2005 г. и е получен от слюнката на Gila Monster гущер Heloderma suspectum. Той споделя само 53% хомология с човешкия GLP-1. Въпреки че се свързва с GLP-1 рецептора, той е устойчив на разграждане от DPP-4, удължава t1/2 и позволява инжектиране два пъти дневно [Robles and Singh-Franco, 2009]. След това бяха направени други манипулации на GLP-1 за удължаване на t1/2 и осигуряване на по-приемлив график на инжектиране. Liraglutide (Victoza®) е разработен като алтернатива на инжекцията веднъж дневно на екзенатид. Лираглутид има много по-близка хомология (97%) с човешкия GLP-1, но е модифициран чрез добавяне на верига от 16 въглеродни мастни киселини, която му позволява да се свързва с албумин [Sisson, 2011]. Това отрича разбивката и изчистването и позволява по-желаното приложение веднъж дневно. В проучване директно с главата лираглутид се представя по-добре от екзенатид по отношение на гликемичното подобрение, но степента на загуба на телесно тегло е сходна и в двете групи, и умерена при
Напоследък бяха изразени опасения относно безопасността на GLP-1 рецепторните агонисти. Предполага се, че както DPP-4 инхибиторите (които предотвратяват разграждането на GLP-1), така и GLP-1 рецепторните агонисти увеличават потенциалния риск от панкреатит, рак на панкреаса, хиперплазия на екзокринния панкреас и хиперплазия на С-клетъчна щитовидна жлеза, потенциално предшественик на медуларен рак на щитовидната жлеза [Butler et al. 2013]. Тези констатации обаче продължават да бъдат разследвани и все още не е направено заключение по отношение на причинно-следствената връзка. Трябва да се има предвид и съотношението риск-полза от употребата на тези средства [Nauck, 2013].
Оксинтомодулин
OXM, 37-аминокиселинен пептиден хормон се обработва подобно на GLP-1, от пост-транслационна обработка на проглукагон. Той се секретира с GLP-1 от ентеро-ендокринните L клетки в отговор на хранене (Фигура 1). OXM се свързва както с GLP-1, така и с глюкагоновите рецептори, но изглежда вероятно да упражнява по-голямата част от ефекта си върху апетита чрез GLP-1 рецептора, тъй като едновременното приложение на GLP-1 рецепторен антагонист блокира аноректичните действия на OXM Dakin et al. 2001].
Доказано е, че OXM инхибира както секрецията на стомашна киселина, така и секрецията на панкреатичния ензим, в допълнение към забавянето на изпразването на стомаха след интравенозно приложение [Schjoldager et al. 1989]. Като се има предвид, че периферно при плъхове е доказано, че OXM значително намалява приема на храна, както и намалява наддаването на телесно тегло в сравнение с животни, хранени по двойки [Dakin et al. 2004]. Тъй като групите, хранени по двойки и третирани, получават идентични количества храна, групата, лекувана с OXM, трябва да има допълнителен стимул за загуба на тегло, освен намаления прием на храна. При изследване на мастните накладки и на двете групи животни, теглото на мастната подложка е било по-ниско при плъхове, третирани с OXM. Това предполага увеличаване на ЕЕ да бъде допълнителен стимул за отслабване, като групата OXM използва запасите от мазнини като енергиен субстрат. Доказано е, че OXM повишава EE [Dakin et al. 2002; Wynne et al. 2006], което изглежда е медиирано чрез увеличаване на свързаната с дейността ЕЕ. Наскоро показахме, че екзогенно прилаганият глюкагон надеждно увеличава ЕЕ в покой [Tan et al. 2013] Тъй като OXM има двойно действие както към глюкагоновия, така и към GLP-1 рецепторите, вероятно е да оказва въздействие върху ЕЕ чрез глюкагоновия рецептор.
Когато се инжектира централно в ARC, OXM предизвиква трайно инхибиране на приема на храна [Dakin et al. 2004]. Съобщава се, че интравенозната инфузия на OXM при здрави човешки доброволци намалява приема на храна [Cohen et al. [По време на и през 12-те часа след края на инфузията. Освен това подкожното самостоятелно приложение на OXM за период от 4 седмици даде 2,4% намаление на телесното тегло и намали приема на храна при доброволци с наднормено тегло и затлъстяване [Wynne et al. 2005].
Грелин
Грелинът е единственият известен орексигенен хормон и когато се прилага на човешки доброволци, както слаби, така и затлъстели, той увеличава приема на храна [Druce et al. 2005, 2006]. Това е 28-аминокиселинен пептид, секретиран от X/A-подобни клетки в дъното на стомаха (Фигура 1) и е най-висок на гладно, като нивата падат след хранене. Грелин съществува в две основни форми, неактивна, неацилирана форма и активна, ацилирана форма, превърната от неацилиран грелин от ензима Грелин О-ацилтрансфераза (GOAT). Подобно на PP, PYY и други чревни хормони, грелинът има рецептори в хипоталамуса, които могат да допринесат за ефекта му върху апетита [Mondal et al. 2005; Willesen et al. 1999]. Известно е, че ацил-грелинът, активната форма, намалява секрецията на инсулин [Tong et al. 2013]
Интересното е, че потискането на грелин след хранене не е свързано с вагусна сигнализация, но повишаването на грелин, наблюдавано на гладно, е напълно премахнато чрез субдиафрагмална ваготомия [Williams et al. 2003], предполага, че потискането на апетита, освен че се медиира чрез хипоталамуса, може да се контролира и по други пътища.
Комбинирани терапии
Въпреки обещаващи резултати с някои от тези чревни хормони като монотерапия, ако наистина искаме да възпроизведем промените в чревния хормон, наблюдавани след бариатрична хирургия, тогава може да се получат по-добри резултати чрез комбиниране на ефектите на повече от един хормон. През 2005 г. Neary и колегите му показват, че PYY и GLP-1 имат адитивен ефект върху приема на храна както при периферно приложение на мишки, така и след интравенозна инфузия при хора [Neary et al. 2005]. Впоследствие същата група изследва комбинацията от РР и PYY, но няма полза от комбинацията от тези два хормона спрямо нито един пептид, когато се дава на мишки или хора [Neary et al. 2008]. Комбинацията от PYY и OXM действа върху NPY рецепторите, както и GLP-1, така и глюкагоновите рецептори, и тази комбинация също показва намаляване на приема на храна в сравнение с всеки един от хормоните [Field et al. 2010]. В допълнение, не трябва да забравяме двойните агонистични ефекти на GLP-1 и глюкагона, описани по-горе [Day et al. 2009; Pocai et al. 2009]. Използването на двойни или дори тройни агонисти на хормоните, описани по-горе, може да съдържа ключът към максимална загуба на телесно тегло и разработване на оптимално лечение на затлъстяването.
Заключение
За да се справи с глобалния проблем със затлъстяването, трябва да се разработят нови възможности за лечение извън операционната зала. Те трябва да насърчават промяна в баланса между енергийния прием и разход чрез увеличаване на ситостта, намаляване на апетита и насърчаване на увеличаване на енергийната продукция. Свойствата на чревните хормони и техните известни ефекти върху ЕЕ и приема отговарят на тези критерии и ги превръщат в основни цели за разработването на нови терапии за затлъстяване.
Бележки под линия
Финансиране: Секцията се финансира от безвъзмездни средства от MRC, BBSRC, NIHR, награда за изграждане на капацитет за интегративна биология на бозайници (IMB), безвъзмездна помощ от FP7- ЗДРАВЕ- 2009-241592 EuroCHIP и се подпомага от схемата за финансиране на Имперския център за биомедицински изследвания на NIHR. R.C.T. се подкрепя от Стипендия за клинични изследвания от MRC. T.M.T. се подкрепя от безвъзмездни средства от MRC. S.R.B. се подкрепя от наградата за старши изследователи на НИПЧ и MRC.
Изявление за конфликт на интереси: Авторите не декларират конфликт на интереси при подготовката на тази статия.
Информация за сътрудника
Рейчъл К. Троке, Катедра по разследваща медицина, Отдел по диабет, ендокринология и метаболизъм, Имперски колеж Лондон, Лондон, Великобритания.
Триша М. Тан, Катедра по разследваща медицина, Отдел по диабет, ендокринология и метаболизъм, Imperial College London, Лондон, Великобритания.
Стив Р. Блум, Катедра по разследваща медицина, Отдел по диабет, ендокринология и метаболизъм, Imperial College London, 6th Floor, Commonwealth Building, London W12 0HS, UK.
- Ролята на симпатиковата нервна система и затлъстяването в етиологията и лечението - Snitker - 2000 -
- Ролята на стоматологията при лечение на затлъстяване - Преглед - ScienceDirect
- УПОТРЕБА НА ЛЕКАРСТВА ПРИ ЛЕЧЕНИЕ НА ЗАТЪЛВАНЕ Годишен преглед на храненето
- Използване на метформин при лечение на детско затлъстяване - изглед в пълен текст
- Гроздената лоза, използвана в традиционната китайска медицина, е потенциално лечение на затлъстяването -