Люк Тапи
Катедра по физиология, Факултет по биология и медицина, Университет в Лозана, Rue du Bugnon 7, 1005 Лозана, Швейцария
Ким-Ан Ле
Отдел за хранене на общественото здраве, Изследователски център Nestlé, Vers-chez-les-blanc, Route du Jorat 57, 1000 Лозана 26, Швейцария
Резюме
Подозрението, че съдържащите фруктоза калорични подсладители (FCCS) могат да играят причинно-следствена роля в развитието на метаболитни заболявания, предизвика интензивни основни и клинични изследвания през последните 10 години. Проспективните кохортни проучвания се сближават, за да покажат, че FCCS, и по-специално подсладените със захар напитки (SSB), консумацията е свързана с увеличаване на теглото във времето. Интервенционни проучвания, при които консумацията на FCCS или SSB се променя, докато приемът на храна по друг начин се оставя ad libitum, показва, че повишеният FCCS обикновено увеличава общия енергиен прием и телесното тегло, докато намаляването на FCCS намалява наддаването на телесно тегло. Клиничните проучвания, оценяващи ефектите от намаляване на SSB като единствена намеса, обаче не успяват да наблюдават клинично значима загуба на тегло. Много механистични проучвания показват, че излишъкът от FCCS може да причини потенциални неблагоприятни метаболитни ефекти. Дали това е свързано с дългосрочен риск остава неизвестно. Понастоящем липсват научни доказателства, че излишният прием на FCCS причинява по-вредни ефекти върху здравето, отколкото излишъкът от други макронутриенти. Голямото потребление на FCCS в популацията го прави една от няколко цели за лечение и профилактика на метаболитни заболявания.
Въведение
Свободната фруктоза и захароза присъстват естествено в плодовете, зеленчуците и меда и най-вероятно са били част от човешката диета от началото на човечеството. Нивото на консумация на фруктоза обаче остава много ниско до деветнадесети век, когато захарта става широко достъпна на ниска цена поради колониалната търговия. Интересно е, че консумацията на захар е тясно свързана с консумацията на подсладени напитки, първоначално чай, кафе и шоколад през деветнадесети век, а по-късно газирани напитки в началото на ХХ век [1, 2].
Дебатът за въздействието на захарта върху здравето далеч не е отскоро. През 1912 г. френският лекар Пол Картън предлага [3], че човешките заболявания са свързани главно с консумацията на три смъртоносни хранителни вещества: алкохол, месо и индустриална захар. През 60-те години Юдкин предполага, че чистата, бяла и смъртоносна захар, повече от наситените мазнини, е от ключово значение за причиняване на сърдечно-съдови заболявания [4, 5]. Неблагоприятните ефекти на захарите обаче остават противоречиви и друг френски лекар Жерар Дебри заключава след обширен преглед на литературата до 1995 г., че има малко доказателства в подкрепа на вредния ефект на захарите [6].
Дебатът за захарта беше подновен през 2004 г., когато Bray, Niels и Popkins заподозряха причинно-следствена връзка между увеличената консумация на високофруктозен царевичен сироп (HFCS) и нарастването на разпространението на затлъстяването в САЩ [7]. Те предположиха, че фруктозата е конкретно отговорна за неблагоприятните ефекти върху здравето поради нейния специфичен метаболизъм. Първоначалното подаване на сигнал, инкриминиращо нови индустриално произведени подсладители, беше отчасти свързано с неправилното предположение, че HFCS съдържа повече фруктоза от захарозата. Действителното съдържание на фруктоза в HFCS е някъде между 42 и 55% от общите захари и следователно показва малка разлика със захарозата. Няколко клинични проучвания, сравняващи ефектите на HFCS и захарозата, стигат до извода, че тези два подсладителя имат много сходни ефекти [8–10]. Независимо от това в научната литература и в непрофесионалната преса бяха публикувани много твърди позиции, в които се посочва, че захарта и по-конкретно нейният фруктозен компонент е токсично вещество и основен фактор, определящ незаразните болести [11–14].
След този първоначален подновен интерес към калорични подсладители, съдържащи фруктоза (FCCS), са проведени много изследователски изследвания и са публикувани много статии, но противоречието продължава. Няколко здравни организации обаче стигнаха до заключението, че потреблението на добавена захар трябва да бъде драстично намалено до по-малко от 5% от общата енергия (http://www.who.int/nutrition/sugars_public_consultation/en/, https://www.gov.uk/government/консултации/консултация-на-проект-sacn-въглехидрати-и-здраве-доклад); тези препоръки изглеждат в противоречие с докладите на Европейската агенция за безопасност на храните [15] и Института по медицина [16], които и двамата стигат до извода, че липсват научни доказателства за определяне на горно ниво за консумация на захар.
В този документ за позиции се опитваме да дефинираме наученото през последните 10 години, на кои въпроси е даден еднозначен отговор и кои нови въпроси са възникнали. В този процес не направихме критичен, систематичен преглед на впечатляващата литература по темата, но основно се фокусирахме върху съответните мета-анализи и критични, систематични прегледи, публикувани между 2007 г. и февруари 2015 г.
Защо първоначално подозирахме, че FCCS са вредни за метаболитното здраве?
Ролята на FCCS в патогенезата на метаболитните заболявания първоначално се подкрепя от
Проучвания върху животни, извършвани главно при гризачи, но също и при други животински видове, включително примати, които не са хора, които показват, че добавянето на фруктоза или захароза към диетата може да доведе до развитие на затлъстяване, инсулинова резистентност, диабет тип 2, дислипидемия и понякога високо кръвно налягане [17, 18]. В повечето от тези проучвания животните, хранени с високо съдържание на захар, се използват като експериментален модел на затлъстяване или метаболитни заболявания и ефектите от високия прием на FCCS не са директно сравнени с други обезогенни диети с високо съдържание на мазнини, които произвеждат подобни дълготрайни термични метаболитни промени [19, 20]. Като такива, те недвусмислено показват, че захарта може да предизвика преяждане, затлъстяване и метаболитни заболявания при спонтанно хранени животни, но не успяват да докажат, че този ефект е свързан изключително с FCCS.
Малък брой проучвания при хора, показващи, че диетата с високо съдържание на фруктоза понякога се свързва с развитието на дислипидемия [21].
Епидемиологични данни, показващи връзките между приема на FCCS и телесното тегло или разпространението/честотата на метаболитни заболявания [7, 22–27].
Твърденията, че фруктозата може да бъде обезогенна поради своето склонност да стимулира de novo липогенезата [23–27] или може да предизвика неадекватно потискане на приема на храна, тъй като не увеличава секрецията на инсулин и сатетогенни хормони на червата [28, 29].
Какво е научено през последните 10 години?
През този период в научната литература бяха публикувани твърде много оригинални статии и рецензии, за да бъдат разгледани подробно всяка от тях тук. Оценката на въздействието на това голямо количество изследвания обаче може да бъде улеснена от няколко скорошни метаанализа и критични, систематични прегледи, които могат грубо да бъдат класифицирани в (а) епидемиологични проучвания, (б) клинични интервенционни проучвания и (в) контролирани механистични проучвания . Основните метаанализи, публикувани между 2007 г. и февруари 2015 г. [30–38, 39 •, 40–42, 43 ••, 44, 45, 46 ••, 47, 48 ••, 49 ••, 50–52] са изброени в таблица 1, заедно с вида на изследванията, включени в мета-анализа, основните му резултати и основните заключения на техните автори.
маса 1
Избрани мета-анализи и систематични прегледи, разглеждащи ефектите на съдържащите фруктоза калорични подсладители върху човешкото здраве
Епидемиологичните проучвания се основават на анализ на проспективни данни, налични от голяма кохорта субекти с множество диетични оценки във времето и няколко години проследяване на телесното тегло или честотата на метаболитни заболявания. Такива проучвания позволяват да се идентифицират статистически връзки между приема на храна при първоначална оценка или промени в диетата, наблюдавани между две диетични оценки и последващо здравословно състояние. Като такива те са изключително ценни за оценка на правдоподобността, че FCCS може да бъде свързан с метаболитни заболявания в реални ситуации [53]. Те обаче не позволяват идентифициране на причинно-следствената връзка между FCCS и здравето поради многото възможни объркващи фактори [54].
Епидемиологичните проспективни проучвания показват силна връзка между приема на FCCS и наддаването на телесно тегло [40, 55, 56 ••]. Повечето проучвания конкретно разглеждат ефектите от консумацията на подсладена захар (SSB), а връзката между консумацията на захар в твърди храни и затлъстяването е сравнително недостатъчно проучена. Резултатите показват, че консумацията на SSB е силно свързана с по-висок общ прием на енергия [57] и че или SSB, общата фруктоза, или общата консумация на FCCS е силно свързана с увеличаването на телесното тегло във времето. Те също така показват, че други диетични хранителни компоненти, главно пържени картофи, червено месо и преработено месо, също участват в увеличаването на телесното тегло [56 ••]. Освен това консумацията на FCCS е свързана и с честотата на дислипидемия, инсулинова резистентност и диабет тип 2 [58], с честота или рискови фактори за сърдечно-съдови заболявания [59–62], със сърдечно-съдова смъртност [63 •], с хронични бъбречни заболявания [39 •] и с хиперурикемия и подагра [64]. Силата на тези асоциации обикновено намалява, когато данните се коригират спрямо телесното тегло, което предполага, че те са поне отчасти вторични спрямо увеличената маса на телесните мазнини.
Какво може да се направи на този етап? Наличните досега епидемиологични данни са доста последователни и сочат към положителна връзка между потреблението на FCCS и развитието на затлъстяване. Асоциацията е особено стабилна за SSB. Освен това тези проучвания показват, че връзката между консумацията на SSB и телесното тегло се дължи до голяма степен на свързаността на SSB с увеличения общ енергиен прием [31, 48 ••].
Много клинични интервенционни проучвания са оценили ефектите от намаляването или увеличаването на приема на SSB при възрастни и деца. Тези изследвания са анализирани допълнително в много пълни мета-анализи [31, 48 ••]. Доказано е, че увеличената консумация на SSB води до значително увеличаване на теглото в сравнение с контрола както при възрастни, така и при деца, и този ефект се дължи основно на увеличения общ енергиен прием. Промените в телесното тегло, наблюдавани в някои от тези проучвания, обаче са много по-ниски от очакваното от кумулираната обща енергия от SSB [65 ••, 66 ••, 67, 68]. Намаляването на консумацията на SSB обикновено е свързано със значителна загуба на тегло и намален общ енергиен прием. И тук, в много опити, загубата на тегло беше далеч по-малка от очакваната въз основа на натрупания енергиен дефицит на SSB, което предполага или ниско съответствие с ограничението на SSB, или компенсаторно увеличение на общия енергиен прием. Намаляването на приема на SSB обаче е противоречиво ефективно при децата, най-вероятно поради ниското съответствие в този клас възраст [31, 48 ••].
Какво научихме от интервенционни опити? Първо, много опити са оценявали ефектите от добавянето на захар към диетата. Съвсем очаквано увеличаването на консумацията на захар е свързано с някакво наддаване на тегло. Ефектите от увеличаването на консумацията на захар не са сравнени с тези от увеличаване на нишестето или мазнините и следователно тези проучвания не успяват да покажат, че наддаването на тегло е свързано конкретно със захарта. Второ, повечето проучвания показват значително намаляване на телесното тегло, когато консумацията на SSB е намалена, което със сигурност показва, че намесата значително намалява общия енергиен прием. Въпреки че телесното тегло, отчетено в интервенционните и контролните рамена, е било статистически значимо, действителният ефект върху затлъстяването често е бил много нисък: в едно проучване ИТМ се е увеличил от 30,4 на 30,5 kg/m 2 при затлъстели юноши, които са заменили SSBs с вода и от 30,1 до 30,6 kg/m 2 в контролната група [66 ••]; в друго проучване телесното тегло не се е увеличило значително с 1,3% при юноши, получаващи SSBs в продължение на 6 месеца, в сравнение с 0,2 и 0,6% при тези, получаващи изкуствено подсладени газирани напитки или вода, съответно [69 •]. Това хвърля сериозно съмнение върху клиничната ефикасност само за намаляване на консумацията на SSB.
Контролираните механистични проучвания се състоят от краткосрочни интервенционни проучвания при избрани групи индивиди, най-често здрави субекти, субекти с наднормено тегло и затлъстяване или субекти с диабет тип 2. Експерименталните протоколи сравняват интервенционно рамо с диета с висок FCCS за контрол на оръжията, което може да бъде или диета за поддържане на теглото с ниско FCCS, или изокалорична диета с високо съдържание на глюкоза/нишесте/ниско съдържание на мазнини. Тези проучвания конкретно разглеждат възможните последици от високата FCCS и се опитват да идентифицират потенциалните механизми, които са в основата на ефектите от излишната FCCS. Като се имат предвид техните строго контролирани състояния, всяко механистично проучване има за цел да отговори на конкретен въпрос (напр. Какви са ефектите на изокалоричните количества захароза спрямо HFCS върху липидите в кръвта? Фруктозата по-липогенна ли е от изокалоричното количество глюкоза? Може ли излишъкът от фруктоза да влоши инсулиновата чувствителност ?). Резултатите от механистични проучвания само оценяват дали конкретна роля на FCCS е правдоподобна като работеща хипотеза. Те обаче не могат да преценят дали подобни ефекти са от значение за населението в условията на свободен живот.
Общият енергиен прием е важен объркващ фактор в тези проучвания. Проучвания, сравняващи излишния енергиен прием от FCCS с поддържане на теглото, диетите с ниско съдържание на FCCS постоянно показват, че излишъкът от консумация на енергия от FCCS може в рамките на няколко дни до няколко седмици да увеличи телесното тегло и запасите от телесни мазнини [70], да увеличи производството на чернодробна глюкоза [71], нарушават чернодробното потискане на производството на глюкоза от инсулин [71–73], увеличават концентрацията на триглицериди в кръвта на гладно и след хранене [29, 70, 74, 75], повишават концентрацията на мазнини в черния дроб [76 •] и водят до повишаване на кръвта концентрации на пикочна киселина [70, 77]. Две проучвания показват, че излишъкът от фруктоза може да увеличи висцералната мастна маса, докато излишъкът от глюкоза ще увеличи главно подкожните мазнини [70]. В едно от тези проучвания [70], индуцирано от фруктоза увеличение на висцералната мазнина се наблюдава само при мъжете, но не и при жените. Като цяло, тези механистични проучвания за съжаление не могат да сортират относителните роли на FCCS и енергоприема. В допълнение, много от тези проучвания оценяват ефектите на чиста фруктоза, а не на захароза или HFCS, и много от тях използват нива на дневен прием на FCCS значително над консумацията, наблюдавани в общата популация.
Хиперкалоричните FCCS диети последователно причиняват повишаване на концентрацията на триглицериди и пикочна киселина в кръвта, докато хиперкалоричните диети с високо съдържание на глюкоза или с високо съдържание на мазнини не. Един мета-анализ заключава, че приемът на високо съдържание на фруктоза е свързан с повишен триглицерид в кръвта само когато е свързан с излишен прием на енергия, но няма ефект, когато е част от диета за поддържане на теглото [34]. За разлика от това, друго проучване заключава, че хранителните захари влияят върху липидите в кръвта независимо от телесното тегло [49 ••]. Един мета-анализ специално разглежда въздействието на захарта върху холестерола в кръвта и съобщава, че неблагоприятните ефекти на захарите се наблюдават при дози над 100 g/ден [37].
Много разкази и статии предполагат, че инсулиновата резистентност е добре познат ефект на диетичната фруктоза [78–80]. Умерено увеличаване на производството на чернодробна глюкоза на гладно наистина се наблюдава в рамките на няколко дни при диета с високо съдържание на фруктоза, но не е свързано с клинично значимо повишаване на кръвната глюкоза. Изненадващо, всички проучвания, които действително оценяват чувствителността на мускулния инсулин чрез хиперинсулинемично-евгликемични скоби, не съобщават за никаква мускулна инсулинова резистентност при здрави индивиди след 1–4 седмици на диета с високо съдържание на фруктоза [71–73, 81] или при пациенти с диабет тип 2 след 3 месеца [82]. Това категорично предполага, че фруктозата сама по себе си, независимо от дългосрочните промени в теглото, не нарушава действията на инсулина в мускулите. Интересното е, че едно проучване наблюдава значителна мускулна инсулинова резистентност при потомци на средна възраст с наднормено тегло от пациенти с диабет тип 2 след 6 дни на диета с високо съдържание на фруктоза [83], докато друго подобно проучване, проведено при млади потомци с наднормено тегло от тип 2 диабет, не успя да документира промени [81]. Това поражда възможността ефектите на фруктозата да бъдат модулирани както от генетичен произход, така и от допълнителни фактори като възраст или телесна мастна маса.
Ефектът от интравенозното приложение на фруктоза върху производството на пикочна киселина и причиняването на хиперурикемия е отдавна известен [94]. Наскоро бяха направени интересни нови наблюдения, за да се свърже индуцираното от FCCS производство на пикочна киселина с метаболитни и сърдечно-съдови заболявания. Според тези нови хипотези пикочната киселина може да действа като медиатор за индуциране на дисфункция на ендотелните клетки, като по този начин предотвратява индуцираната от инсулин мускулна вазодилатация. Предполага се, че този ефект на пикочната киселина допринася за индуцирана от фруктоза инсулинова резистентност и високо кръвно налягане [95]. Едно изолирано клинично проучване подкрепя тази хипотеза, като показва, че краткосрочната хиперкалорична диета с високо съдържание на фруктоза повишава кръвното налягане и че този ефект е предотвратен чрез прилагане на инхибитора на синтеза на пикочна киселина алопуринол [77]. Това наблюдение обаче трябва да бъде смекчено от факта, че няколко други проучвания не успяват да наблюдават значителен ефект от диетата с високо съдържание на фруктоза върху кръвното налягане [45]. Освен съдови ефекти, пикочната киселина също е предложена за засилване на липогенезата и по този начин за допринасяне за дислипидемия и чернодробна стеатоза [96, 97, 98 ••]. Тези нови хипотези явно изискват допълнителна оценка и са необходими повече изследвания върху хора, за да се оцени тяхната клинична значимост.
Каква клинично значима информация предлагат тези механистични изследвания? Съществуват солидни доказателства, че диетата с високо съдържание на фруктоза може да увеличи триглицеридите в кръвта (TG) в рамките на няколко дни, да подобри съхранението на IHCL и да увеличи производството на ендогенна глюкоза. Тези промени са много значими, но с малки размери, а концентрацията на триглицериди и глюкоза в кръвта, както и съдържанието на вътрехепатални мазнини, обикновено остават в нормалните граници. Разбира се, те могат да бъдат ранни маркери на инсулиновата резистентност и да напредват с времето към развитието на метаболитни заболявания. Съществува обаче алтернативно обяснение, което досега е било пренебрегвано, т.е. че тези промени могат да отразяват простото адаптиране към диета с високо съдържание на фруктоза.
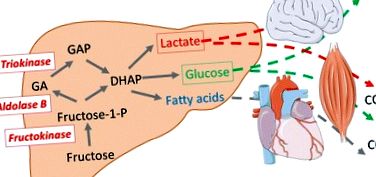
За разлика от глюкозата, която може да се използва като енергиен субстрат от всички човешки клетки, фруктозата не може да се метаболизира директно от повечето клетки поради много по-нисък афинитет на хексокиназите към фруктозата, отколкото към глюкозата. Вместо това, фруктозата първо се метаболизира в ограничен брой органи (черен дроб, лигавица на тънките черва, бъбреци). В тези органи той се метаболизира до триози-фосфат (ди-хидроксиацетон-фосфат и глицералдехид-3-фосфат) от набор от специфични ензими: фруктокиназа (кетохексокиназа), алдолаза В и триокиназа. Впоследствие триозите-фосфат могат допълнително да бъдат превърнати в повсеместни енергийни субстрати: лактат, глюкоза и мастни киселини (палмитат, олеат, стеарат, ...)
- Добавка към екдистероиди - ползи за здравето, дозировка, странични ефекти
- Глимепирид (амарил) - странични ефекти, взаимодействия, употреба, дозировка, предупреждения
- Коза; s Rue (Galega officinalis) - Употреби, ползи за здравето и терапевтични ефекти
- Ефекти от спирането на тютюнопушенето върху приема на калории и наддаването на тегло в стационарно отделение SpringerLink
- Capsicum Употреба, странични ефекти, дозировка, взаимодействия и ползи за здравето