Резюме
ВЪВЕДЕНИЕ
Ендоскопията на горната част на стомашно-чревния тракт (UGI) дава възможност на лекарите да оценят секретиращата способност на стомашната лигавица и риска от рак на стомаха въз основа на констатациите на фоновата стомашна лигавица (фиг. 1). За да се измери секретиращата способност на стомашните клетки на лигавицата, неинвазивните серологични тестове се предпочитат пред инвазивните ехографски тестове [1]. Неинвазивните тестове се състоят от анализ на серумен пепсиноген (PG), тест за дишане на калциев карбонат и тест за дишане с водород, докато инвазивните тестове се състоят от тестове за аспирация (тестове за пентагастрин и тетрагастрин), ендоскопски тест за гастрин и интрагастрални измервания на рН [2]. Напоследък серумният PG анализ стана предпочитан пред серумния гастринов анализ при измерване на състоянието на стомашната лигавица, тъй като гастринът се произвежда предимно от ендокринните G клетки на антрума [3,4]. Отрицателният PG анализ е показателен за здрава стомашна лигавица с отрицателна прогнозна стойност> 99% при използване на серумен PG I/II [5].
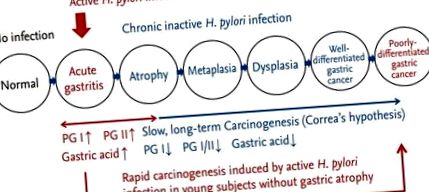
Ендоскопски находки на фоновата стомашна лигавица според пътя на стомашната канцерогенеза. При инфекция с Helicobacter pylori стомашната лигавица показва промени, показващи активна инфекция, като множество хеморагични петна, възли и удебеляване на стомашните руги. По време на този етап рискът от дифузен тип рак на стомаха се увеличава, интрагастралната среда става хиперацидна и има повишаване на серумните нива на пепсиноген (PG). Когато активното възпаление отшуми и инфекцията премине в хроничен стадий, фоновата стомашна лигавица показва атрофия и метаплазия. Този дългосрочен, бавен процес увеличава риска от рак на стомаха от чревен тип, интрагастралната среда става хипоацидна и има намаляване на серумните нива на PG.
UGI ендоскопията се извършва на всеки две години в Корея като национална система за скрининг за вторична профилактика на рак на стомаха при всички възрастни над 40 години. Въпреки това няма стандартизиран формат за докладване, използван за описване на констатациите на фонова стомашна лигавица, а ендоскопският гастрит често се подценява по време на процеса на скрининг. Тази прегледна статия се фокусира върху ендоскопските находки на фоновата стомашна лигавица във връзка с интрагастрални състояния, отразени от констатациите от серумния PG анализ.
ИНТАКТЕН СТОМАХ БЕЗ ИНФЕКЦИЯ
Способността за секреция на стомашна киселина и други стомашни хормони е непокътната при лица без инфекция с H. pylori. Фоновата стомашна лигавица показва редовно разположение на събиращите венули, когато субектът никога не е бил заразен с H. pylori (фиг. 2). При хиперацидни състояния могат да възникнат множество хиперемични ерозии или линейни ивици върху антралната част, което може да доведе до ерозивен гастрит (EG) или хроничен повърхностен гастрит (CSG).
(А) Ендоскопски находки при субекти без инфекция с Helicobacter pylori. Пепсиногенът (PG) I се произвежда изключително от главните клетки и слузните шийни клетки на очното дъно. PG II се секретира в стомаха, а също и от жлезата на Brunner’s на дванадесетопръстника. (B) Нормално ендоскопско откриване на ъгъла при неинфектиран обект. Редовното разположение на събиращите венули под ъгъла показва нормална стомашна лигавица. (C) Нормално откриване на корпуса при същия обект. Редовното разположение на събирателните венули се простира до кардията и очното дъно. (Г) Хроничен повърхностен гастрит. Няколко хиперемични ивици се забелязват от страната с по-голяма кривина на антрума. (Д) Ерозивен гастрит. Множество надигнати, хиперемични ерозии са видими на антралната част.
Хроничен повърхностен гастрит
CSG се характеризира с множество линейни ивици от страната на по-голямата кривина на антрума. CSG е най-често срещаният ендоскопски гастрит в Корея, последван от EG, хроничен атрофичен гастрит (CAG) и метапластичен гастрит (MG) [6]. Хиперемичните ивици, открити в CSG, не изискват последваща биопсия, тъй като те не са свързани с увеличаване на риска от рак на стомаха. CSG включва хиперацидни състояния. Секретиращата способност на стомашните лигавични клетки остава непокътната.
Ерозивен гастрит
EG се представя с множество повдигнати ерозии с хиперемични промени в антралната област. Ерозии могат да бъдат открити както при неинфектирани субекти, така и при субекти с активна инфекция с H. pylori (Таблица 1). При липса на инфекция с H. pylori честотата на рак на стомаха е ниска [7]. При EG интрагастралните състояния са хиперацидни и секретиращата способност на стомашните мукозни клетки остава непокътната.
маса 1.
Чести ендоскопски находки в ендемична област на инфекция с хеликобактер пилори
| Няма инфекция | Хроничен повърхностен гастрит | Няколко хиперемични ивици | Antrum, страна с по-голяма кривина | Цели | Нормоациден | Нормално |
| Няма корелация с инфекция | Ерозивен гастрит | Няколко хиперемични, повдигнати лезии | Antrum | Цели | Хиперациден | Нормално |
| Активна инфекция | Нодуларен гастрит | Множество малки и редовни субмукозни повишени лезии без промяна на цвета | Antrum се простира към корпуса | Цели | Хиперациден | Повишено ниво на серумен PG II |
| Хеморагични петна | Множество малки и правилни червеникави петна | Корпус (очно дъно и високо тяло) | Цели | Хиперациден | Повишено ниво на серумен PG II | |
| Хипертрофични стомашни руги | Няколко удебелени руги с едематозна промяна и белезникави, лепкави секрети | Корпус | Цели | Хиперациден | Повишено ниво на серумен PG II | |
| Хронична неактивна инфекция | Хроничен атрофичен гастрит | Видими прозрачни съдове | Antrum, по-малка кривина към корпуса, по-голяма кривина | Нарушено | Хипоациден | Намалено серумно ниво на PG I |
| Метапластичен гастрит | Множество големи и неправилни белезникави коти | Antrum се простира към корпуса | Нарушено | Хипоациден | Намалено серумно ниво на PG I |
Други гастрити, несвързани с инфекция с H. pylori
Ендоскопският гастрит при неинфектирани индивиди е рядко срещан с ендемични инфекции с H. pylori. Автоимунният гастрит тип А е първоначално асимптоматично заболяване, което прогресира до атрофия на корпуса с пернициозен аденом (дефицит на В12) или желязодефицитна анемия [8]. Грануломатозният гастрит е свързан с болестта на Crohn, туберкулоза, сифилис, саркоидоза, анисакиаза или реакция на чуждо тяло. Еозинофилният гастроентерит се проявява с неспецифични стомашно-чревни симптоми и може да обхване хранопровода или дебелото черво [9]. Други видове гастрит включват колагенен гастрит, пострадиационен гастрит и гастрит, свързан с наркотици.
СТОМАХ С АКТИВНА ИНФЕКЦИЯ НА H. PYLORI
Активна или остра инфекция с H. pylori може да бъде диагностицирана чрез биопсия на стомашната лигавица. Констатациите на патологията показват инфилтрации на мононуклеарни клетки и полиморфноядрени неутрофили. Поради липсата на единична ендоскопска находка, която да показва инфекция с H. pylori, често се използват серологични тестове за проверка на състоянието на стомашната лигавица.
Хеморагични петна, нодуларност и удебелени стомашни гънки
Типичните ендоскопски находки на остра инфекция с H. pylori включват хеморагични петна по очното дъно и/или високо тяло, нодуларен гастрит и хипертрофични стомашни руги (фиг. 3). Ендоскопските находки на нодуларен гастрит са малки, кръгли, жълтеникаво-бели възли, които представляват хистологични лимфоидни фоликули [10]. Ендоскопският нодуларен гастрит е по-често срещан в антрума, отколкото корпусът при инфекция с H. pylori.
(А) Ендоскопски находки при субекти с активна инфекция с Helicobacter pylori. (Б) Нодуларен гастрит от предната по-голяма страна на проксималния антрум. На антрума се виждат множество малки възли, простиращи се до по-голямата кривина на корпуса. Възлите се състоят от субмукозни повишени лезии и следователно няма промяна в цвета при нодуларен гастрит. (В) Последващи констатации на увеличени възли на проксималния антрум до ниско тяло при същия пациент. По-рано отбелязаните малки, редовни възли са се увеличили по размер. Възлите бяха неправилни и нараснаха от преди 12 месеца. (D) Намиране на хеморагични петна по очното дъно при пациент с нодуларен гастрит при първоначална ендоскопия (B). Множество малки червеникави петна, така нареченото дифузно зачервяване, могат да се видят на дъното и по-голямата кривина на корпуса. (E) Хипертрофични стомашни гънки. Удебелени стомашни руги с белезникави, лепкави ексудати показват активна инфекция с H. pylori. PG, пепсиноген.
Повишена секретираща способност на стомашните клетки на лигавицата
Секретиращата способност на стомашните лигавични клетки е все още непокътната по време на активна инфекция с H. pylori. Следователно, повишена секреция на PG или киселина може да възникне при стимулация или възпаление. Интрагастралните нива на pH корелират добре с плътността на H. pylori и тежестта на гастрита [11]. Индуцираният от H. pylori гастрит може да бъде идентифициран чрез серумни нива на PG, тъй като нивата на PG II са повишени и съотношението PG I/II е намалено при пациенти с инфекция с H. pylori в сравнение с тези без инфекция [12,13]. Известно е, че концентрацията на PG II в серума е по-полезна за прогнозиране на активна инфекция с H. pylori, отколкото концентрацията на PG I.
Повишен риск от дифузен тип рак на стомаха
Независимо от възрастта, нодуларният гастрит увеличава риска от рак на стомаха [14]. Въпреки че е известно, че серумният PG анализ е по-полезен за скрининг на рак на стомаха от чревен тип, отколкото дифузен тип рак на стомаха, високото ниво на PG II показва повишен риск от дифузен тип рак на стомаха [15-17]. Следователно ерадикацията на H. pylori е силно препоръчителна в този стадий на активна инфекция; изглежда, че клетъчните промени са обратими, преди стомашните клетки на лигавицата да прогресират отвъд точката на връщане [18,19].
СТОМАХ С ХРОНИЧНА НЕАКТИВНА ИНФЕКЦИЯ НА H. PYLORI
Хроничната инфекция показва неактивна инфекция с H. pylori, която води до атрофични промени със или без чревна метаплазия (IM). MG се забелязва, когато загубата на жлези при CAG еволюира в IM и CAG от отворен тип е силно корелирана с експресията на Cdx2 и MG [20]. Независимо от това, има ограничения за патологична оценка с помощта на стомашна биопсия в случаите на MG, тъй като е трудно да се определи оптимално място за биопсия, което да позволи оценка на целия стомах [21,22].
Намалена секретираща способност на стомашните клетки на лигавицата
Намалените серумни нива на PG I, CAG от отворен тип и старостта са предиктори за хипоацидно състояние по време на инфекция с H. pylori [23]. След като нормалните стомашни жлези бъдат заменени от необратима фиброза и ИМ, стомашната среда става хипоацидна. Поради тази причина гастроезофагеалният рефлукс (ГЕРБ) е рядък при пациенти с CAG и/или MG [24]. Усъвършенстваното ендоскопско класиране на атрофичния гастрит е обратно свързано с ГЕРБ.
Атрофия на стомашния корпус, отразена чрез серумен PG анализ
Атрофията на стомашния корпус се определя като серумно съотношение PG I/II от фиг. 4). Ендоскопията е надежден метод с висока възпроизводимост, за който е доказано, че предсказва хистологична атрофия в многонационално проучване [28]. Постановката на гастрит, така наречената оперативна връзка при оценката на гастрита (OLGA), предоставя информация за стомашната лигавица чрез интегриране на атрофичния резултат и топографията [29]. Съвсем наскоро срещата на Глобалния консенсус в Киото постигна глобален консенсус относно класификацията на хроничния гастрит [30]. Важно е да се разграничат ендоскопските находки въз основа на техните характеристики (фиг. 5).
Инфекциите, унищожени на обратим етап
Дългосрочно проследяващо проучване показва, че промените, индуцирани от лека CAG и CSG, са обратими, както при хистологични, така и при серологични находки [42]. Степента на възпаление и активност, както и инфилтрацията на лимфоиден фоликул намаляват след ликвидиране на H. pylori [43]. Серумът PG II е добър маркер за интрагастрални промени в околната среда преди и след ликвидиране на H. pylori [44].
За отбелязване е, че дори тежка стомашна атрофия и ИМ са обратими при някои пациенти [45]. Съобщава се, че някои случаи на MG и преобладаващ корпус гастрит с ниско серумно съотношение PG I/II са обратими [46,47]. Напротив, не са открити съществени промени в молекулярните промени, свързани с канцерогенезата, дори след ликвидиране на H. pylori [48].
Инфекциите, унищожени на необратим етап
Рискът от рак след ликвидиране зависи от степента на CAG преди ерадикацията и е силно корелиран със тежестта на атрофията на корпуса [49,50]. При пациенти с необратимо увреждане на стомашната лигавица серумните нива на PG I и съотношението PG I/II продължават да намаляват. Поради това е необходим периодичен ендоскопски скрининг [51]. Независимо от това, само 5% от пациентите с тежка CAG развиват рак на стомаха от чревен тип [52]. В Корея няма консенсус относно ролята на ликвидирането в превенцията на рак на стомаха [53-55], но за тези субекти се препоръчва ендоскопски скрининг, както е при корейските американци с известна CAG, IM или фамилна анамнеза за стомашна болест рак [56].
Спонтанна регресия на H. pylori
Спонтанната регресия настъпва в най-тежките, късни етапи на стомашна атрофия и/или ИМ, когато стомашната среда е негостоприемна за растежа на H. pylori [57]. При такива напреднали състояния серумният анти-Н. pylori имуноглобулин G (IgG) анализът се връща към отрицателна находка [58]. Това показва хипоацидност на стомаха и също така предоставя обосновка за измерване на серумните нива на PG като вторично средство за скрининг на рак на стомаха [59]. Пациентите с атрофия на стомашния корпус и ниска концентрация на H. pylori показват най-силно нарушена секреция на киселина и най-висок риск от рак на стомаха от чревен тип. Взети заедно, най-големият риск от рак на стомаха от чревен тип се открива при серонегативни субекти с минали инфекции и ниски съотношения на PG I/II [60-62].
ЗАКЛЮЧЕНИЯ
Благодарности
Тази работа беше подкрепена от Университета Конкук през 2016 г.
- Лечение на гастрит Лечение на гастроезофагеален рефлукс Хеликобактер Пилори Лечение Хадон
- Ефекти на ферментиралите продукти от ръжени трици върху инфекцията с Helicobacter Pylori (HP) и метаболитния риск
- Диетичен план за Helicobacter Pylori - здравословна диета за H
- Пушенето на цигари насърчава атрофичния гастрит при позитивни субекти на Helicobacter pylori SpringerLink
- Може ли Helicobacter Pylori да е основната причина за вашето дете; суетене яде