Общи положения
Ендогенна канабиноидна система
Ендогенната канабиноидна система включва канабиноидни рецептори, техните ендогенни лиганди (ендоканабиноиди) и ензими за техния синтез и разграждане. [13]
Съществуват два основни типа рецептори, свързани с ендоканабиноидната сигнална система: канабиноиден рецептор 1 (CB1) и 2 (CB2). И двата рецептора са 7-трансмембранни G-протеинови рецептори (GPCR), които инхибират натрупването на цикличен аденозин монофосфат в клетките. [14] [15] CB1 рецепторите присъстват в най-висока концентрация в мозъка, но могат да бъдат намерени и в периферията. CB2 рецепторите са разположени най-вече в имунната и хематопоетичната системи. [1] [14]
Ендоканабиноидите са ейкозаноиди, действащи като агонисти на канабиноидните рецептори и те се срещат естествено в тялото. [9] Процесите, свързани с канабиноидните рецептори, например участват в познанието; памет; тревожност; контрол на апетита; повръщане; двигателно поведение; сензорни, автономни, невроендокринни и имунни отговори; и възпалителни ефекти. [13] Има два добре характеризирани ендоканабиноида, разположени в мозъка и периферията. Първият идентифициран е анандамид (арахидоноил етаноламид), а вторият е 2-AG (2-арахидоноил глицерол). Допълнителните ендоканабиноиди включват виродамин (O-арахидоноил етаноламин), ноладин етер (2-арахидоноил глицерил етер) и NADA (N-арахидоноил допамин). [14]
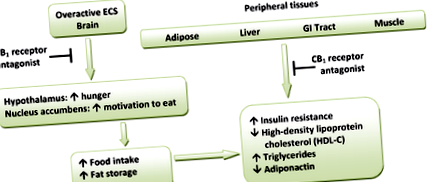
Хипотетичен модел за метаболитните ефекти на CB1 рецепторните антагонисти. (ECS = ендоканабиноидна система)
CB1 рецепторите се свързват чрез Gi/o протеини и инхибират аденилил циклазата и активират митоген-активиран протеин (MAP) киназа. В допълнение, CB1 рецепторите инхибират пресинаптичните N- и P/Q-тип калциеви канали и активират вътрешно коригиращите се калиеви канали. [4] [11] CB1 антагонистите произвеждат обратни канабимиметични ефекти, които са противоположни по посока на тези, произведени от агонистите за тези рецептори. [4] [16]
CB1 рецепторите са силно изразени в хипоталамусните зони, които участват в централния контрол на приема на храна и поведението при хранене. Това категорично показва, че канабиноидната система участва пряко в регулирането на храненето. Тези региони също са взаимосвързани с мезолимбичния допаминов път, така наречената система за възнаграждение. Следователно, CB1 антагонистите могат индиректно да инхибират медиираните от допамина наградни свойства на храната. [14] [16] Периферните CB1 рецептори са разположени в стомашно-чревния (GI) тракт, черния дроб и в мастната тъкан. В GI рецепторите CB1 са разположени на нервните терминали в червата. Ендоканабиноидите действат на CB1 рецепторите, за да увеличат глада и да насърчат храненето и се предполага, че те намаляват чревната перисталтика и изпразването на стомаха. По този начин антагонизмът към тези рецептори може да обърне тези ефекти. [14] Също така, в периферните тъкани антагонизмът на CB1 рецепторите увеличава инсулиновата чувствителност и окисляването на мастните киселини в мускулите и черния дроб. [1] Хипотетична схема за метаболитните ефекти на CB1 рецепторните антагонисти е показана на Фигура 1.
Първият подход за разработване на канабиноидни антагонисти в края на 80-те години беше модифицирането на структурата на THC, но резултатите бяха разочароващи. В началото на 90-те години беше открито ново семейство канабиноидни агонисти от НСПВС (нестероидно противовъзпалително) лекарство правадолин, което доведе до откриването на антагонисти на аминоалкил индол с известен, но ограничен успех. Тъй като търсенето, основано на структурата на агонистите, беше разочароващо, не беше изненада, че първият мощен и селективен канабиноиден антагонист принадлежи на изцяло ново химическо семейство. През 1994 г. първият селективен канабиноиден антагонист, SR141716 (римонабант), е въведен от Sanofibe, принадлежащ към семейство от 1,5-диарилпиразоли. [10] [17]
Римонабант
Rimonabant, известен също под систематичното име [н-(пиперидин-1-ил) -5- (4-хлорофенил) -1- (2,4-дихлорофенил) -4-метил-1З.-пиразол-3-карбоксамид хидрохлорид)], е 1,5-диарилпиразол CB1 рецепторен антагонист (Фигура 2). [17] Римонабант е не само мощен и високоселективен лиганд на CB1 рецептора, но също така е орално активен и антагонизира повечето от ефектите на канабиноидните агонисти, като THC, и двете инвитро и in vivo. Rimonabant показа ясна клинична ефикасност за лечение на затлъстяване. [18]
Свързването на агонистичен лиганд с CB1 рецептора провокира конформационна промяна и води до активното състояние на рецептора, което е отговорно за трансдукцията на сигнала. Съществува обаче допълнителен механизъм, който може да доведе до активното състояние при липса на лиганд. Както много други GPCR, CB1 рецепторът показва високо ниво на конститутивна активност и по този начин той може спонтанно да приеме активно конформационно състояние при липса на свързване с агонист, поддържайки повишени базови нива на вътреклетъчната сигнализация. [19] Това може да се обясни с двата модела на състояние на рецепторно активиране, при които рецепторите са в равновесие между две състояния, активно и неактивно (R * и R). Агонистът ще стабилизира активното състояние, което води до активиране, неутралният антагонист се свързва еднакво с активните и неактивните състояния, докато инверсният агонист ще стабилизира неактивното състояние (Фигура 3). [19]
Съобщава се, че в много случаи римонабантът се държи като инверсен агонист, а не като неутрален антагонист и е вероятно той да се свързва за предпочитане с неактивното състояние на CB1, като по този начин намалява активирането на сигналния път. [20] [21] Ключовото свързващо взаимодействие е водородна връзка, образувана между карбонилната група на римонабант и остатъка Lys192 на CB1 рецептора. Тази връзка стабилизира солевия мост Lys192-Asp366 на вътреклетъчния край на трансмембранните спирали 3 и 6 (Фигура 4). Този специфичен солен мост присъства в неактивно състояние на рецептора, но отсъства в активно състояние. [20] [21]
В неактивно състояние на CB1 римонабантът се свързва в трансмембранния-3-4-5-6 ароматен микродомен. Свързването на римонабант включва директни ароматни взаимодействия подреждане между неговия 2,4-дихлорофенилов пръстен и остатъците Trp279/Phe200/Trp356 от едната страна и ал-хлорофенилов пръстен и остатъците Tyr275/Trp255/Phe278 от другата страна. Липофилната пиперидинилова част се побира добре в кухина, образувана от аминокиселинните остатъци Val196/Phe170/Leu387 и Met384 (Фигура 4). [20] [18] [19] [22]
Повечето съобщени досега антагонисти на СВ1 са близки аналози или изостери на римонабант. [23] Общ модел на фармакофор за обратен агонист на CB1 може да бъде извлечен от общите характеристики на тези аналози, диарилпиразоли (Фигура 4). [20] Този фармакофор съдържа циклично ядро, С (напр. Пиразол в римонабант), заместено с две ароматни части, А и В. Единица за приемане на водородна връзка, D, свързва С с циклична липофилна част, Е. В някои случаи единица E директно се свързва с C. [20] [23] На фигура 4 като пример е използван римонабант. Единица А представлява 4-хлорофенилова група, а единица В 2,4-дихлорофенилов пръстен. Единица С е централният пиразолов пръстен и единица D представлява карбонилната група, която служи като акцептор на водородна връзка. Единица Е представлява липофилна аминопиперидинилова част. [20]
Оптималното свързване на CB1 рецептора изисква a ал-заместен фенилов пръстен в пиразолова 5-позиция. 5-заместителят на пиразола участва в разпознаването на рецепторите и антагонизма. The ал-заместител на фениловия пръстен може да бъде хлор, бром или йод, но е показано, че алкилова верига също може да бъде толерирана. [20] Номерирането на централния пиразолов пръстен е показано на Фигура 2.
2,4-дихлоро-заместен фенилов пръстен в пиразолово 1-положение се предпочита както за афинитет, така и за активност. Доказано е, че допълнителните халогени на този фенилов пръстен намаляват афинитета. [20]
Също така е благоприятно да има заместване на пръстена при 3-карбоксамидната група, като 1-пиперидинилната група в римонабант. [20] Замяната на аминопиперидинилния заместител с алкиламиди, етери, кетони, алкохоли или алкани води най-вече до намален афинитет. Замяната на пиперидинила с пентил или хептилна верига дава на съединенията агонистични свойства. Въз основа на тези резултати се стигна до заключението, че пиразоловата 3-позиция изглежда участва в агонизъм, докато 1-, 4-, 5-позициите изглежда участват в антагонизъм. [18]
Изследванията показват, че липсата на карбоксамиден кислород води до намален афинитет. Освен това, присъствието на карбоксамиден кислород допринася за придаване на свойствата на обратния агонист, докато аналозите, на които липсва този кислород, са неутрални антагонисти. Тези резултати подкрепят хипотезата, че карбоксамидният кислород образува водородна връзка с остатък Lys192 в рецептора CB1. [24]
Аналозите на SR141716 (римонабант) наскоро бяха описани от няколко групи, което води до добро разбиране на връзката структура-активност (SAR) в тази химическа група. Докато повечето описани съединения са по-малко мощни от SR141716, две от тях заслужават да бъдат споменати, SR147778 и AM251. [2]
SR147778 (суринабант), антагонист от второ поколение, има по-голяма продължителност на действие от римонабант и засилена орална активност. Тази засилена продължителност на действие вероятно се дължи на присъствието на по-метаболитно стабилната етилова група в 4-та позиция на нейния пиразолов пръстен. Друга промяна е заместването на 5-фенил хлорния заместител с бром. [2] [20] [25]
Описано е производното на диарилпиразол, AM251, където хлорният заместител е заменен с йод в ал положение на 5-фениловия пръстен. Това производно изглежда по-силно и селективно от римонабант. [11] [18]
Синтезирани са 21 аналога, притежаващи или алкил амид, или алкил хидразид с различни дължини в позиция 3. Беше забелязано, че афинитетът се увеличава с увеличаване на дължината на въглеродната верига до пет въглерода. Също така амидните аналози проявяват по-висок афинитет от аналозите на хидразид. Въпреки това, нито един от тези аналози не притежава значително по-голям афинитет от римонабант, но въпреки това те са малко по-селективни от римонабант за CB1 рецептора спрямо CB2 рецептора. [18]
Правени са няколко опита за увеличаване на афинитета на производни на диарилпиразол чрез втвърдяване на структурата на римонабант. По отношение на общия фармакофорен модел единиците A, B и/или C са свързани чрез допълнителни връзки, водещи до твърди молекули. Например кондензираният полицикличен пиразол NESS-0327 показва 5000 пъти повече афинитет към CB1 рецептора, отколкото римонабант. Това съединение обаче има лоша централна бионаличност. [20] [18]
Друго съединение, индазоловото производно О-1248, може да се разглежда като аналог на римонабант, където неговата 5-арилна група е слята с пиразоловата част. Тази структурна модификация обаче доведе до 67-кратно намаляване на афинитета на CB1 рецептора. [20]
Структурно различни от 1,5-диарилпиразолите са химическите серии на 3,4-диарилпиразолините. В тази серия е SLV-319 (ибипинабант), мощен CB1 антагонист, който е около 1000 пъти по-селективен за CB1 в сравнение с CB2 и показва in vivo активност, подобна на римонабант. [2] [20]
Друг подход, използван за разработване на аналози на римонабант, е заместването на централния пиразолов пръстен с друг хетероцикъл. Пример за този подход са 4,5-диарилимидазоли и 1,5-диарилпирол-3-карбоксамиди. [2]
Съобщава се за голям брой кондензирани бициклични производни на диарил-пиразол и имидазоли. Пример за това е пуриново производно, при което пиримидинов пръстен е слят с имидазолов пръстен. [2] Otenabant (CP-945,598) е пример за кондензиран бицикличен дериват, разработен от Pfizer. [26]
Няколко изследователски групи са изучавали шестчленни биоизостери от пръстен с пиразол. Например, за едно 2,3-диарилпиридиново производно е показано, че е мощен и селективен CB1 обратен агонист. Структурата на това съединение показва възможността амидната част на римонабанта да бъде разделена на липофилна (бензилокси) и полярна (нитрилна) функционалност. Други шестчленни пръстенни аналози са например пиримидини и пиразини. [2]
В допълнение към пет- и шестчленните аналози на пръстена има и други циклични производни като азетидините. Един пример е производното на метилсулфонамид азетидин, което има 1,1-диарилова група, която имитира 1,5-диарилната част на диарилпиразолите. Сулфонилната група служи като акцептор на водородна връзка. 1,1-диариловата група присъства и в производни като бензодиоксолите и хидантоините. [2] [20]
Съобщени са и ациклични аналози. Тези аналози съдържат 1,2-диарилов мотив, който съответства на 1,5-диариловите заместители на римонабант. [2] Пример за ацикличен аналог е таранабант (MK-0364), разработен от Merck. [26]
Представителите на тези аналози са обобщени в таблица 2.
Антителата на CB1 рецептора са разработени и въведени в клиничната употреба в Русия. [27] Те включват бризантин (на руски: Бризантин ®) и диетиса (на руски: Диетресса ®). [27] Brizantin е показан за лечение на отнемане на никотин и спиране на тютюнопушенето, а dietressa е показан за отслабване. [27] Dietressa се предлага без рецепта в Русия. [27] [1]
Rimonabant (Acomplia) е одобрен в Европейския съюз (ЕС) от юни 2006 г. за лечение на затлъстяване. На 23 октомври 2008 г. Европейската агенция по лекарствата (EMEA) препоръча спиране на разрешението за пускане на пазара в целия ЕС за Acomplia от Sanofi-Aventis въз основа на риска от сериозни психични разстройства. [28] На 5 ноември 2008 г. Sanofi-Aventis обяви прекратяване на програмата за клинично развитие на римонабант. [29]
Sanofi-Aventis също преустановява разработването на суринабант (SR147778), CB1 рецепторен антагонист за отказване от тютюнопушенето (31 октомври 2008 г.). [30]
Merck заяви в своето прессъобщение на 2 октомври 2008 г., че няма да търси регулаторно одобрение за таранабант (MK-0364) за лечение на затлъстяване и ще прекрати програмата си за клинично развитие фаза III. Данните от фаза III клинично изпитване показват, че по-голяма ефикасност и повече нежелани ефекти са свързани с по-високите дози таранабант и е установено, че общият профил на таранабант не подкрепя по-нататъшното развитие на затлъстяването. [31]
Друга фармацевтична компания, Pfizer, прекрати програмата за развитие на фаза III за своето съединение за затлъстяване отенабант (CP-945,598), селективен антагонист на CB1 рецептора. Според Pfizer тяхното решение се основава на променящи се регулаторни перспективи за профила риск/полза на класа CB1 и вероятно нови регулаторни изисквания за одобрение. [32]
Публикувани са редица инициативи за разработване на CB1 антагонисти, които са насочени само към периферни CB1 рецептори, като ограничават способността им да преминават през кръвно-мозъчната бариера. Сред тези инициативи 7 TM Pharma съобщава за развитието на TM38837. [ необходимо е цитиране ] Сега е публикуван преглед на подходите и съединенията, които се преследват като периферно ограничени CB1 рецепторни блокери. [33]
- Диференциално вътреклетъчно сигнализиране на подтипове на GalR1 и GalR2 Galanin Receptor Биохимия
- Отзиви на GlucaFix, анализиращи усъвършенстваните съставки на формула
- Ръководство за типове филтърни носители; Разширени концепции за аквариума
- GNC Лимонена киселина с висока ефективност Предимства Отслабване Ефекти на тялото Разширени отзиви за формула за отслабване
- Док, едва ли ям нищо и все още мога; t Отслабнете; Разширена средиземноморска диета