Даниела Д. Вебер
1 Изследователска програма за рецепторна биохимия и туморен метаболизъм, Университетска болница за педиатрия на Медицински университет Парацелз, 5020, Залцбург, Австрия
Сепиде Аминазде-Гохари
1 Изследователска програма за рецепторна биохимия и туморен метаболизъм, Университетска болница за педиатрия на Медицински университет Парацелз, 5020, Залцбург, Австрия
Барбара Кофлер
1 Изследователска програма за рецепторна биохимия и туморен метаболизъм, Университетска болница за педиатрия на Медицински университет Парацелз, 5020, Залцбург, Австрия
Кетогенната диета (KD), диета с високо съдържание на мазнини/ниско съдържание на въглехидрати/адекватни протеини, наскоро беше предложена като адювантна терапия при лечение на рак [1]. KDs са насочени към ефекта на Варбург, биохимичен феномен, при който раковите клетки използват предимно гликолиза, вместо окислително фосфорилиране, за да произведат АТФ. Освен това, някои видове рак нямат способността да метаболизират кетонни тела, поради митохондриална дисфункция и понижаване на регулацията на ензимите, необходими за използването на кетони [2]. По този начин, обосновката при осигуряването на богата на мазнини диета с ниско съдържание на въглехидрати в терапията на рака е да се намалят нивата на циркулиращата глюкоза и да се предизвика кетоза, така че раковите клетки да са лишени от енергия, докато нормалните клетки адаптират метаболизма си, за да използват кетонни тела и да оцелеят. Освен това, чрез намаляване на кръвната глюкоза също намаляват нивата на инсулин и инсулиноподобен растежен фактор, които са важни двигатели на пролиферацията на раковите клетки.
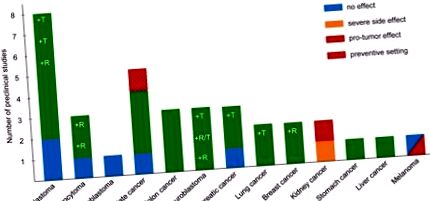
Многобройни предклинични проучвания са предоставили доказателства за антитуморен ефект на KD [1] (Фигура 1). Например, нашата лаборатория интензивно изследва антитуморния ефект на KD в комбинация със или без химиотерапия с ниски дози върху невробластом. Установихме, че растежът на ксенотрансплантатите на невробластом е значително намален от KD, състоящ се от съотношение 2: 1 мазнини към въглехидрати + протеин, когато се комбинира с калорично ограничение [2]. Въпреки това, ограничаването на калориите, въпреки антитуморния си ефект и потенциала да сенсибилизира раковите клетки към химиотерапия, би било противопоказано при редица пациенти с рак, особено тези с кахексия. По този начин се фокусирахме по-нататък върху оптимизирането на състава на KD за справяне с този проблем. Установихме, че ad libitum KD (8: 1) със съдържание на мазнини 25% триглицериди със средна верига и 75% триглицериди с дълга верига произвежда по-силен противотуморен ефект в сравнение с KD (8: 1) с всички верижни триглицериди и е толкова ефективен срещу невробластома, колкото описания по-горе KD (2: 1), комбиниран с калорично ограничение [3]. Тези резултати подчертават важността на оптимизиран състав на KD за потискане на растежа на тумора и за сенсибилизиране на туморите към химиотерапия, без да се налага ограничаване на калориите.
Предклинични доказателства, показващи ефекта на KD върху растежа и прогресията на тумора. Стълбовидната диаграма показва броя на предклиничните проучвания, които изследват ефекта на KD върху различни видове рак. Цветовете на лентите представляват резултата от всяко изследване, както е посочено в цветния бутон. Проучвания върху KD и рак са събрани чрез търсене на литература, обхващаща до края на 2017 г. R показва изследвания с KD с ограничен калории; T показва използването на KD като адювантна терапия към класическата терапия.
В допълнение към невробластома, различни изследователи са изследвали ефикасността на KD като адювантна терапия за други видове рак. Съобщава се за най-силните доказателства (> 3 проучвания) за туморен супресиращ ефект за глиобластом, докато за два други мозъчни тумора (астроцитом и медулобластом) е установена малка или никаква полза. Налични са добри доказателства (2-3 проучвания) за рак на простатата, дебелото черво, панкреаса и белия дроб [1]; невробластом също попада в тази категория (Фигура 1). Някои от тези проучвания съобщават за тумор-потискащ ефект само на KD и/или в комбинация с класическа терапия и/или ограничаване на калориите. Едно проучване за рак на простатата прилага KD в превантивна, вместо в терапевтична обстановка. Само ограничени доказателства (1 проучване) подкрепят антитуморния ефект на неограничен KD върху рака на гърдата, стомаха и черния дроб.
За разлика от безопасното приложение на KD, съобщени в различни модели на рак, нашата изследователска група наскоро съобщи, че мишки, носещи ксенотрансплантати на бъбречно-клетъчен карцином и с признаци на синдром на Stauffer са претърпели драстична загуба на тегло и чернодробна дисфункция, когато са лекувани с KD [4]. Друго проучване, изследващо ефекта от дългосрочното лечение на KD върху рак на бъбреците, описва протуморен ефект на KD в модел на плъх на туберкулозен склерозен комплекс [5]. Най-обезпокоително е наблюдението, че при миши модел на BRAF V600E-позитивен меланом растежът на тумора е значително увеличен при KD [6]. Освен това, проучването също така демонстрира, че кетонното тяло ацетоацетат стимулира онкогенната сигнализация на BRAF пътя. За разлика от това, KD няма ефект върху прогресията на NRAS Q61K-позитивен или ксенотрансплантати от меланом от див тип [6]. Независимо от тези наблюдения, в проучване за осъществимост, включващо ограничен брой пациенти с напреднали злокачествени заболявания, пациент с BRAF V600E-позитивен/BRAF-инхибиторен меланом изглежда имаше полза от KD [7].
Взети заедно, резултатите от предклинични проучвания, макар и понякога противоречиви, са склонни да поддържат антитуморен ефект, а не протуморен ефект на KD за повечето солидни видове рак. Въпреки това, въпреки че протуморните ефекти са редки, те не могат да бъдат изключени сами по себе си. Най-важното е, че наличните предклинични доказателства предполагат, че осъществимостта на KD като адювантна терапия на рака силно зависи от вида на тумора и неговите генетични промени.
Към днешна дата липсват доказателства от рандомизирани контролирани клинични проучвания, но са необходими, за да се отговори на въпроса дали адювант KD би бил от полза за конкретни пациенти с рак. Данните за хората, свързани с KD и рак, се базират най-вече на доклади за единични случаи и малко предварителни клинични проучвания с малки кохорти на проучването, хетерогенни планове за проучване, лошо спазване на диетата, несравними режими или без стандартизирани хранителни насоки. Въпреки това, резултатите от първите клинични проучвания подкрепят хипотезата за антитуморен ефект на KD. Например 10 от 24 (42%) клинични проучвания, включени в скорошен преглед [1], предоставят доказателства за антитуморния ефект на KD, докато седем (29%) не показват ефект и само едно проучване съобщава за протумор ефект на KD. Наличната в момента медицинска литература представя сериозни научни доказателства за безопасното приложение на KD само при пациенти с глиобластом. Въпреки това, ясна препоръка за адювантна употреба на KD при пациенти с глиобластом все още изисква резултати от текущи рандомизирани контролирани клинични проучвания.
В заключение, клиничното приложение на KD като адювантна терапия за пациенти с рак първо изисква KD да бъде оценен за неговия антитуморен ефект за всеки отделен тип/генетичен подтип рак в предклинична обстановка, тъй като безопасността и ефикасността на KD силно зависят от туморната същност и нейния генотип. Въз основа на резултатите от строгите предклинични и клинични проучвания, извършени досега, KD изглежда изглежда обещаващ и мощен вариант за адювантна терапия за редица ракови заболявания. Специфичните за рака препоръки очакват резултатите от рандомизирани контролирани клинични проучвания.
- Lacto-Ovo Vegetarian Diet Limited Evidence - Американски институт за изследване на рака
- Здравословно тегло, диета и оцеляване от рак на яйчниците - Американски институт за изследване на рака
- Как да проследявате резултатите от кетогенната диета - Перфектното кето
- Как може кето диетата да помогне за лечение на рак
- Колко типично кетогенният режим на диета се справя с излишните загуби на мазнини - кафяв; s Шофьорско училище