Марта Риера-Борул
2 Centro de Investigaciones Biológicas (CIB-CSIC), 28040 Мадрид, Испания
Анабел Гарсия-Ередия
Салвадор Фернандес-Аройо
3 Група за молекулярна онкология, Girona Biomedical Research Insitiute (IDIBGI), 17190 Жирона, Испания; gro.igbidi@sayuce (E.C.); gro.igbidi@zednenemj (J.A.M.)
Анна Хернандес-Агилера
Ноеми Кабре
Елизабет Куяс
3 Група за молекулярна онкология, Girona Biomedical Research Insitiute (IDIBGI), 17190 Жирона, Испания; gro.igbidi@sayuce (E.C.); gro.igbidi@zednenemj (J.A.M.)
4 ProCURE (Програма срещу терапевтична резистентност към рак), Група за метаболизъм и рак, Каталунски институт по онкология, 17190 Жирона, Испания
Федра Лучано-Матео
Jordi Camps
Хавиер А. Менендес
3 Група за молекулярна онкология, Girona Biomedical Research Insitiute (IDIBGI), 17190 Жирона, Испания; gro.igbidi@sayuce (E.C.); gro.igbidi@zednenemj (J.A.M.)
4 ProCURE (Програма срещу терапевтична резистентност към рак), Група за метаболизъм и рак, Каталунски институт по онкология, 17190 Жирона, Испания
Хорхе Йовен
5 Кампусът на международните постижения Южна Каталуния, 43003 Тарагона, Испания
Свързани данни
Резюме
1. Въведение
Съвременните високоенергийни и богати на мазнини диети, съчетани с ефекта от заседналия начин на живот, са тясно свързани с конвергентните епидемии от затлъстяване, инсулинова резистентност, диабет тип 2 (T2D) и безалкохолна мастна чернодробна болест (NAFLD). Тези съпътстващи метаболитни заболявания сериозно компрометират здравето и качеството на живот в световен мащаб [1]. Ефикасността на подходите за промяна на начина на живот е ниска и сериозно възпрепятствана от относително неизвестни клетъчни метаболитни стратегии и компенсаторни пътища, предизвикани от намаляване на приема на мазнини [2,3].
Начинът, по който действа метформин, не е напълно изяснен, но няколко реда доказателства предполагат критична роля в енергийната хомеостаза чрез сложна картина, която включва ефекта на хранителните вещества и молекулярните кръстосани връзки между метаболитните органи, особено черния дроб, червата и мастната тъкан [20,21] . Тук извършихме интегриран анализ на метаболитните фенотипове, възникващи при хранене на мишки експериментални диети със или без лечение с метформин, използвайки целенасочен метаболитен подход. Тествахме хипотезата, че едновременното лечение с метформин и простото обръщане на диетата може да подобри нарушенията, причинени от HFD.
2. Резултати
2.1. Ефекти върху регулирането на телесното тегло и приема на храна
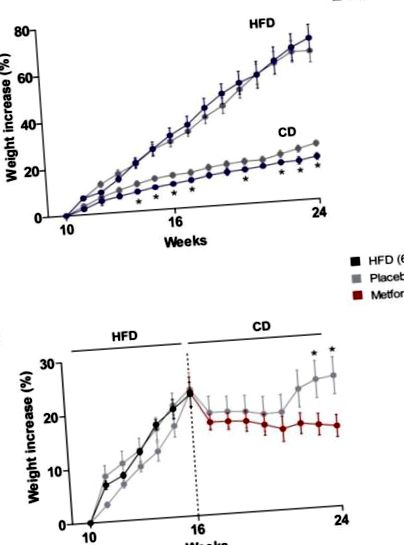
Мишките от групата на HFD са наддавали по-бързо от телата на диетата с чау (CD). Въпреки че лечението с метформин няма ефект върху регулирането на телесното тегло при мишки, предизвикани с HFD, това води до значително намаляване на наддаването на телесно тегло при мишки на CD от четвъртата седмица на експеримента до края на проследяването (24 седмици) (Фигура 1 А). Увеличаването на телесното тегло на HFD-хранени мишки намалява веднага след преминаване към CD. Забележително е, че прилагането на метформин е значително по-ефективно от CD самостоятелно за намаляване на наддаването на телесно тегло, особено след 6-7 седмици на диверсия, когато мишките, хранени само с CD, започват да възвръщат загубеното телесно тегло (Фигура 1 B).
2.3. Ефекти върху хиперлипидемията
Плазмените нива на холестерол и триглицериди са значително по-високи в HFD групата, отколкото в CD групата (Фигура 3 А). Лечението с метформин води до намаляване на концентрацията на общия серумен холестерол и на плътния липопротеин с ниска плътност (LDL) при животни, хранени със CD; ефект, който не се наблюдава при животни, хранени с HFD (Фигура 3 A, B). Индуцираните от метформин промени в нивата на LDL при CD-хранени мишки са придружени от значително намаляване на серумните концентрации на триглицериди и на триглицеридите във LDL фракцията (Фигура 3 A, B). Обръщането на диетата към CD премахна повишаването на циркулиращия холестерол, насърчавано от HFD хранене (Фигура 3 В). Всъщност разпределението на липопротеините при мишки, подложени на диверсионно обръщане със или без метформин, до голяма степен наподобява това, което обикновено се наблюдава при диви животни (т.е. почти целия холестерол във фракцията на липопротеините с висока плътност (HDL)) (Фигура 3 D). Прилагането на метформин насърчава по-нататъшно намаляване на циркулиращите нива на холестерол при мишки с промяна на диетата, както и статистически значимо намаляване на серумната концентрация на триглицериди (Фигура 3 С).
Индуцирани от диетата промени и ефектът на метформин върху плазмените липиди и разпределението на липопротеините. (A) Плазмени липиди и (Б.) разпределение на липопротеините, измерено с бързодействаща течна хроматография при мишки при хранене с експериментални диети в продължение на 14 седмици. CD, чау диета; HFD, диета с високо съдържание на мазнини; (° С,д) същите измервания при мишки след обръщане на диетата със или без метформин. Звездичките означават значими (* p Фигура 4 A, B). Прилагането на метформин значително намалява размера на адипоцитите, а също и относителното тегло на депото на eWAT при мишки, хранени със CD. За разлика от това, лечението с метформин допълнително увеличава площта на адипоцитите, а също и относителното тегло на бялата мастна тъкан (WAT) при животни, хранени с HFD (Фигура 4 В). Въпреки че лечението с метформин увеличава загубата на депото на WAT при животни, подложени на обръщане на диетата и води до значително намаляване на площта на адипоцитите, средният размер на адипоцитите остава по-голям от този на животните, лекувани само с дивертиране (Фигура 4 D).
Диетично предизвикани промени и ефектът на метформин върху чернодробния фенотип. Ефекти от диетата и метформин в определени часове по време на хранителните вариации. Представителни микрофотографии (100 ×) чернодробни секции, оцветени с H&E (A,Б.) и F4/80 имунохимия (° С,д) показва ефекта от диетата и метформин в стеатоза и делът на макрофагите; (Е.) ефектът на метформин в чернодробната концентрация на избрани цитокини при CD-хранени мишки. Легендите, както на фигура 1 и звездичките, означават значими (* p Фигура 5 В). Обръщането на диетата подобрява възпалението на черния дроб в групата с HFD, както се демонстрира от значителното намаляване на броя на F4/80 + възпалителни клетки (Фигура 5 D). За отбелязване е, че лечението с метформин на животни с обратен хранителен режим почти напълно елиминира наличието на F4/80 + макрофаги (Фигура 5 D), които също изглеждат увеличени; морфология, която може да подсказва за активирано състояние след HFD. Способността на метформин да намалява индуцираното от HFD хронично възпаление може да включва намаленото производство на прототипични противовъзпалителни цитокини, включително интерлевкин (IL) -1β и фактор на туморна некроза-α (TNFα), тъй като нивата на тези цитокини са значително намалени в метформин- лекувани мишки. Промените бяха сходни както при CD, така и при HFD режими. За по-голяма яснота на фигура 5 Д са показани само стойности, получени при мишки, хранени с CD, със или без метформин.
2.7. Ефекти върху нивата на енергийните метаболити в чернодробната и мастната тъкан
Излагането на мишки на HFD оказва влияние върху нивата на енергийните метаболити, което е различно при WAT и черния дроб. В WAT, HFD води до намаляване на нивата на гликолитични междинни продукти, близки до глюкозо-6-фосфата, като същевременно увеличава междинните съединения цитрат/изоцитрат и α-кетоглутарат. Обратно, HFD насърчава натрупването на гликолитични междинни продукти, близки до глюкозо-6-фосфата в черния дроб, т.е. тези междинни продукти, участващи в транспорта и фосфорилирането на глюкозата, като същевременно намалява аминокиселините с разклонена верига (BCAA) (Фигура 6).
Относителното въздействие на хранителните мазнини върху нивата на метаболитите, свързани с енергийния метаболизъм в мастната тъкан и черния дроб. Метаболитите са маркирани в зелено, червено или сиво, ако са били значително намалени, увеличени или неоткрити съответно според въздействието на HFD.
Диетично предизвикани промени и ефектът на метформин върху енергийните метаболити на бялата мастна тъкан (WAT). (A) Ефектът от двете диети е разделен, за да се подчертаят специфични промени в отговора на метформин; метаболитите са маркирани в зелено, червено или сиво, ако са били значително намалени, увеличени или неоткрити съответно; (Б.) частичен дискриминант с най-малък квадрат показва визуално ролята на измерените метаболити в различаването между различните експериментални групи; (° С) случайни гори са използвани за класиране на важността на метаболитите без надзор, за да се обясни диференциалният ефект на метформин; (д) стандартизирани концентрации на метаболит, представени като топлинна карта. Популациите на мишки с различни диети и лечение с метформин се отчитат като цветен код в горната част на графиката, докато имената на метаболитите са присвоени на редове.
Променени от диетата промени и ефектът на метформин върху метаболитите на чернодробната енергия. Описателните подробности са запазени, както е показано на фигура 7 .
3. Дискусия
Излагането на HFD причинява хронично възпаление в черния дроб, критичен фактор за развитието на свързана със затлъстяването непоносимост към глюкоза, инсулинова резистентност и прогресия на NAFLD [25]. Този ключов механистичен компонент на доживотния риск за развитие на метаболитни усложнения в отговор на енергийно претоварване се влияе от метформин. Мишките, лекувани с метформин и обръщане на диетата, показват подобрена защита срещу HFD-индуцирана чернодробна стеатоза, което е придружено от значително понижаване на чернодробно-инфилтриращите противовъзпалителни макрофаги, както и по-ниски нива на основните провъзпалителни цитокини. Способността на метформин да модулира поляризацията или миграцията на тези клетки наскоро беше демонстрирана в свързани с тумор макрофаги [26]. Бъдещите проучвания трябва да изследват дали метформинът допринася за намаляване на възпалението на чернодробната и мастната тъкан, като предотвратява или набирането, или провъзпалителното активиране на макрофаги (или и двете) [27].
Обръщането на диетата не успя да възстанови индуцираното от HFD чернодробно увреждане, освен ако не се комбинира с метформин. Метформин намалява потока на получените от глюкоза и глутамин CAC междинни продукти и изглежда преодолява чернодробната способност да съхранява и метаболизира въглехидратите, като по този начин по-добре предотвратява индуцираното от HFD увреждане на черния дроб при преминаване към нормална диета. Механизмите остават да бъдат напълно разбрани, но вероятно са свързани с известни ефекти върху биосинтетичната активност, зависима от митохондриите, и de novo липогенезата [28,29]. Следователно повишената CAC функция на митохондриите и увеличеният поток през анаболните пътища играят решаваща роля в патобиологията на мастната чернодробна и инсулинова резистентност, индуцирана от обезогенна диета [30,31]. Това проучване не предоставя ясни доказателства за това как метформинът и обръщането на диетата могат да споделят механизми, но предполага, че метформин може да облекчи възпалението и че адаптациите на митохондриите могат да бъдат изследвани като механизми на индуцирани от HFD чернодробни усложнения.
Въпреки че все още има противоречия относно механизмите на действие на метформин [35], техните подобряващи здравето ефекти се разглеждат до голяма степен като последица от способността му да насочва едновременно основните хранителни сензорни мрежи инсулин/IGF-1, към неклетъчните автономно ниво и AMPK/mTOR, на клетъчно-автономно ниво [7,36,37,38]. Като алтернатива, ние не отхвърляме първичните последствия надолу по веригата на един главен механизъм, който все още не е идентифициран. Намерихме стабилни модели, показващи потенциала на метформин да служи като модел съединение за предотвратяване на HFD-прогресиране на метаболитни усложнения. Клиничната комбинация от базирана на метформин фармакотерапия с диетична модификация може да възвести развитието на така необходимите терапевтични и превантивни стратегии срещу метаболитните последици от прекомерния прием на мазнини в храната.
4. Материали и методи
4.1. Животни, грижи за животните и хранителни подробности
4.2. Експериментален дизайн и предоставяне на метформин
Животните бяха разпределени в експериментални групи с помощта на компютърно генерирани графици за рандомизация, а изследователите, отговорни за оценката на резултатите, нямаха познания за експерименталната група, към която животните принадлежаха. От анализа не са изключени животни. Първо изследвахме отговора на метформин при мишки, хранени с оригиналния CD или HFD в продължение на 14 седмици. Мишките бяха разпределени в две диетични групи (n = 16, всяка) и допълнително разделени на мишки, получаващи метформин (Sigma, Мадрид, Испания) или плацебо (Monteloeder, Elche, Испания) всеки ден (n = 8, всяка). Мишките се умъртвяват на 24 седмици, използвайки инхалация на изофлуран. Ние продължихме по подобен начин в паралелни експерименти, за да изследваме отговора на метформин при мишки с неблагоприятен възпалителен и метаболитен статус, установен чрез хранене на животни с HFD в продължение на 6 седмици. За сравнителен анализ, някои животни (n = 6) бяха умъртвени по това време, а други котила бяха хранени с HFD или CD за други 8 седмици. Тези мишки, хранени с CD, се разделят, за да получат метформин или плацебо (n = 8, всеки), за да се оцени дали метформин засилва ефекта от преминаването към CD. Мишките се умъртвяват на 24 седмици след подобно време на гладно (4 часа с максимална разлика от 15 минути).
Използвахме метформин, разтворен в питейна вода (5 mg · ml -1), за да осигурим 250 mg · kg -1 ден на -1. Както беше описано по-рано, средните плазмени концентрации при мишки са подобни на тези, получени при хора с доза 1,25 g · ден -1 - [36]. Метформин не се натрупва в плазмата след продължително приложение. Изборът на този начин на приложение се основава на предварително публикувани данни [32,41]. В нашите ръце действието на метформин може да зависи от дозата и времето, тъй като се наблюдават небалансирани плазмени концентрации на метформин, когато метформин се дава чрез болус или чрез интраперитонеална инжекция. Не постигнахме достатъчна възпроизводимост при добавяне на метформин към диетите по време на производствения процес и лекарството се консумира предимно, но нередовно през нощта.
4.3. Вземане на проби, аналитични методи и хистологичен анализ
4.4. Целенасочена метаболомика
4.5. Статистически анализ
Всички резултати са показани като средната стойност ± SD, освен ако не е посочено друго. Разликите между групите се оценяват с U-теста на Mann-Withney (непараметричен) и се считат за статистически значими, когато p (110K, pdf)
Принос на автора
Хорхе Йовен и Хавиер А. Менендес са замислили и проектирали изследването. Марта Риера-Борул, Анабел Гарсия-Ередиа, Салвадор Фернандес-Аройо, Анна Ернандес-Агилера и Ноеми Кабре извършват експерименти и молекулярни анализи. Anabel García-Heredia, Elisabet Cuyàs и Fedra Luciano-Mateo извършиха имунохистохимични анализи. Марта Риера-Борул и Салвадор Фернандес-Аройо извършиха метаболомични анализи. Jordi Camps и Javier A. Menendez допринесоха с важни реактиви. Marta Riera-Borrull, Jordi Camps и Jorge Joven извършиха интерпретация на данни. Jordi Camps, Javier A. Menendez и Jorge Joven подготвят ръкописа, който е преработен и окончателно одобрен от всички автори.
Конфликт на интереси
Авторите не декларират конфликт на интереси.
- Диета на Metformin Trumps, Упражнение за трайно отслабване, Проучване открива ежедневното здраве
- Списък на лекарствата за хранителни добавки с фибри (6 сравнени)
- Домашни безглутенови здравословни десерти с рецепта от Тирамис с предимства
- Списък на лекарствата за хранителни добавки (207 в сравнение)
- Медицински доказателства за ползите за здравето от чая Kuding (Kuding Cha) Hello Tea Cup