Лео Пруимбум
1 Фондация Natura, Edisonstraat 66, 3281 NC Numansdorp, Холандия
2 Катедра по лабораторна медицина, Университетски медицински център Гронинген (UMCG), Университет в Гронинген, П.О. Каре 30.001, 9700 RB Гронинген, Холандия
Карин де Пундер
1 Фондация Natura, Edisonstraat 66, 3281 NC Numansdorp, Холандия
3 Институт по медицинска психология, Медицина на университета Шарите, Берлин, Hufelandweg 14, 10117 Берлин, Германия
Резюме
Съдържащите глутен зърнени храни са основна хранителна съставка, присъстваща в ежедневната диета на човека, включително пшеница, ечемик и ръж. Приемът на глутен е свързан с развитието на цьолиакия (CD) и свързаните с това разстройства като захарен диабет тип I, депресия и шизофрения. Досега обаче няма съгласие за възможните вредни ефекти от приема на глутен поради често отпадащи симптоми дори при хора с доказан CD. Асимптоматичният CD (ACD) присъства при повечето засегнати пациенти и се характеризира с липсата на класически признаци на непоносимост към глутен, като диария, подуване на корема и коремна болка. Въпреки това тези индивиди много често развиват заболявания, които могат да бъдат свързани с приема на глутен. Глутенът може да се разгради до няколко морфиноподобни вещества, наречени глутен екзорфини. Тези съединения имат доказан опиоиден ефект и могат да прикрият вредните ефекти на глутеновия протеин върху стомашно-чревната лигавица и функцията. Тук ние описваме предполагаем механизъм, обясняващ как глутенът може да „маскира” собствената си токсичност от екзорфини, които се произвеждат чрез смилането на протеини от глутен.
Заден план
Безсимптомна целиакия
CD обикновено се представя с редица типични признаци и симптоми на малабсорбция: диария, загуба на мускули и загуба на тегло. Други стомашно-чревни (GI) симптоми като коремна болка, подуване на корема и метеоризъм също са чести. Любопитното е, че голяма група пациенти, които са диагностицирани с CD чрез скрининг за CD-специфични антитела и дуоденална биопсия [3, 4], нямат тези класически симптоми, състояние, което също се нарича „безсимптомно CD“ (ACD). Много нарушения са налице при пациенти с АКД, включително захарен диабет тип I [5, 6], тежка хипогликемия при захарен диабет тип I [7], псориазис [8], сънна апнея при деца [9], неоплазия [10], атопичен дерматит [11], депресия [8], субклиничен синовит при деца [12], аутизъм [13], шизофрения [14] и синдром на раздразнените черва (IBS) [8], което предполага, че приемът на глутен е свързан с развитието на тези условия.
CD се характеризира с наличието на серумни антитела срещу тъканната трансглутаминаза
Глиадин се разгражда до колекция от полипептиди, наречени екзорфини в стомашно-чревния тракт
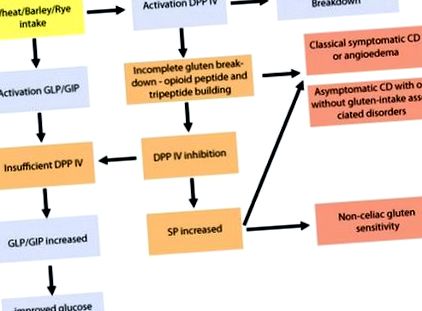
Разграждането на глиадин от пшеница се постига чрез хидролиза от чревния пепсин, левцин аминопептидаза и еластаза, което води до освобождаване на имунореактивни и подобни на опиоиди пептиди, включително глиадиноморфин-7 (Tyr-Pro-Gln-Pro-Gln-Pro- Phe) от α-глиадин [2]. По-нататъшното разграждане на тези пептиди, които са богати на пролин, зависи от ензима дипептидил пептидаза IV (DPP IV), способен да разцепва N-крайните дипептиди с пролин на второ (предпоследно) положение [29–31]. Останалият трипептид (в случая на глиадиноморфин-7) с пролин в центъра бавно се хидролизира и действа като селективен състезателен инхибитор за DPP IV [32–34].
Докато пълното разграждане на глиадин до изолирани аминокиселини предотвратява присъствието на глутеновите епитопи, за които е известно, че провокират провъзпалителен отговор на имунната система при генетично чувствителни хора [35, 36], евентуален дефицит/неактивност на DPP IV може да доведе до непълното разграждане на глутена и по този начин увеличават присъствието на имунореактивни и подобни на опиоиди пептиди, известни още като глутенови екзорфини [36–39]. Глутенът не е единственият източник на екзорфини. Млечните продукти и някои зеленчуци като соя и спанак също съдържат протеини, които могат да се превърнат в биоактивни екзорфини [40].
Глиадинът от глутен и казеинът от млечни продукти показват изненадващо висока субстратна специфичност за DPP IV в сравнение с други ендогенни субстрати DPP IV. Например DPP IV показва по-висок афинитет към глиадин и казеин, отколкото към вещество Р (SP) [41] и глюкагоноподобен пептид (GLP) [42]. Глиадин е силно специфичен за DPP IV [36], което се доказва допълнително от неговия свързващ афинитет с човешки DPP IV. Чрез използване на ензимно-свързан имуносорбентен анализ беше показано, че свързването на глиадин и казеин към DPP IV инхибира свързването на DPP IV с анти-DPP IV съответно с 52 и 44% [43]. Фактът, че глиадинът има висок афинитет към DPP IV, може да обясни защо толкова много пациенти с доказан CD са асимптоматични. Инхибирането на DPP IV от глиадин може да доведе до повишени нива на неметаболизирани глиадинови молекули с опиоидна активност, които могат да инхибират типичната коремна болка, свързана с класическия CD (Фиг. 1).
Развитието на симптоматични и асимптоматични CD и NCGS. Непълното разграждане на глутена води до инхибиране на DPP IV и евентуално увеличаване на SP, което води до чревни и извън чревни смущения, предизвикани от глутен. Полученото от глутен DPP IV инхибиране също увеличава присъствието на GIP и GLP в червата, което води до подобрена глюкозна хомеостаза
Опиоидните пътища могат да бъдат отговорни за развитието на ACD
Изненадващо е, че голяма група пациенти, положителни за наличие на CD антитела и с доказан хистологичен CD, не страдат от никакви стомашно-чревни симптоми. Ако опиоидните ефекти на самия глутен прикриват класическите симптоми на CD, тогава симптомите трябва да се провокират, когато пациентите получават налоксон, естествен антагонист на морфина.
Опиоидни ефекти върху чревното транзитно време
Изпразването на стомаха и чревният транзит се влияят от ендогенни и екзогенни опиоидни вещества. За дълго е известно, че морфинът увеличава стомашно-чревното транзитно време при хората и че това може да бъде обърнато от налоксон [44]. Ранните изследвания показват, че глутеновите екзорфини индуцират значително увеличение на времето за преминаване и този ефект е премахнат, когато се прилага налоксон [45]. По-ново проучване подкрепя тези ранни открития. В едноцентрово проучване Urgesi et al. [46] наблюдава, че пациентите, страдащи от CD, показват значително по-дълго време за преминаване през тънките черва. В дискусията авторите споменават различни пътища, обясняващи своите открития, но не споменават възможния ефект на опиоидите върху чревното транзитно време.
Екзорфините, получени от глутен, имитират ендогенна опиоидна активност
Стимулирането на производството на инсулин след прием на храна се счита за ендогенна опиоидна активност. Ранните изследвания при гризачи показват, че пероралното приложение на глутен екзорфин А5 стимулира производството на инсулин след прием на храна. Постпрандиалното повишаване на освобождаването на инсулин от глутенов екзорфин е напълно премахнато от опиоидния антагонист налоксон, което означава, че глутеновите екзорфини поддържат бионаличност за периферната нервна система в стомашно-чревния тракт и панкреатичните тъкани [47]. Повишени нива на циркулиращ пролактин се наблюдават при индивиди с диагноза CD [48]. Кратък период на безглутенова диета понижава нивата на пролактин при тези пациенти, което предполага, че глутенът (или получените от глутен вещества), подобно на ендогенните опиоиди, пряко влияе върху секрецията на пролактин. Това беше допълнително доказано от Fanciulli et al. [49]. При плъхове, чрез използване на опиоиден антагонист, неспособен да премине кръвно-мозъчната бариера (налоксон метобромид), интрацеребровентрикуларният (ICV) инжектиран глутен екзорфин стимулира освобождаването на пролактин чрез активиране на опиоидни рецептори, вероятно също извън мозъка.
Глутеновите екзорфини влияят на поведението и възприемането на болката
Неотдавнашен преглед на литературата стигна до заключението, че екзорфините, получени от храна, са биоактивни и засягат поведенческите черти като спонтанно поведение, памет и възприемане на болката при гризачи. Най-високото поведенческо влияние е измерено за екзорфини, получени от казеин и спанак (съответно, B-казоморфин и рубисколин) [50]. Само едно от прегледаните проучвания описва ефектите на глиадин екзорфините в този контекст. Такахаши и др. [51] показа, че прилаганият от ICV глиадин екзорфин А5 предизвиква антиноцицептивни ефекти и перорално доставяния глиадин екзорфин А5 модифицира поведението на учене и безпокойство по време на няколко лабораторни стресови фактора при мишки, като по този начин показва, че перорално доставените екзорфини могат да повлияят както на периферната, така и на централната нервна система и предполагат глутеновите екзорфини притежават опиоидна активност, която потенциално може да маскира симптомите при пациенти с ACD.
Освен обяснението на липсата на чревни симптоми чрез експресия на глутен ексорфин опиоиди при лица, страдащи от ACD, инхибирането на DPP IV от приема на глутен може да има много други последици за човешкото здраве. Известно е, че инхибирането на DPP IV има антидиабетни ефекти, но в същото време може да бъде отговорно за наличието на екстра-чревни симптоми и нарушения при ACD и появата на чревни и екстра-чревни симптоми и нарушения при CD и нецелиакален глутен чувствителност (NCGS) пациенти (описани по-долу).
DPP IV инхибиране чрез прием на глутен
Блокирането на DPP IV от глиадинови пептиди подобрява глюкозната хомеостаза
Блокирането на DPP IV от глиадинови пептиди предизвиква чревни и извън чревни разстройства
Инхибирането на DPP IV увеличава развитието на ангиоедем
Глиадиновите пептиди могат да причинят анатомични промени на нивото на мозъка
Заключения
Точният път, водещ до развитието на ACD, все още трябва да бъде открит. Предполагаемият механизъм, представен в този преглед, обаче може да обясни това натрапващо се явление. Непълното разграждане на глутеновия протеин, което води до наличието на глиадинови пептиди с опиоидни ефекти, прави правдоподобното предположение, че опиоидните ефекти на глутеновите екзорфини могат да бъдат отговорни за липсата на класически стомашно-чревни симптоми на лица, страдащи от свързан с приема на глутен заболявания. Освен това, частичното смилане на глутена, което води до инхибиране на DPP IV, може също да отчете наличието на извън чревни симптоми и нарушения при ACD и появата на чревни и извън чревни симптоми и нарушения при пациенти с CD и NCGS. Ако е така, тогава хората, страдащи от някое от тези състояния, трябва да бъдат разпознати навреме и да се включат в безглутенов начин на живот, за да предотвратят индуцирани от глутен симптоми и нарушения.
Бележки под линия
Конкуриращи се интереси
Авторите не декларират конфликт на интереси.
Принос на авторите
LP пише първия ръкопис въз основа на обширен преглед на литературата. KP ревизира ръкописа и добавя няколко раздела към ръкописа, включително фигурата. Окончателният ръкопис е преработен и приет от двамата автори. И двамата автори прочетоха и одобриха окончателния ръкопис.
- На момичето, което искаше да има целиакия, за да може; Кльощава като мен
- Torsemide странични ефекти, дозировка, употреба и др
- Най-добрите пайове с ниско съдържание на въглехидрати - вкусни и без глутен - диетичен лекар
- Какви храни трябва да избягвате, ако имате киселини, гастроезофагеална рефлуксна болест (ГЕРБ) или
- Страничните ефекти от консумирането на юфка Maggi