Тардивните дискинезии (TD) са постоянни и често необратими неволеви движения, които се появяват след продължителна невролептична терапия (Sethi, 2004).
Свързани термини:
- Клозапин
- Паркинсонизъм
- Типичен антипсихотик
- Дискинезия
- Стереотипно разстройство на движението
- Дистония
- Допамин
Изтеглете като PDF
За тази страница
Патофизиология, фармакология и биохимия на дискинезията
Diederik E. Tenback, Peter N. van Harten, в International Review of Neurobiology, 2011
IV Заключение
TD при диагностично смесени популации, лекувани с допаминови блокери, може да се различава от спонтанната дискинезия при нелекувани с антипсихотични пациенти с шизофрения. Честотата на TD в ерата на SGA с по-нисък афинитет към допаминовия D2 рецептор изглежда като цяло по-ниска, но остава клинична загриженост, особено тъй като може да е свързана с по-лош клиничен резултат.
Процентът на разпространение на TD остава висок, дори при пациенти, които не са били антипсихотици и има индикация, че превключването на допаминовите блокери с висок афинитет към допаминовия D2 рецептор към блокери с по-нисък афинитет към D2 рецептора може да подобри симптомите на TD. Не е ясно дали това също подобрява клиничния резултат.
Съществува голямо количество литература за рисковите фактори за ТД. Има обаче малко „твърди“ рискови фактори. Възрастта, ранният EPS и етническата принадлежност са вероятни рискови фактори за TD. Има някои обещаващи гени, които показват връзка с TD. Тези гени са или свързани с повишена доза, свързана с нарушен метаболизъм, или свързани с хипотези по отношение на патофизиологичната основа на TD. Трябва да се прояви известна предпазливост, тъй като това са асоциации с напречно сечение, съобщени в литературата и не правят разлика в сместа между появата и персистирането на TD.
TD остава интересна област за клиницистите и научните изследвания, особено в психиатрията, където е един от малкото симптоми, които могат да бъдат измерени обективно.
Тардивна дискинезия и други свързани с наркотиците нарушения на движението
Естествена история и епидемиология
TD е променлива болест, но богатството от данни предполага, че нейната естествена история може да бъде повлияна от благоразумно управление на невролептиците. TD може да ремитира, когато невролептиците се прекратят незабавно след поставяне на диагнозата, или TD може да отслабне с намаляване на дозата на невролептиците, често по-възможна алтернатива в клиничните условия. При дългосрочни проучвания вероятността от клинично подобрение на ТД корелира с продължителността на прекъсването на приема на лекарството или, алтернативно, с продължителността на проследяването. Проучванията, изследващи резултата след повече от 5 години, показват най-голям брой с клинично подобрение. Въпреки тези оптимистични възгледи, някои случаи на ТД продължават безкрайно и могат да се влошат с течение на времето.
През 80-те години беше общоприето, че разпространението на TD е от порядъка на 20% сред психиатричните пациенти. Gardos и Cole изчисляват, че рискът от развитие на TD за шизофреничен пациент, лекуван с невролептици в продължение на 1 непрекъсната година, е приблизително 5%. Kane et al. са цитирали кумулативна честота от 20% след 4 години лечение (приблизително 5% годишно, в съгласие с Gardos и Cole).
Съвсем наскоро вниманието се насочи към въпросите за вероятността от развитие на ТД по време на лечение с един от четирите одобрени от FDA атипични антипсихотици: клозапин, рисперидон, оланзапин и кветиапин. Кейн проследява 28 пациенти, които са получавали клозапин в продължение на поне 1 година. Двама пациенти, и двамата преди които са приемали типични невролептици, изглежда развиват лека TD на клозапин. Проспективно проучване на 122 възрастни, лекувани с рисперидон и халоперидол (61 във всяка група), стигна до заключението, че рискът от ТД е значително по-малък при рисперидон; е използван анализ на таблицата на живота въз основа на 9-месечен период на наблюдение. В голямо, двойно-сляпо, проспективно проучване, сравняващо 1 година лечение с оланзапин и лечение с халоперидол, рискът от TD в групата на оланзапин е бил една десета от групата на халоперидол и е изчислено, че годишният риск от TD по време на лечението с оланзапин е по-малък от 1%. Публикуван е доклад за случая на TD по време на лечението с кветиапин, но в момента няма систематични данни. В обобщение, TD все още може да възникне по време на лечение с атипични антипсихотици, но вероятността изглежда значително по-малка, отколкото е съобщено за типичните антипсихотици.
Нарушения на движението, предизвикани от наркотици
ЖОЗЕФ Х. ФРИДМАН, ХУБЕРТ Х. ФЕРНАНДЕЗ, в Животински модели на нарушения на движението, 2005 г.
А. Класическа тардивна дискинезия
TD е описан за първи път в рамките на 5 години след като първият DRBA, хлорпромазин, става широко достъпен през 50-те години [71]. Терминът тардивна дискинезия е въведен за първи път през 1964 г. от Faurbye et al. които подчертават, че честотата на TD се увеличава с хронична експозиция [72]. Класическият TD е използван за обозначаване на TD, който се представя с бързи, повтарящи се, стереотипни движения, включващи устната, букалната и езиковата области. Също така е наречена ритмична хорея и тардивна стереотипия поради своята повтаряща се, а не случайна природа [73].
TD е резултат от хронично излагане на DRBA, лекарства, използвани главно за лечение на психоза. TD не се съобщава при допаминови източници (като резерпин) и нечесто се съобщава при атипични антипсихотични лекарства. Някои лекарства за гадене (напр. Метоклопрамид или прохлорперазин) и депресия (напр. Амоксапин) всъщност са DRBA и следователно могат да причинят TD (Таблица 3).
ТАБЛИЦА 3. Наркотиците, за които се съобщава, че причиняват тардивни синдроми
Амоксапин (трицикличен антидепресант)
Цинаризин (блокер на калциевите канали)
Флунаризин (блокер на калциевите канали)
TD-подобни движения, възникващи при никога не лекувани шизофреници, повдигат въпроса дали TD се приписва единствено на DRBA или е проява на шизофрения [75, 76], вероятно демаскирана от DRBA. Основните опасения за последната алтернативна хипотеза са точността на докладите за експозиция без невролептици и точността на диагнозата TD. Без демонстрации на видеокасети би било трудно да се определи дали това всъщност са случаи на оромандибуларна дистония, беззъба дискинезия, болест на Хънтингтън, стереотипи и др. Тази хипотеза също не обяснява TD, възникваща при непсихотични лица, изложени на DRBA, като метоклопрамид или прохлорперазин, използвани за гадене.
Честотата и честотата на разпространение на TD варират в широки граници в зависимост от популацията, дизайна на изследването и използваните диагностични критерии. Годишните нива на заболеваемост варират от 5% при по-младото население (средна възраст, 28 години) [77] до 12% при по-възрастната група (средна възраст, 56 години) [78]. В конвенционалната антипсихотична ера поне 20% от пациентите, лекувани с невролептици, са били засегнати от TD, а приблизително 5% развиват TD с всяка година невролептично лечение [79]. Въпреки това, след 5 години разпространението остава стабилно, тъй като процентите на ремисия балансират честотата на заболеваемост [80].
През последните 2 десетилетия настъпиха големи промени в управлението на шизофренията, с преминаване към амбулаторни грижи в общността и използването на атипични антипсихотични средства, които уж предизвикват по-малко екстрапирамидни странични ефекти. Въпреки това, проучване за разпространението на двигателните разстройства сред всички шизофреници в Нитсдейл, Шотландия, през 1999–2000 г. установява, че от 136 пациенти разпространението на TD е 43%, това на паркинсонизма е 35%, а това на акатизията е 15% [81]. Петдесет и два процента от пациентите, за които е установено, че имат TD, са получавали само атипични антипсихотични средства; много от тях обаче са били на невролептици преди това. По този начин, въпреки въвеждането на атипични антипсихотични средства, TD продължава да бъде проблем.
Възрастта е най-постоянният рисков фактор за ТД. По-висока честота и по-ниски нива на ремисия се отбелязват при по-възрастните пациенти, особено сред жените [77, 82, 83]. Други предполагаеми рискови фактори включват афективни разстройства, лоша реакция на лечение, предишно мозъчно увреждане, по-голяма обща експозиция на лекарства, съществуващ паркинсонизъм и алкохолизъм [84, 85]. Фактори като продължителността на лекарството, вида на невролептичния агент и интервалите без лекарства са трудни за корелация поради сложната естествена история на TD и трудността на точния запис на лекарството.
Естествената история на TD не е лесно да се определи, тъй като DRBA, които причиняват TD, също са склонни да я потискат. Изследванията показват, че естественият ход на TD може да продължи [86], да се подобри обикновено [87, 88] или да има непредсказуем курс [89]. Променливата продължителност на проследяването и разликите в изследваните популации могат да обяснят променливостта в курса на TD [90]. Изследвания, включващи субекти със и без TD на изходно ниво, показват увеличение на средните резултати от оценката на TD, тъй като броят на новите случаи на TD надвишава подобрението на TD сред вече засегнатите при първата оценка. Повечето проучвания, включващи само субекти с TD на изходно ниво, показват, че TD обикновено се подобрява или намалява. Едно проучване, което изследва 53 психиатрични пациенти на високи дози, дългосрочни невролептици, преоценени след 14 години, показва средно 4,0 точки подобрение в резултата на AIMS. Тридесет и трима от 53 пациенти са имали пълно разрешаване на TD. Въпреки това, имаше значително влошаване на паркинсонизма, със средно 3,5 точки увеличение в рейтинговата скала за екстрапирамидни признаци, което предполага, че TD е маскиран [91].
Въпреки че има доказателства при животински модели, че хроничната блокада на допаминовите рецептори води до повишена рецепторна чувствителност [92, 93], проучвания при хора никога не са открили това.
Най-интересните и последователни констатации по отношение на генни проучвания на TD са фокусирани върху гена на допамин D3 рецептор (DRD3). Няколко групи съобщават за връзка между полиморфизма на серин към глицин в екзон 1 на гена DRD3 и TD. По-конкретно, всяка група установява, че генотипът глицин/глицин или глициновият алел създават повишен риск за TD в сравнение със серин/серинови хомозиготи. Едно проучване установи висока честота на този тип хомозиготност (22–24%) сред пациентите с ТД в сравнение с относителното недостатъчно представяне (4–6%) на този генотип при пациенти без ТД [94]. Това може да е обяснение за чувствителността към развитие на ТД при някои пациенти.
Ефектът на DRBA може да не бъде ограничен до допаминергичната система. Други невротрансмитери, като GABA и норадреналин, са замесени. Оксирадикалите също са замесени [95, 96]. Това се основава на концепцията, че DRBAs причиняват увеличаване на допаминовия оборот, което води до повишен синтез на водороден прекис, който образува оксирадикали, които увреждат клетъчните компоненти.
Единственият начин да се предотврати TD е да се избегнат нейните етиологични агенти. DRBA не трябва да се използва при непсихотични разстройства като тревожност. Дългосрочната употреба на DRBA трябва да бъде ограничена, доколкото е възможно. Пациентите трябва да бъдат предупредени за риска от TD синдром, преди да бъдат поставени на лекарството за поддържащо лечение над 3 месеца. Необходимостта от невролептична терапия трябва да се преразглежда периодично дали има признаци на TD или не. Той трябва да се поддържа на най-ниското ниво, необходимо за постигане на желания ефект, и да се оттегли при първа възможност. Сред атипичните антипсихотици клозапин, оланзапин и кветиапин имат най-ниска отчетена честота на TD и като цяло не е убедително съобщено, че причинява TD сред пациенти, които никога не са били изложени на други невролептици. Няма налични дългосрочни епидемиологични данни за употребата на по-нови атипични лекарства, като зипразидон и арипипразол.
Патофизиология, фармакология и биохимия на дискинезията
Д-р Питър Н. ван Хартен, д-р Diederik E. Tenback, в Международен преглед по невробиология, 2011 г.
D Лечение с холинергични медикаменти
TD може да включва централен холинергичен дефицит. Следователно са използвани холинергични лекарства (ареколин, холин, деанол, лецитин, меклофеноксат, физостигмин, RS 86, такрин, метокситакрин, галантамин, ипидакрин, донепезил, ривастигмин, ептастигмин, метрифонат, ксаномелин, цевимелин TD). Нито един от РКИ с холинергични лекарства не е показал значително благоприятен ефект върху TD. Въпреки това размерът на извадката в повечето проучвания е малък (5–20) и новите холинергични лекарства за Алцхаймер все още не са тествани (Tammenmaa et al., 2004).
Мозъчна стимулация
Дълбока мозъчна стимулация при тардивна дискинезия
Тардивната дискинезия (TD) е хронично хиперкинетично разстройство, което рядко може да последва приложението на допаминоблокиращи лекарства. Най-често засяга орофациалната мускулатура. Неотдавнашно многоцентрово, сляпо проучване на двустранен палидален DBS при 10 пациенти с резистентна към лекарства TD показа по-голямо от 50% намаление на неволевите движения, както по скалата за оценка на екстрапирамидните симптоми (ESRS), така и по скалата на ненормалните неволни движения (AIMS), при 6 месеца след имплантацията (Damier et al., 2007). Това проучване като цяло потвърждава обещаващи резултати от по-ранни доклади (Eltahawy et al., 2004; Schrader et al., 2004). По този начин палидалната стимулация може да се разглежда като вариант за лечение на пациенти с тежка, продължителна TD. Други DBS цели за TD не са проучени.
Екстракти от гинко билоба при терапия на неврологични разстройства
Тардивна дискинезия
Патофизиология, фармакология и биохимия на дискинезията
Въведение
Тардивната дискинезия (TD) е сериозен неблагоприятен страничен ефект, който понякога се среща от пациенти с шизофрения, които се лекуват с антипсихотични лекарства. Въпреки че честотата на разпространение е трудна за оценка и според съобщенията се различава между отделните проучвания, мета-анализ, включващ 39 187 пациенти от 76 проучвания, установява общо разпространение от 24,2% (Yassa and Jeste, 1992). Най-типичният признак на ТД е неволна орофациална дискинезия, но багажникът и крайниците също могат да бъдат засегнати. TD обикновено се причинява от антипсихотици и особено от първо поколение антипсихотици (FGA), но понякога и от второ поколение антипсихотици (SGA). Въпреки че много SGA са разработени и все по-често се използват, FGAs все още се предписват широко поради фактори като липсата на някакви значителни разлики в ефикасността на двете поколения антипсихотици (Lieberman, 2007), страничните ефекти на SGA (като метаболитен синдром) и по-ниските разходи за придобиване на FGA.
Причините за TD се считат за многофакторни; предложени са многобройни демографски причини, включително възраст, пол, дозировка, етническа принадлежност и продължителност на излагане на антипсихотици, както и няколко патофизиологични причини, нито една от които не се счита за категорична. Предложени са няколко биологични механизма, лежащи в основата на патофизиологията на TD, включително свръхчувствителност на допаминовите рецептори (Tarsy и Baldessarini, 1977), серотонергична дисфункция (Meltzer, 1994), недостатъчност на у-аминомаслена киселина (GABA) (Casey et al., 1980) и нарушения на антиоксидантната защита (Andreassen и Jorgensen, 2000). Патофизиологията на TD обаче остава слабо разбрана.
Много изследвания са предоставили доказателства, че TD включва генетични и фамилни причини. По-конкретно, беше установено, че TD се среща само при някои пациенти, приемащи антипсихотици, и че такива прояви включват фамилна тенденция, като по този начин се посочва биологичен или генетичен фактор (Tamminga et al., 1990; Yassa and Ananth, 1981). Този фон е подтикнал много генетични изследвания на TD, които включват основно фармакогенетични изследвания на антипсихотици. Друга причина, поради която много проучвания са изследвали фармакогенетиката на TD, е, че TD е видът страничен ефект, който е потенциално необратим и е много трудно да се предскаже кой ще повлияе. Освен това TD причинява на пациентите сериозен дистрес и води до неспазване на фармакотерапията. Изясняването на подробностите за генетичната чувствителност към този страничен ефект би направило възможно предписването след генотипизиране и прогнозиране, ръководено от биомаркер (Ozdemir et al., 2006). В бъдеще може да стане възможно да се изчисли вероятността от развитие на TD, като се вземе предвид наличието на някои свързани променливи (т.е. гени и демографски параметри). Освен това, фармакогенетичното проучване на TD ще допринесе за откриването на генетичния механизъм, лежащ в основата на анормални дискинетични движения и нарушения на движението.
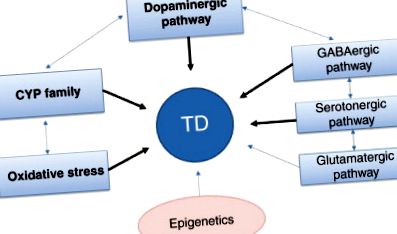
Кандидат-гените, за които се смята, че определят чувствителността към TD, са цитохром P450 (CYP), разнообразен невротрансмитер и гени, свързани с оксидативен стрес. Лекарственият отговор е много тясно свързан с лекарствения метаболизъм и CYP гените са изследвани задълбочено. В допълнение, гените, свързани с невротрансмитерите, и особено тези, свързани с допамин и серотонин, са проучени по същество, тъй като тези невротрансмитери се считат за мишени на антипсихотици. Няколко скорошни проучвания на гени, свързани с оксидативния стрес, предоставят доказателства за връзка между TD и оксидативен стрес. Освен това многобройни фармакогенетични проучвания са изследвали гени, свързани с невротрофични фактори, опиоидни рецептори, естрогенни рецептори, GABA път и глутаминергичен път. Фигура 1 показва хипотетични генетични фактори, допринасящи за TD.
Фиг. 1 . Генетични фактори, допринасящи за TD. Удебелените стрелки представляват репликирани доказателства от множество изследвания. TD, тардивна дискинезия; CYP, цитохром P450. GABA, гама-аминомаслена киселина
- Нефролитиаза - общ преглед на ScienceDirect теми
- Нефросклероза - общ преглед на ScienceDirect теми
- Skinfold - общ преглед на ScienceDirect теми
- Натриев баланс - общ преглед на ScienceDirect теми
- Покой за разход на енергия - общ преглед на ScienceDirect теми