Резюме
Заден план
Анализът на пробите на изпражненията е съществена част от рутинната диагностика на хелминтните инфекции. Стандартните методи като Kato и Kato-Katz обаче използват само част от наличната информация. Тук представяме метод, основан на ядрено-магнитната резонансна спектроскопия (ЯМР), който може да бъде спомагателен за стандартните процедури чрез оценка на сложните метаболитни профили (или фенотипове) на пробите.
Метод
Пробите бяха събрани през периода юни-юли 2015 г., замразени при -20 ° C на мястото на събиране и прехвърлени в рамките на четири часа за постоянно съхранение при -80 ° C. Фекалните метаболити се екстрахират чрез смесване на аликвотни части от около 100 mg размразени материали на изпражненията с 0,5 ml физиологичен разтвор на фосфатен буфер, последвано от етапите на хомогенизиране и центрофугиране. Всички NMR данни са записани с помощта на спектрометър Bruker 600 MHz AVANCE II, оборудван с 5 mm тройна резонансна обратна криопроба и z-градиентна система.
Резултати
Тук докладваме оптимизиран метод за метаболитно профилиране/фенотипиране на проби от изпражнения, базирани на ЯМР. Като цяло 62 метаболита са анотирани в пробата от пула, използвайки 2D ЯМР спектрите и базата данни Bruker Biorefcode. Съединенията обхващат широк спектър от метаболоми, включително аминокиселини и техните производни, късоверижни мастни киселини (SCFA), карбоксилни киселини и техните производни, амини, въглехидрати, пурини, алкохоли и други. Изследователски анализ на метаболитните профили не разкрива силни тенденции, свързани със статуса на инфекция на пациентите. Въпреки това, използвайки наказаната регресия като метод за променлива селекция, успяхме да намерим подмножество от единадесет променливи, което позволява да се дискриминират пациентите въз основа на състоянието на инфекциите.
Заключения
Опростен метод за метаболитно профилиране/фенотипиране на пробите на изпражненията се докладва и тества върху пилотна кохорта от описторхоза. Доколкото ни е известно, това е първият доклад от ЯМР-базиран анализ на изпражненията в контекста на хелминтните инфекции.
Заден план
Всъщност фекалните маси са физиологичният продукт на стомашно-чревния тракт, една от ключовите метаболитни системи на човешкото тяло. Поради това е логично да се приеме, че техният състав трябва да отразява текущия метаболитен статус на храносмилателния тракт или неговия метаболитен фенотип [8]. Човешките черва представляват сложна екосистема и приютяват чревни бактерии, превъзхождащи клетките в нашия организъм [9], а анализът на фекалните маси или/и техните производни (напр. Екстракти или фекални води) предлага най-директния достъп до физиологичните процеси, контролиращи хомеостаза на стомашно-чревната система, чревни бактерии-гостоприемници и взаимодействие между гостоприемниците и паразитните хелминти. Например, хелминтните инфекции често са придружени от такива симптоми като диария, коремна болка и кръв в изпражненията. Дадените примери представляват крайните случаи, но те дават ясна илюстрация на способността на паразита да променя метаболитната хомеостаза на гостоприемника и по-специално на храносмилателната система на гостоприемника. Това от своя страна прави метаболитния анализ на фекалните маси интересен, неинвазивен начин за проследяване на такива промени.
Тук представяме прост NMR базиран работен поток за метаболомика за анализ на фекални проби. За това пилотно проучване използвахме проби от изпражнения на пациенти с диагноза описторхоза и група от съвпадащи контроли. Описторхозата е паразитно заболяване, причинено от трематоди, принадлежащи към семейство Описторхии (Opisthorchis felineus, Opisthorchis viverrini) [10]. Според СЗО има около 17 милиона заразени хора и приблизително 112 милиона хора, изложени или в риск от инфекция. Представеният тук работен поток е само доказателство за принцип, но може лесно да се мащабира, настрои към количествен анализ и да се приложи в други казуси или в бъдещ рутинен скрининг, без фундаментална модификация на събирането на проби или излизащите диагностични процедури.
Методи
Вземане на проби
Изследването е прегледано и одобрено от местната комисия по етика на Сибирския държавен медицински университет (Томск, Русия). Пробите бяха събрани през периода юни-юли 2015 г. Пробите бяха замразени при -20 ° C на мястото на събиране и прехвърлени в рамките на четири часа за постоянно съхранение при -80 ° C. Диагнозата на описторхозата е потвърдена от теста на Kato-Katz [1]. Таблица 1 обобщава демографските данни на пациентите. Общо бяха използвани пробите от 30 пациенти (16 заразени и 14 неинфектирани).
Извличане на фекални метаболити
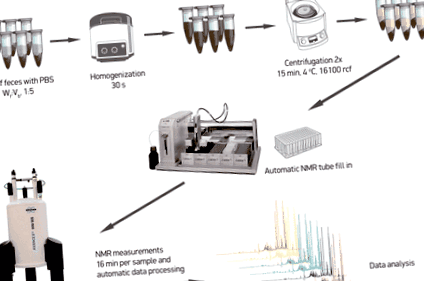
Фекалните метаболити бяха извлечени, както е описано другаде [11] с някои незначителни модификации. Накратко, аликвотите от около 100 mg размразени материали на изпражненията се смесват с 0,5 ml физиологичен разтвор на фосфатен буфер (1,9 mM Na2HPO4, 8,1 mM NaH2PO4, 150 mM NaCl, рН 7,4; Sigma-Aldrich, Германия), съдържащ 10% деутерирана вода (D2O 99,8%; Cortecnet, Франция) и 0,05 mM натриев 3-триметилсилил-пропионат-д 4 (TMSP-2,2,3,3-д 4; Cambridge Isotope Laboratories Inc., Обединеното кралство) като справка за химично изместване. Смесите се хомогенизират чрез биене на топчета с топчета циркониев оксид с диаметър 1 mm в продължение на 30 s при 4 ° С в Bullet Blender 24 (Next Advance Inc., САЩ). След това фекалната суспензия се центрофугира при 16100 ×ж за 15 минути при 4 ° С. Супернатантите се събират и центрофугирането се повтаря. И накрая, получените фекални екстракти бяха прехвърлени в плоча с 96 гнезда (Bruker, Германия) и 190 μL от всяка проба бяха прехвърлени в 3 mm NMR епруветка в шкаф за тръби SampleJet 96 (Bruker, Германия), използвайки манипулатор за течност 215 Gilson. След това пробите се поставят в система SampleJet и се държат охладени при 6 ° C, докато се поставят в опашка за NMR измервания.
Алтернативни протоколи за фекална екстракция, както са описани на други места [5, 12, 13], също са приложени, като се използват технически копия и същото оборудване и химикали, описани по-горе. За филтриране използвахме филтрите Whatman с пори с диаметър 0,2 μm (GE Healthcare, Великобритания). Етап на ултрацентрифугиране с филтриране също беше тестван с помощта на центробежни филтри Amicon Ultra целулоза с граничен MW от 3000 Da (Millipore Ireland, Ltd). Филтрите бяха измити с двойно дестилирана вода преди употреба и тествани за примеси и наличие на добавки, използвайки празна проба от буфер на PBS и получаване на ЯМР спектри със същите параметри като тези, използвани за измерване на фекални екстракти (виж по-долу).
ЯМР спектроскопия
Всички ЯМР данни са записани с помощта на спектрометър Bruker 600 MHz AVANCE II, оборудван с 5 mm обратна криопроба с тройно резонансно изображение и z-градиентна система. По време на измерването температурата на пробите се контролира при 27 ° С. Преди събирането на данни, настройката и съвпадението на главата на сондата, последвано от шиминг и калибриране на протонния импулс, се извършват автоматично за всяка проба. Едномерните (1D) 1Н NMR спектри са записани, като се използва първото нарастване на импулсна последователност на NOESY с пренаситеност (γB1 = 50 Hz) за потискане на водата по време на релаксационно закъснение от 4 s и време на смесване от 10 ms [14, 15] Записани са 64 сканирания от 65 536 точки, обхващащи 12 335 Hz и запълнени нула до 65 536 комплексни точки преди преобразуването на Фурие, е приложена експоненциална прозоречна функция с коефициент на разширяване на линията от 1,0 Hz. Спектрите бяха автоматично коригирани фазово и базово, и се препращаха към вътрешния стандарт (TMSP; δ 0,0 ppm).
След пълнене на епруветката, 30 μL от остатъците от всяка проба се комбинират, за да образуват смес от проби в басейна. Пробата от пула се разпределя аликвотно и се използва за получаване на двумерни (2D) ЯМР спектри, за да се подпомогне определянето на фекални метаболити. Комплектът от 2D експерименти включваше a J-разрешаване (J-res), 1 H-1 H корелационна спектроскопия (COZY), 1 H-1 H обща корелационна спектроскопия (TOCSY), 1 H-13 C хетероядрена единична квантова корелация (HSQC) и 1 H-13 C хетероядрена корелационна спектроскопия с множествена връзка ( HMBC), използвайки стандартните параметри, внедрени в Topspin 3.0 (Bruker Biospin, Германия).
NMR обработка на данни
NMR данните бяха допълнително обработени, използвайки вътрешни рутинни процедури, написани в Matlab 2014a (The Mathworks, Inc., САЩ) и Python 2.7 (Python Software Foundation, www.python.org). Накратко, получените 1Н спектри бяха преоценени за неправилни изходни линии и коригирани с помощта на полиномно напасване на степен 5. Спектралната област от 0,5 до 9,7 ppm е бинирана с помощта на вътрешен алгоритъм за адаптивно интелигентно свързване, който се основава на оригинална статия на De Meyer et al. [16]. Първоначалната ширина на контейнера беше зададена на 0,02 ppm и крайните променливи размери на контейнерите бяха изчислени въз основа на пиковата позиция и ширина в спектрите. Спектралната област с пика на остатъчната вода (4,5 - 5,1 ppm) беше изключена от данните. Окончателните данни се състоят от 429 контейнера, които са нормализирани чрез метода за нормализиране на вероятностните коефициенти [17], за да се коригират разликите в разреждането от проба към проба. Данните първо бяха нормализирани към единица обща площ и впоследствие променливите на всяка проба бяха разделени на тези на референтната проба, в този случай средният спектър. Впоследствие всяка проба се мащабира по нейния медианен коефициент, който представлява най-вероятния фактор на разреждане. И накрая, нормализираните данни бяха автоматично мащабирани преди статистическия анализ.
Анализ на данни
Целият анализ беше извършен в R статистическата софтуерна среда (http://www.r-project.org/, R версия 3.2.3.). Анализът на изследователските данни беше извършен с помощта на пакета “pcaMethods” [18]. Изборът на променлива беше извършен с пакета “glmnet” [19]. За визуализация на данни бяха използвани пакетите “ggplot2”, “GGally” и “gridExtra”.
Резултати
Оптимизиране на подготовката на пробата
Схематично очертание на работния процес за подготовка на пробата
Фигура 2 показва 1Н спектъра на обединена проба с анотации на идентифицираните метаболити. Като цяло 62 метаболита са анотирани в пробата от пула, като се използват 2D ЯМР спектрите и базата данни Bruker Biorefcode (Bruker Biospin, Германия). Откритите съединения обхващат широк спектър от метаболити, включително аминокиселини и техните производни, мастни киселини с къса верига (SCFA), карбоксилни киселини и техните производни, амини, въглехидрати, пурини, алкохоли и други. Пълният списък на метаболитите е изброен в легендата на фиг. 2.
Области от 600 MHz 1D 1 H NMR спектър на пробата от басейна, смесени от всички фекални екстракти, използвани в това проучване. Областите отгоре се умножават 16 пъти за по-добра визуализация. Идентифицирани са 60 фекални метаболита, като повечето от тях са анотирани в спектъра. Метаболити и тяхното номериране, както е показано на фигура: 1: 2-метилбутират; 2: Валерат; 3: n-бутират; 4: левцин; 5: Изолевцин; 6: Валин; 7: Пропионат; 8: изобутират; 9: 3-метил-2-оксоизовалерат; 10: 2-оксоизовалерат; 11: Етанол; 12: 3-хидроксибутират; 13: Треонин; 14: Лактат; 15: 2-хидроксиизобутират; 16: 3-хидрокси-2-бутанон; 17: Аланин; 18: Лизин; 19: Тимин; 20: Ацетат; 21: 5-аминопентаноат; 22: Орнитин; 23: Пролин; 24: Глутамат; 25: Метионин; 26: глутамин; 27: Сукцинат; 28: 2-оксоглутарат; 29: 3-фенилпропионат; 30: Аспартат; 31: Метиламин; 32: Малат; 33: Триметиламин; 34: Тирозин; 35: Malonate; 36: Холин; 37: D-глюкоза; 38: Таурин; 39: метанол; 40: Глицин; 41: D-ксилоза; 42: D-галактоза; 43: Фруктоза; 44: дихидроксиацетон; 45: Урацил; 46: Фумарат; 47: Уроканат; 48: Етаноламин; 49: Ксантин; 50: Хипоксантин; 51: никотинат; 52: 3-хидроксифенилацетат; 53: Триптофан; 54: Фенилаланин; 55: Оротат; 56; UDP-глюкуронат; 57: Формат; 58: бензоат; 59: 4-аминохипурат; 60: Хомованилат; 61: Путресцин; 62: Аспарагин
Изследователски анализ на данните
Основната цел на изследователския анализ на данните е да разкрие основните тенденции в данните, както и възможните аналитични и/или биологични объркващи фактори, ако има такива. Анализът на главните компоненти (PCA) е често използван метод за такъв анализ. Фигура 3 показва комбиниран график на резултатите от първите три основни компонента на модела PCA. Първите три компонента покриват почти 50% (
49) от общото отклонение в данните, но очевидно състоянието на инфекция не представлява видима тенденция в данните. Тъй като първоначалният модел на PCA не успя да опише каквито и да било тенденции в данните, свързани с дизайна на изследването, ние изградихме двукласов модел на частичен анализ на най-малките квадрати (PLS-DA) със статус на инфекции като идентификатор на класа. Моделът се оказа статистически лош и описа данните по-добре от случаен (данните не са показани). Може да се тълкуват резултатите като липса на връзка между състоянието на инфекция и метаболитния състав на изпражненията. Ефективността на модела PLS-DA явно подкрепя подобна интерпретация. Структурата на нашия набор от данни (30 наблюдения и 429 променливи) е такава, че броят на прогностичните променливи (p) е много по-голям от броя на пробите (n). Методът PLS-DA, въпреки че е един от най-популярните методи за класификация в анализа на метаболомиката, е неоптимален избор за p>> n наборите от данни [20]. По този начин решихме да използваме алтернативна стратегия за анализ на данни, включваща променлива стъпка за подбор, която може да идентифицира подмножество предиктори, имащи отношение към дизайна на изследването.
Графики на резултатите от PCA за първите три компонента
Променлив избор и валидиране на избраното подмножество
Графични полета за променливите, избрани с ласо регресията. Присвояване на променливи и съответстващи стр-стойностите са показани в таблица 2
Дискусия
Заключения
В обобщение, един прост метод за метаболитно профилиране/фенотипиране на пробите на изпражненията е докладван и тестван върху пилотна кохорта описторхоза. Доколкото ни е известно, това е първият доклад от ЯМР-базиран анализ на изпражненията в контекста на хелминтните инфекции. С това проучване беше направен опит за разширяване на конвенционалния начин на анализ на изпражненията, добавяйки допълнително измерение, което може да се използва за метаболитно фенотипизиране на пациентите, в задълбочено изследване на взаимодействието гостоприемник и паразит и търсене на метаболитна заболеваемост или/и инфекция маркери. За да се разширят и да се възползват в пълна степен от възможностите, предлагани от ЯМР метаболитно профилиране, са необходими много по-големи кохорти от тази, използвана в това проучване, за предпочитане дори събрани в различните ендемични области. С този доклад обаче ние предоставяме просто доказателство за концепцията, целяща да въведе утвърдена технология в областта на инфекциозните болести и анализа на фекалните материали и с това да стартираме бъдещи изследвания в тази посока.
Съкращения
1 H- 1 H корелационна спектроскопия
Хетеронуклеарна корелационна спектроскопия с множество връзки
- Анализ и риск за човешкото здраве от избрани тежки метали в обикновените юфка SpringerLink
- Бактерията, която причинява бъбречни камъни и усложнени инфекции на пикочните пътища, се отказва от генетичната си
- Статистика за рака на гърдата Световен фонд за изследване на рака
- Алфа-липоевата киселина (ALA) като добавка за отслабване е резултат от мета-анализ на
- Преодолейте пропастта между ОКР и храненето - Кентъки Конски изследвания