Влиянието на екстракти от V. opulus върху метаболитната активност на MIN6 в клетките, определено чрез анализ на PrestoBlue след 24-часово излагане на сок (FJ) (A) и PRF (B). Контролните клетки не бяха изложени на никакво съединение, освен на носителя; стойностите са средни стойности ± стандартни отклонения от поне три независими експеримента, n ≥ 12; изчислена е статистическа значимост спрямо контролни клетки (нелекувани), ** p ≤ 0,01, *** p ≤ 0,001.
Влиянието на V. opulus PRF екстракт върху морфологията на MIN6 клетки, третирани в продължение на 24 часа; контролните клетки не бяха изложени на никакво съединение, освен на носителя; произволно избрани полета са снимани при × 200.
Влиянието на екстракти от V. opulus върху нивото на АТФ в клетките MIN6, определено чрез луминисцентен анализ на АТР след 24-часово излагане на FJ и PRF (A); митохондриалният мембранен потенциал се определя с JC-1 сонда (В), където се използва положителен контрол на деполяризацията карбонил цианид m-хлорофенил хидразин (CCCP) (50 цМ); контролните клетки не бяха изложени на никакво съединение, освен на носителя; стойностите са средни стойности ± стандартни отклонения от поне три независими експеримента, n ≥ 9; изчислена е статистическа значимост спрямо контролни клетки (нелекувани), ** p ≤ 0,01, *** p ≤ 0,001; флуоресцентни изображения на MIN6 клетки, оцветени с JC-1, където произволно избрани полета са заснети при увеличение 200 × с FITC и Texas Red филтри (C).
Влиянието на 24 h експозиция на FJ и PRF върху фосфатидилсериновата екстернализация върху външната мембранна брошура на апоптотичните MIN6 клетки и мембранната пермеабилизация, открита с тестовия комплект анексин-V-FITC и оцветяване с пропидиев йодид (A); извличане на въздействие върху активиране на каспаза-9 (B) и активиране на каспази-3/7 (C); DAPI-оцветени ядра и кондензация на хроматин, наблюдавани с помощта на флуоресцентен микроскоп (Olympus CKX41, Япония), увеличение 400 × (D). Контролните клетки не бяха изложени на никакво съединение, освен на носителя; стойностите са средни стойности ± стандартни отклонения от поне три независими експеримента, n ≥ 9; изчислена е статистическа значимост спрямо контролни клетки (нелекувани), * p ≤ 0,05, ** p ≤ 0,01, *** p ≤ 0,001.
Влиянието на екстракти от V. opulus върху вътреклетъчното генериране на ROS, анализирано чрез DCFH-DA анализ след 24 часа инкубация на MIN6 клетки с FJ и PRF (A), GPx активност (B) и ниво на производство на хидропероксид (C). Контролните клетки не бяха изложени на никакво съединение, освен на носителя; стойностите са средни стойности ± стандартни отклонения от поне три независими експеримента, n ≥ 9; изчислена е статистическа значимост спрямо контролни клетки (нелекувани), * p ≤ 0,05, ** p ≤ 0,01, *** p ≤ 0,001.
Цитопротективните свойства на V. opulus екстракти при дози на IC0 (24 часа предварително инкубиране) срещу химическа индукция (500 цМ t-BOOH, 2 часа) и оксидативен стрес, анализирани чрез DCFH-DA върху MIN6 клетки (A); клетки, визуализирани под флуоресцентен микроскоп: ниска флуоресценция в контролни клетки, много висока флуоресценция в клетки след инкубация с 500 µM t -BOOH и намалена в клетки, предварително обработени с PRF за 24 h преди добавяне на t -BOOH (увеличение 200 ×) (B ); MIN6 метаболитна активност, анализирана с анализ на PrestoBlue (C). Контролните клетки не бяха изложени на никакво съединение, освен на носителя; стойностите са средни стойности ± стандартни отклонения от поне три независими експеримента, n ≥ 12; изчислена е статистическа значимост спрямо клетки, третирани с t -BOOH, ** p ≤ 0,01, *** p ≤ 0,001.
Влиянието на V. opulus екстракти върху натрупването на липидни капчици в MIN6 клетки, оцветени с червено по Нил, наблюдавано след третиране на клетките с екстракти при IC0 за 24 h (A); като положителна контрола се използва 100 μM олеинова киселина; контролните клетки не бяха изложени на никакво съединение, освен на носителя; стойностите са средни стойности ± стандартни отклонения от поне три независими експеримента, n ≥ 12; изчислена е статистическа значимост спрямо контролните клетки ** p ≤ 0,01. Клетки, визуализирани под флуоресцентен микроскоп (увеличение 200 ×) (B).
Влиянието на екстрактите на V. opulus върху поглъщането на аналог на мастна киселина TF2-C12, измерено в MIN6 клетки с анализ на поглъщане на FFA, наблюдавано след третиране на клетки с екстракти при IC0 за 24 h (A); контролните клетки не бяха изложени на никакво съединение, освен на носителя; стойностите са средни стойности ± стандартни отклонения, n ≥ 5; изчислена е статистическа значимост спрямо контролните клетки. Клетки, заредени с TF2-C12, визуализирани под флуоресцентен микроскоп (увеличение 200 ×) (B).
Влиянието на екстракти от V. opulus върху секрецията на инсулин от MIN6 клетки (A), секреция на GLP-1 в GLUTag клетки (B) при ниски (отворени стълбове) или високи (затворени стълбове) глюкозни условия. Контролните клетки не бяха изложени на никакво съединение, освен на носителя; стойностите са средни стойности ± стандартни отклонения от поне три независими експеримента, n ≥ 9; изчислена е статистическа значимост спрямо контролни клетки, третирани с ниско ниво на глюкоза *** p ≤ 0,001 или висока глюкоза ### p ≤ 0,001. Процент DPP4 ензимно инхибиране от FJ и PRF (C); стойностите са средни стойности ± SD, n ≥ 4; статистическа значимост ** p ≤ 0,01, *** p ≤ 0,001.
Емисионните спектри на маркирани с Laurdan клетки преди и след инкубация с екстракти от V. opulus при дози IC0 (A). Промени в течливостта на клетъчната мембрана, изразени като стойности на GP за сондата Laurdan след инкубация на клетки с екстракти в условия на ниско (отворени стълбове) или високо (затворени пръчки) глюкоза (B). Влиянието на екстрактите върху вътреклетъчното генериране на ROS, анализирано чрез анализ на DCFH-DA при ниски (отворени ленти) или високи (затворени стълбове) глюкозни условия (C). Хиперполяризиращ ефект, предизвикан от екстракти върху клетъчната мембрана при ниски (отворени решетки) или високи (затворени решетки) глюкозни условия (D). Контролните клетки не бяха изложени на никакво съединение, освен на носителя; стойностите са средни стойности ± стандартни отклонения от поне три независими експеримента, n ≥ 12; изчислена е статистическа значимост спрямо контролните клетки, третирани с ниско ниво на глюкоза * p ≤ 0,05, ** p ≤ 0,01 или висока глюкоза ## p ≤ 0,01.
Излъчването на белязани с пирен клетки преди и след инкубация с екстракти от V. opulus PRF (A) и FJ (B) при дози на IC0; представените данни са представителни емисионни спектри на маркирани с пирен клетки преди и след инкубация с PRF и FJ, n = 3.
Флуоресцентният спектър на HSA (1,5 × 10 −5 M, възбуждане при 295 nm) и неговите промени при увеличаване на концентрациите на екстракта от PRF (A). График на Стърн-Волмер за закаляване на HSA чрез PRF (концентрация на PRF в mg/mL) (B). График на Стърн-Волмер за закаляване на HSA с PRF (концентрация на PRF в изразена като еквивалент на хлорогенова киселина [M]) (C).
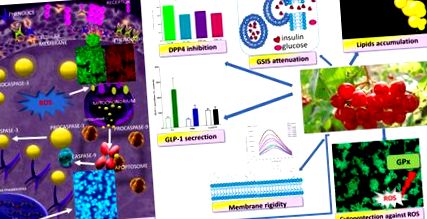
Фенолни съединения на Viburnum opulus като цитопротективни агенти, влияещи върху MIN6 клетъчната биологична активност - предложен механизъм на действие. Те притежават цитопротективна активност срещу генериране на ROS, индуцират клетъчна смърт от апоптотичен тип, стимулират секрецията на GLP-1 и инхибират активността на DPP4; те обаче отслабват GSIS и засилват натрупването на липиди.
Резюме
Влиянието на екстракти от V. opulus върху метаболитната активност на MIN6 в клетките, определено чрез анализ на PrestoBlue след 24-часово излагане на сок (FJ) (A) и PRF (B). Контролните клетки не бяха изложени на никакво съединение, освен на носителя; стойностите са средни стойности ± стандартни отклонения от поне три независими експеримента, n ≥ 12; изчислена е статистическа значимост спрямо контролни клетки (нелекувани), ** p ≤ 0,01, *** p ≤ 0,001.
Влиянието на V. opulus PRF екстракт върху морфологията на MIN6 клетки, третирани в продължение на 24 часа; контролните клетки не бяха изложени на никакво съединение, освен на носителя; произволно избрани полета са снимани при × 200.
Влиянието на екстракти от V. opulus върху нивото на АТФ в клетките MIN6, определено чрез луминисцентен анализ на АТР след 24-часово излагане на FJ и PRF (A); митохондриалният мембранен потенциал се определя с JC-1 сонда (В), където се използва положителен контрол на деполяризацията карбонил цианид m-хлорофенил хидразин (CCCP) (50 цМ); контролните клетки не бяха изложени на никакво съединение, освен на носителя; стойностите са средни стойности ± стандартни отклонения от поне три независими експеримента, n ≥ 9; изчислена е статистическа значимост спрямо контролни клетки (нелекувани), ** p ≤ 0,01, *** p ≤ 0,001; флуоресцентни изображения на MIN6 клетки, оцветени с JC-1, където произволно избрани полета са заснети при увеличение 200 × с FITC и Texas Red филтри (C).
Влиянието на 24 h експозиция на FJ и PRF върху фосфатидилсериновата екстернализация върху външната мембранна брошура на апоптотичните MIN6 клетки и мембранната пермеабилизация, открита с тестовия комплект анексин-V-FITC и оцветяване с пропидиев йодид (A); извличане на въздействие върху активиране на каспаза-9 (B) и активиране на каспази-3/7 (C); DAPI-оцветени ядра и кондензация на хроматин, наблюдавани с помощта на флуоресцентен микроскоп (Olympus CKX41, Япония), увеличение 400 пъти (D). Контролните клетки не бяха изложени на никакво съединение, освен на носителя; стойностите са средни стойности ± стандартни отклонения от поне три независими експеримента, n ≥ 9; изчислена е статистическа значимост спрямо контролни клетки (нелекувани), * p ≤ 0,05, ** p ≤ 0,01, *** p ≤ 0,001.
Влиянието на екстракти от V. opulus върху вътреклетъчното генериране на ROS, анализирано чрез DCFH-DA анализ след 24 часа инкубация на MIN6 клетки с FJ и PRF (A), GPx активност (B) и ниво на производство на хидропероксид (C). Контролните клетки не бяха изложени на никакво съединение, освен на носителя; стойностите са средни стойности ± стандартни отклонения от поне три независими експеримента, n ≥ 9; изчислена е статистическа значимост спрямо контролни клетки (нелекувани), * p ≤ 0,05, ** p ≤ 0,01, *** p ≤ 0,001.
Цитопротективните свойства на V. opulus екстракти при дози на IC0 (24 часа предварително инкубиране) срещу химическа индукция (500 цМ t-BOOH, 2 часа) и оксидативен стрес, анализирани чрез DCFH-DA върху MIN6 клетки (A); клетки, визуализирани под флуоресцентен микроскоп: ниска флуоресценция в контролни клетки, много висока флуоресценция в клетки след инкубация с 500 µM t -BOOH и намалена в клетки, предварително обработени с PRF за 24 h преди добавяне на t -BOOH (увеличение 200 ×) (B ); MIN6 метаболитна активност, анализирана с анализ на PrestoBlue (C). Контролните клетки не бяха изложени на никакво съединение, освен на носителя; стойностите са средни стойности ± стандартни отклонения от поне три независими експеримента, n ≥ 12; изчислена е статистическа значимост спрямо клетки, третирани с t -BOOH, ** p ≤ 0,01, *** p ≤ 0,001.
Влиянието на V. opulus екстракти върху натрупването на липидни капчици в MIN6 клетки, оцветени с червено по Нил, наблюдавано след третиране на клетките с екстракти при IC0 за 24 h (A); като положителна контрола се използва 100 μM олеинова киселина; контролните клетки не бяха изложени на никакво съединение, освен на носителя; стойностите са средни стойности ± стандартни отклонения от поне три независими експеримента, n ≥ 12; изчислена е статистическа значимост спрямо контролните клетки ** p ≤ 0,01. Клетки, визуализирани под флуоресцентен микроскоп (увеличение 200 ×) (B).
Влиянието на екстрактите на V. opulus върху поглъщането на аналог на мастна киселина TF2-C12, измерено в MIN6 клетки с анализ на поглъщане на FFA, наблюдавано след третиране на клетки с екстракти при IC0 за 24 h (A); контролните клетки не бяха изложени на никакво съединение, освен на носителя; стойностите са средни стойности ± стандартни отклонения, n ≥ 5; изчислена е статистическа значимост спрямо контролните клетки. Клетки, заредени с TF2-C12, визуализирани под флуоресцентен микроскоп (увеличение 200 ×) (B).
Влиянието на екстракти от V. opulus върху секрецията на инсулин от MIN6 клетки (A), секреция на GLP-1 в GLUTag клетки (B) при ниски (отворени стълбове) или високи (затворени стълбове) глюкозни условия. Контролните клетки не бяха изложени на никакво съединение, освен на носителя; стойностите са средни стойности ± стандартни отклонения от поне три независими експеримента, n ≥ 9; изчислена е статистическа значимост спрямо контролни клетки, третирани с ниско ниво на глюкоза *** p ≤ 0,001 или висока глюкоза ### p ≤ 0,001. Процент DPP4 ензимно инхибиране от FJ и PRF (C); стойностите са средни стойности ± SD, n ≥ 4; статистическа значимост ** p ≤ 0,01, *** p ≤ 0,001.
Емисионните спектри на маркирани с Laurdan клетки преди и след инкубация с екстракти от V. opulus при дози IC0 (A). Промени в течливостта на клетъчната мембрана, изразени като стойности на GP за сондата Laurdan след инкубация на клетки с екстракти в условия на ниско (отворени стълбове) или високо (затворени пръчки) глюкоза (B). Влиянието на екстрактите върху вътреклетъчното генериране на ROS, анализирано чрез анализ на DCFH-DA при ниски (отворени ленти) или високи (затворени стълбове) глюкозни условия (C). Хиперполяризиращ ефект, предизвикан от екстракти върху клетъчната мембрана при ниски (отворени решетки) или високи (затворени решетки) глюкозни условия (D). Контролните клетки не бяха изложени на никакво съединение, освен на носителя; стойностите са средни стойности ± стандартни отклонения от поне три независими експеримента, n ≥ 12; изчислена е статистическа значимост спрямо контролните клетки, третирани с ниско ниво на глюкоза * p ≤ 0,05, ** p ≤ 0,01 или висока глюкоза ## p ≤ 0,01.
Излъчването на белязани с пирен клетки преди и след инкубация с екстракти от V. opulus PRF (A) и FJ (B) при дози на IC0; представените данни са представителни емисионни спектри на маркирани с пирен клетки преди и след инкубация с PRF и FJ, n = 3.
Флуоресцентният спектър на HSA (1,5 × 10 −5 M, възбуждане при 295 nm) и неговите промени при увеличаване на концентрациите на екстракта от PRF (A). График на Стърн-Волмер за закаляване на HSA чрез PRF (концентрация на PRF в mg/mL) (B). График на Стърн-Волмер за закаляване на HSA с PRF (концентрация на PRF в изразена като еквивалент на хлорогенова киселина [M]) (C).
Фенолни съединения на Viburnum opulus като цитопротективни агенти, влияещи върху MIN6 клетъчната биологична активност - предложен механизъм на действие. Те притежават цитопротективна активност срещу генериране на ROS, индуцират клетъчна смърт от апоптотичен тип, стимулират секрецията на GLP-1 и инхибират активността на DPP4; те обаче отслабват GSIS и засилват натрупването на липиди.
- Антиоксиданти Безплатен пълнотекстов оксидативен дисбаланс и бъбречни увреждания в кафене, предизвикано от диета плъх
- Токсичност на въглерод, силиций и метални наночастици за хемоцитите при животни
- Биомолекули Безплатен пълнотекстов никотинамид, никотинамид рибозид и никотинова киселина - нововъзникващи роли
- Рак Безплатен пълнотекстов холин PETCT в множествена миелома HTML
- Безживното пълномаслено затлъстяване на животни при късни бременности влошава метаболитните нарушения на перинаталното