Резюме
ВЪВЕДЕНИЕ
Диетичните добавки с антиоксиданти имат потенциала да увеличат вероятността за оцеляване след иначе смъртоносно облъчване на цялото тяло (TBI). Наскоро Wambi et al. демонстрира, че антиоксидантната диета е започнала 1 седмица преди облъчването да подобри процента на мишките, оцелели от TBI, в сравнение с групите мишки, които са получавали контролна диета (1). Освен това, на 30 дни след TBI, същият процент от мишките са оцелели от TBI, когато мишките са преминали от антиоксидантната диета към контролна диета часове преди TBI или когато мишките са преминали към антиоксидантна диета от контролна диета 2 часа след TBI. Общото за подобряване на преживяемостта при всяко условие изглежда е наличието на антиоксиданти в диетата по време на излагането на радиация плюс или минус няколко часа. Подобрената преживяемост в резултат на антиоксидантна диета се дължи на намаляване на индуцирания от радиация оксидативен стрес и апоптоза на популацията от клетки на костния мозък, минимизирайки синдрома на костния мозък (1). Антиоксидантната диета е лесно достъпна и преводима противодействие за човешка употреба. За съжаление, антиоксидантните добавки могат да имат ограничена потенциална полезност в практическа ситуация, освен ако не са ефективни приблизително 1 ден след TBI.
Оптималното време за прилагане на антиоксидантна диета като радиационна контрамерка не е определено. За да се даде възможност за доставка и разпространение на агент за противодействие, вероятно е необходим минимум 1 ден. Също така, след значително излагане на облъчване на цялото тяло (1 до 7 Gy), хората могат да получат гадене, повръщане и диария, което предотвратява ефективното прилагане на диетата. След тази продромална фаза симптомите на облъчване отшумяват и жертвите на облъчване могат да получат антиоксидантна диета. Настоящите проучвания са предназначени да определят дали антиоксидантната диета е ефективно противодействие, когато се започне 24 часа след TBI.
Предимствата на антиоксидантната диета пред другите контрамерки, изискващи инжекция, като растежни фактори и цитокини, са тройни. Първо, антиоксидантната диета може да бъде лесно достъпна без правителствените запаси и разпределение, които биха били необходими за растежните фактори и цитокините. Второ, антиоксидантната диета може да се дава през устата, за разлика от инжекционните препарати, които обикновено изискват обучен персонал за приложение. Трето, антиоксидантната диета се счита за безопасна дори при продължителна употреба, което може да не е така за растежните фактори и цитокините (2–4).
В това съобщение представяме неотчетеното по-рано наблюдение, че оцеляването на мишките се подобрява, когато началото на приложението на антиоксидантната диета се забави за 24 часа след излагането на радиация в сравнение с добавянето на антиоксидантна диета, започнало няколко часа след излагане на радиация.
МЕТОДИ И МАТЕРИАЛИ
Проучванията върху животни бяха извършени в акредитиран от AAALAC център в болница Хенри Форд и бяха прегледани и одобрени от IACUC в болница Хенри Форд. Групи мишки C57BL/6, на възраст от 7 до 8 седмици, бяха изложени на радиация самостоятелно или в комбинация с антиоксиданти, както е описано по-долу. Мишките се аклиматизират в продължение на 1 седмица преди облъчването, настаняват се в контролирана с температура, филтрирана с HEPA среда и им се предлага храна и подкиселена вода ad libitum. Храната беше или AIN-93G гризач за гризачи (Land O'Lakes Purina Feed, Lansing, MI) или същата диета, допълнена с антиоксиданти.
Антиоксидант
Допълненият с антиоксиданти AIN-93G гризач за гризачи беше приготвен под наше ръководство от Land O'Lakes Purina Feed (Lansing, MI). Добавянето на антиоксидантна диета започва в точно определено време, както е посочено, след излагането на радиация. Веднъж започнала, диетата продължи по време на експеримента. Антиоксидантните добавки на грам диета бяха: 0,12 μg l-селенометионин, 19 μg натриев аскорбат, 51 μg N-ацетил цистеин, 100 μg α-липоева киселина, 8,6 μg α-токоферол сукцинат и 51 μg коензим Q10; антиоксидантната формула е проектирана да бъде идентична с режима „Диета А” в изследването на Guan et al. (5), но при подготовката му възникнаха някои грешки при закръгляването, водещи до незначителни отклонения.
Крайна точка на леталност
Реактивни кислородни видове (ROS) в клетки
ROS in vitro или in vivo се измерват чрез окисление на дихидроетидий (DHE). WI-38 човешки ембрионални фибробласти, получени от American Type Culture Collection, се поддържат в минималната основна среда на Eagle с 10% фетален говежди серум. Приблизително 50% сливащи се клетки WI-38 бяха облъчени с γ (използвайки описания по-горе източник на 137 Cs) или бяха облъчени фалшиво. Веднага след облъчване или фалшиво облъчване се добавя прясна среда за клетъчна култура със или без антиоксидантна добавка и клетките се връщат в своите инкубатори до следващия ден. Антиоксидантната добавка е 50 μM аскорбинова киселина, 50 μM α-липоева киселина, 10 μM 1-селенометионин, 10 μg/ml коензим Q10, 50 μM витамин Е сукцинат и 0,1% (обем/обем) етанол (разтворител). DHE оцветяването се извършва 24 часа след облъчването, както е описано по-долу за тъканни срези.
ROS в тъкани
Ефектът на антиоксидантната диета върху ROS в кожата е оценен при мишки, които са получили TBI със или без диетата, дадена след 24 часа по-късно. Две седмици след фалшиво облъчване или облъчване (т.е. след 13 дни от антиоксидантната диета), на мишките се инжектира DHE (27 mg/kg, i.p.); 4 часа по-късно мишките се упояват с кетамин (100 mg/kg, i.p.) и ксилазин (10 mg/kg, i.p.). След това кожата беше изрязана, замразена при –80 ° C и подложена на криосекция за последваща флуоресцентна микроскопия. DHE прахът се разтваря в диметилсулфоксид, за да се получи DHE изходен разтвор (10 mg/ml). DHE инжекцията (200 ml окончателно, 27 mg/kg) се получава чрез добавяне на основен разтвор на DHE към PBS, поддържан при 40uC. Quick и Dugan (7) отбелязват, че температурите под 37 ° C водят до утаяване на DHE.
Анализ за образуване на колония на далак (CFU)
Относителният брой клетки от костен мозък, оцелели от TBI, е количествено определен чрез ендогенния анализ на CFU на далака, както е описано по-горе (6). Броят на образуващите колония на далака единици е измерен, за да се оцени in vivo ефектът на антиоксидантната диета върху оцеляването на клетките на костния мозък. Групи мишки C57BL/6 са били изложени на 7.0 или 7.5 Gy самостоятелно или в комбинация с антиоксидантната диета (започнала 24 часа след облъчване). Дванадесет дни след TBI, далаците на мишките се изрязват и се потапят в разтвора на Bouin за поне 1 ден. След това колониите бяха преброени с помощта на дисекционен микроскоп.
Периферна кръвна картина
В избраните моменти след TBI, мишките са анестезирани с кетамин (100 mg/kg) и ксилазин (10 mg/kg) за вземане на кръв. Кръв (0,5 ml), получена чрез сърдечна пункция с игла 25, се поставя в хепаринизирани антикоагулантни епруветки. Пълната кръвна картина беше измерена с помощта на хематологичен анализатор Advia 120 (Siemens Diagnostics) от Antech Diagnostics (Детройт, Мичиган).
РЕЗУЛТАТИ
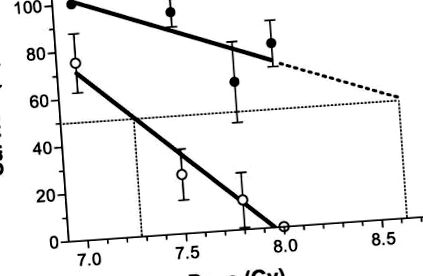
По-голямата част (78% ± 10%) от група от 18 мишки C57BL/6 са оцелели иначе смъртоносна доза радиация, когато диетата им е била допълнена с антиоксиданти. Фигура 1 илюстрира, че антиоксидантната диета, давана от 24 часа след TBI, осигурява значително смекчаване от индуцирана от радиация леталност (тест на Каплан-Майер, P Фиг. 2). Всички мишки умряха в рамките на 30 дни след облъчването, когато им беше осигурена диета, допълнена с антиоксиданти, започнала веднага след TBI. Диетата, давана от 24 часа след 8 Gy TBI, осигурява значително смекчаване в сравнение с антиоксидантната диета, започнала или веднага след TBI, 12 часа след TBI, или 48 часа след TBI (тест на logrank, P Фигура 3 показва, че с увеличаване на дозата на радиация оцеляването намалява приблизително линейно с доза в диапазона от 7,0 до 8,0 Gy (коефициенти на корелация, r 2, само за радиация и радиация плюс антиоксидантна диета са съответно 0,97 и 0,63). Установено е, че наклонът на линията за мишки, получили радиация само значително (P = 0,02) се различава от нулата с наклон -74 ± 10 (% оцеляване/Gy), докато отклонението от нулата не е значително (P = 0,2) за линията за антиоксидантната диета, започнала 24 часа след облъчването, с наклон от –31 ± 17. В обхвата на изследваните дози радиация добавянето на антиоксидантна диета направи значителна разлика в оцеляването. Факторът на радиационна защита е приблизително 1,18, изчислен като отношение раполирана оценка на LD50 от кривата за радиация плюс антиоксидантна диета и изчислената LD50 само за радиация.
Преживяемостта на мишките на 30 дни (n = 8–18/група) намалява с увеличаване на дозата на облъчване; наклонът за мишки без антиоксиданти в диетата (отворени символи) е по-стръмен от този за мишки, получаващи антиоксидантна диета (твърди символи). Монтирани са линии и са изчислени LD50, както е описано в текста.
Ефектът от антиоксидантната диета, дадена от 24 часа след TBI върху стволовите клетки на костния мозък, беше измерен с помощта на ендогенния анализ на S-CFU (Фиг. 4). Дванадесет дни след сублетално облъчване плюс антиоксидантна диета (започнала 24 часа след облъчването), броят на колониите на далака е бил два до три пъти по-висок (P 3 на μl кръв. Броят на червените кръвни клетки е 10 6 на μl кръв. Броят на тромбоцитите е 10 3 на μl кръв.
Периферната кръвна картина е показана на фиг. 4 за кръв, събрана 12 дни след сублетален TBI самостоятелно (7,0 Gy или 7,5 Gy) или TBI, последван от антиоксидантна диета, започвайки 24 часа по-късно. Броят на левкоцитите, еритроцитите, тромбоцитите и неутрофилите е значително по-нисък при облъчени мишки, отколкото при необлъчени контролни мишки (n = 4; P Фигура 5A и B показва, че клетките, третирани с антиоксиданти, съдържат по-малко ROS. Резултатите са потвърдени от изследвания на кожни проби от мишки, които преди са получавали радиация самостоятелно или радиация, последвана 24 часа по-късно от началото на диета, допълнена с антиоксиданти за около 2 седмици. Както при култивираните клетки, облъчената тъкан демонстрира увеличение на ROS. Увеличението на ROS е смекчено от добавяне на антиоксидантна диета, започвайки след облъчване (Фиг. 5C-H). Следователно, както in vitro, така и in vivo, ROS са били увеличени дни (в клетъчна култура) до седмици (при животни) след облъчване и ефектът е смекчен чрез добавяне на антиоксиданти.
Индуцираните от радиация реактивни кислородни видове са редуцирани от антиоксиданти in vitro и in vivo. Панел А: Клетките WI-38 бяха изложени на 8 Gy и ROS беше изследван 24 часа по-късно чрез флуоресценция от окислен дихидроетидий (DHE). Панел Б: DHE флуоресценция в WI-38 клетки, третирани с антиоксиданти в продължение на 24 часа, започвайки веднага след облъчването. Панели C – H: Кожа от мишки 2 седмици след 8 Gy TBI. Панели C, D и E са светлинни микроскопски изображения на кожни участъци след фалшиво облъчване, 8 Gy TBI самостоятелно и TBI плюс антиоксиданти, съответно. Панели F, G и H са флуоресцентни изображения на окислен DHE в тъканни резени, съседни на панели C, D и E, съответно. Оригиналните увеличения са показани в отделни панели.
ДИСКУСИЯ И ЗАКЛЮЧЕНИЯ
Йонизиращото лъчение инициира клетъчно увреждане директно чрез йонизация и индиректно чрез производство на свободни радикали. Приблизително две трети от радиационно-индуцирани щети се причиняват от свободните радикали, които се генерират по време на експозицията. В допълнение към краткотрайните свободни радикали, произведени по време на излагане, след радиационното излагане се генерират свободни радикали; АФК и провъзпалителните цитокини предизвикват множество биологични наранявания дълго след приключване на облъчването. Един от подходите за противодействие на оксидативния стрес, причинен от свободните радикали и ROS, е използването на антиоксиданти като α-токоферол сукцинат, аскорбинова киселина, β-каротин, витамин А, α-липоева киселина, N-ацетилцистеин, селен или SH съединение ( напр. амифостин) (9, 10).
Обосновката за използването на комбинация от антиоксиданти се основава на редица наблюдения. Отделните антиоксиданти могат да действат като прооксиданти, когато самите те са окислени; следователно отделни антиоксиданти могат да подобрят прогресията на постирадиационното увреждане на тъканите и органите. В допълнение, хората разполагат с набор от антиоксиданти, както ендогенни антиоксиданти, които се синтезират конститутивно от клетките, така и антиоксиданти, които се консумират в диетата. Отделните антиоксиданти функционират по различни механизми и имат различен афинитет към различни свободни радикали. Например, α-токоферолът е по-ефективен като гасител на свободните радикали в редуцирана кислородна среда, витамин Е има малък ефект върху окислителите, получени от азотен оксид, а витамин А е най-ефективен при по-високи атмосферни налягания. Аскорбиновата киселина е необходима за защита на клетъчните компоненти във водна среда, докато каротеноидите, витамините А и Е предпазват клетъчните компоненти в неводната среда. Витамин С рециклира окисления витамин Е до активна форма (11). Комбинираните витамини Е и С инхибират апоптозата в човешките ендотелни клетки по-ефективно от всеки сам, увеличавайки Bcl-2 и регулирайки надолу проапоптотичния Bax (12).
Данните, представени тук, показват, че диета с добавка на антиоксидант е започнала 24 часа след иначе смъртоносно излагане на радиация, ефективно смекчаващо смъртта (фиг. 1), медиирано от щадящи клетки на костния мозък (фиг. 4), може би поради намаляване на реактивния кислород видове (фиг. 5). Ефектът от 8 Gy върху стомашно-чревната система изисква дискусия. Последните данни показват, че механизмите, управляващи синдрома на костния мозък и стомашно-чревния синдром след TBI, се развиват едновременно (14). Следователно е необходимо да се вземат предвид възможните последици от радиационното увреждане за усвояването на антиоксиданти. Може да се очаква още по-голям смекчаващ ефект, ако биоразпределението на антиоксидантите бъде нарушено от стомашно-чревно увреждане.
Връзката между ROS и хематопоезата се изяснява на молекулярно ниво. Доказано е, че факторите на растежа, които стимулират хематопоезата като IL3 и GM-CSF, причиняват повишаване на вътреклетъчните нива на ROS (15, 16). Генерирането на ROS в отговор на хематопоетични растежни фактори допринася за сигнални събития надолу по веригата, включващи фосфорилиране на тирозин, като клетъчна пролиферация (15) и апоптоза (17). Iiyama et al. (17) замесен ROS в прогресията на клетъчния цикъл, индуцирана от хемопоетичен цитокин, от G1 към S фаза чрез индуциране на експресия на c-Myc, циклин D2 и циклин Е и намаляване на експресията на p27. Iiyama et al. (16) също показа, че ROS играят роля в цитокиновото активиране на Jak2 с сигнализиране надолу по веригата на проапоптозните пътища, включително MEK/ERK. Лечението с антиоксиданти инхибира увеличаването на ROS, намалява фосфорилирането на тирозин, намалява пролиферацията, индуцирана от GM-CSF (15, 16), и намалява апоптозата (1).
Нашите данни са първите, които показват, че забавянето на приложението на антиоксиданти след клетъчен стрес може да бъде от полза за оцеляването на клетките и животните. Кинетиката на генериране на ROS от хематопоетични цитокини, както и механизмите, чрез които ROS участват в сигнализирането на цитокиновите рецептори за регулиране на пролиферацията и апоптозата на хематопоетичните клетки, е изследвана от Iiyama et al. (16). Те демонстрираха, че хематопоетичните цитокини IL3 и Epo индуцират бързо и преходно увеличение на ROS, което достига своя връх след 30 минути, последвано от бавно прогресивно увеличение на ROS 24 часа след приложението на цитокини. Изглежда, че ROS пътищата, контролиращи пролиферацията и апоптозата на хематопоетичните клетки, включват две отделни увеличения на ROS, преходно увеличение след 30 минути и продължително увеличение, което продължава поне 24 часа.
Смекчаването на леталната смъртност от антиоксиданти, приложени скоро след излагане на радиация, се дължи на намаляване на апоптозата (1). Нашият опит с мишки C57BL/6 не е в противоречие с тези резултати, както е показано на фиг. 2, което също илюстрира допълнителната полза от изчакването да започнете да прилагате диета, допълнена с антиоксиданти, до 24 часа след облъчването. Изглежда, че първата преходна вълна на ROS има благоприятен ефект върху оцеляването, тъй като ранното минимизиране на ROS има вреден ефект върху оцеляването на клетките на костния мозък.
В допълнение към инхибирането на апоптозата, намаляването на ROS от антиоксиданти скоро след излагането на радиация инхибира прогресията на клетките от G1 до S (18), фазата на клетъчния цикъл, в която възстановяването на увреждане на ДНК е най-ефективно (19). Възстановяването на увреждане на ДНК има време на полувреме от 1 до 2 часа (20, 21). Следователно арестуването на клетките преди S фаза твърде скоро след излагане на радиация може да намали способността на клетките да възстановят напълно увредената ДНК. Едно от обясненията за увеличената преживяемост на животните, когато се дава антиоксидантна диета, започваща 24 часа след облъчването, е, че отлагането на началото на антиоксидантната диета позволява най-ефективното възстановяване на радиационното увреждане и най-голямото увеличение на оцеляването на клетките на костния мозък. Необходими са допълнителни проучвания, за да се потвърди или опровергае тази хипотеза.
В заключение, нашите резултати разширяват работата на други, за да покажат, че диетата, допълнена с антиоксиданти, е ефективна за смекчаване на леталната смъртност, когато е започнала 24 часа след облъчването и е по-ефективна, отколкото ако се дава скоро след експозицията. Нашите резултати подкрепят стойността на антиоксидантите като противодействие срещу радиологичния тероризъм, особено в практичния сценарий за започване на диета, допълнена с антиоксиданти 24 часа след експозицията.
ПРИЗНАНИЕ
Тези проучвания са подкрепени от U19AI067734-020005 (Режисьор: Jae Ho Kim), безвъзмездна помощ от NIH/NIAID, която е част от Центъра за медицински противодействия срещу радиационно увреждане (CMCR) към Медицинския колеж в Уисконсин (PI: John E. Moulder ).
- Причини за запек, които може да се избегнат, след започване на нова диета здравословно
- Острото излагане на диета с високо съдържание на мазнини променя моделите на хранене и състава на тялото
- 10 съвета за начинаещи вегани, започващи растителна диета - ForksToFeet
- 7 добавки, които трябва да имате предвид при започване на растителна диета
- Мозъчните тумори реагират на диета и лъчева терапия