Резюме
Въведение: червата в здравето и болестите
Предишното мнение, че червата е до голяма степен инертен орган, е било оспорвано повече от десетилетие, тъй като чревната микробиота осигурява основни функции, които човешкото тяло само по себе си не е в състояние да осигури [1], като събирането на основни хранителни продукти, енергия спестяване, метаболизъм на ксенобиотици, защита срещу инвазия от чужди микроби, обновяване на чревния епител, генериране на витамини и балансиране на имунната функция [1, 2].
Определението за „нормален“ микробиом с поразителните му индивидуални различия, понякога поради ежедневни елементи като диета или упражнения [3, 4], повдигна очевидния въпрос за това какво се случва по време на заболяването [5, 6] . Още през 2003 г. бяха описани промени в чревния микробиом за мултиорганна недостатъчност, рак на дебелото черво и възпалително заболяване на червата [2]. През последното десетилетие този списък беше допълнен от дълга поредица от силно разпространени хронични заболявания. Връзката между чернодробните заболявания и чревния микробиом може да се очаква от тяхното съпоставяне [7]. Доказана е обаче и връзка като причина или следствие със захарен диабет, затлъстяване, инсулинова резистентност, метаболитен синдром, стареене, микро-възпаление и сърдечно-съдови заболявания [6, 8, 9].
Съзнанието, че също хроничното бъбречно заболяване (ХБН) е свързано с чревния статус, дойде относително късно [10] и отчасти произтича от прозрението, че няколко токсина, активни в уремичния синдром, произхождат от червата [11, 12].
Много от гореспоменатите хронични състояния, свързани с промени в чревния микробиом, също са свързани с бъбречна недостатъчност или се разглеждат като причина за нея. Поставен е въпросът дали чревният микробиом може да е един от общите знаменатели, свързващи всички тези елементи заедно [13, 14]. Възможно е някои от разтворените вещества, генерирани в червата и в момента наречени уремични токсини, да проявяват своята токсичност дори при нормално функциониращи бъбреци [15] и по този начин са не само уремични токсини, но и токсини като цяло. Тази хипотеза обаче остава да бъде потвърдена.
По този начин има добри причини да разгледаме отблизо взаимодействието между червата и бъбреците, особено след като разбирането на механизмите може да създаде възможности за разработване на нови целеви терапевтични интервенции [13, 16]. В този разказ ще разгледаме текущото състояние на техниката по тази тема, включително двупосочното взаимодействие между червата и уремичната токсичност, доказателство за концепцията за ролята на червата в генерирането на уремичен токсин, доказателствата за токсичността на генерирани молекули и изчерпателен преглед на наличните терапевтични възможности, като се има предвид уремичната токсичност/токсини като ключови елементи.
Двупосочната интерференция между червата и уремията
Червата са отговорни за генерирането на уремични задържащи съединения с патофизиологично въздействие, докато уремията като такава причинява структурни и функционални чревни промени, които косвено причиняват заболеваемост и смъртност [17], като предизвикват възпаление по различни пътища [10]. По този начин, кръстосаната връзка между уремия и червата се основава на два различни елемента, но последиците са едни и същи, базирани на двоен ефект: индуциране на микро-възпаление, протичащо с некомпетентност на предварително активираната имунна система да се справи със стимули [10, 18], което води до повишен риск от инфекция, който накрая от своя страна отново е провъзпалителен. Възпалението остава една от основните причини за усложнения и смърт при ХБН, но също така и при състояния, които не са ХБН.
Червата като източник на уремични токсини
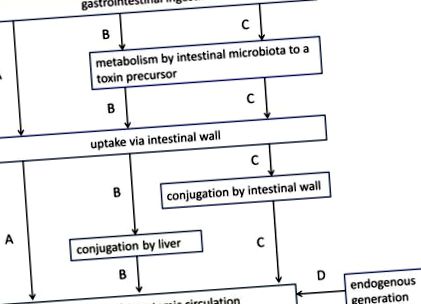
Уремичните токсини се генерират по няколко начина (Фигура 1): (i) някои от тях (напр. Пептиди) се произвеждат в организма без приноса на червата; (ii) други (напр. напреднали гликационни крайни продукти - AGEs) навлизат в тялото чрез немодифицирана абсорбция на хранителни елементи от червата; (iii) накрая, по същество разтворени вещества, свързани с протеини, като феноли, индоли или хипурати, но също така и триметиламин оксид (TMAO) се генерират метаболитно от прекурсори, произхождащи от микробна ферментация [12, 19]. Редица задържащи разтворени вещества (напр. AGEs, пикочна киселина) произхождат частично от червата и частично от тялото.
Основни метаболитни пътища, участващи в генерирането на уремичен токсин. (A) поглъщане през стомашно-чревния тракт и директно немодифицирано поемане през чревната стена в системното кръвообращение (напр. усъвършенствани крайни продукти за гликиране); (Б.) гастроинтестинално усвояване на предшественик (напр. аминокиселина), който се трансформира от чревната микробиота в друг предшественик (напр. индол); след поглъщането му през чревната стена и порталната вена, този предшественик се конюгира допълнително от черния дроб (напр. индоксил сулфат) преди прехвърлянето му в системната циркулация; (° С) стомашно-чревно поглъщане на предшественик (напр. аминокиселина), който се трансформира от чревната микробиота в друг предшественик (напр. индол); предшественикът е конюгиран по време на поглъщането му през чревната стена (напр. индоксил сулфат) и след това преминава в системната циркулация през черния дроб, без допълнителни модификации; (д) ендогенно генериране без принос на стомашно-чревния тракт (напр. β2-микроглобулин). Променено от Schepers et al. [12].
Активната роля на червата е особено видна при генерирането на свързаните с протеините уремични токсини (напр. Индоксил сулфат и р-крезил сулфат) (Фигура 1, пътища В и С). В началото са аминокиселините (в casu триптофан и тирозин), получени от усвояването на протеини, които се трансформират от чревната микробиота в предшественици на уремични токсини като индол и р-крезол). След това те се конюгират по време на абсорбцията в чревната стена или по-надолу по течението в черния дроб, преди да се прехвърлят в системната циркулация [12]. Най-разпространените конюгати са сулфатите, въпреки че са възможни много други структурни варианти (Таблица 1). В допълнение, функционални групи, като метил или хидроксил, могат да бъдат добавени в различни позиции. Някои съединения остават немодифицирани (например кинуренин).
маса 1.
Предшественици и конюгати, съставляващи чревно генерирани уремични метаболити a
| Предшественици |
| Индол |
| Фенол |
| Крезол |
| Хипурат |
| Метиламин |
| Конюгати |
| Сулфат |
| Лактат |
| Ацетат |
| Глюкуронид |
| Пропионат |
| Ацетилглицин |
| Пропионилглицин |
| Оксид |
a Списъкът не е изчерпателен.
Допълнителни фактори, допринасящи
При уремия редица допълнителни чревни модификации, участващи в така наречения процес на асимилация, водят до увеличаване на генерирането на уремични токсини в сравнение с нормалното състояние. Първо, аминокиселините, ако се усвояват по-слабо по стомашно-чревния тракт, представят повече субстрат на червата за микробен метаболизъм [12]. Второ, балансът на чревната микробиота се променя в полза на протеолитичните микроорганизми, произвеждащи повече токсинен прекурсор чрез ферментация (вж. По-долу) [20–22]. И накрая, необичайната чревна подвижност, удължаваща транзита на дебелото черво [23, 24], лишава дебелото черво от въглехидрати, предизвиквайки разширяване на протеолитичните видове нагоре по веригата, увеличавайки генерирането на бактериални токсини и увеличавайки времето за тяхното усвояване [23]. В елегантно проучване Bammens et al. оценява отделянето на p-крезол с урината, предшественика на крезиловите конюгати и сурогат от тяхното генериране: приблизително два пъти повече p-крезол се екскретира за 24 часа с урината на пациенти с напреднала ХБН в сравнение с контролите с нормална бъбречна функция и екскрецията на р-крезол в урината е в отрицателна корелация с GFR [25].
Това е обърнат свят: промени в червата поради уремия
Червата не само играе роля в генерирането на уремични токсини, но и обратното около уремията (и като разширяване на уремичните токсини) може да причини функционални и структурни модификации в червата с патофизиологични последици.
Първо, бактериалните видове, които са склонни да генерират уремични токсини чрез ферментация, са привилегировани при уремия (Таблица 2) и надхвърлят броя на защитните видове като лактобацилите [20, 21]. Досега само три проучвания сравняваха състава на чревната микробиота на уремични спрямо контролни пациенти чрез бактериален геномен анализ: всички откриха дисбаланс в пропорционалното разпределение на чревните бактерии с преобладаване на видове с патологично въздействие и/или недостиг на тези, които нямат вредно въздействие [21, 26, 27], идентично с това, което е демонстрирано преди при уремични плъхове [26]. По-ранни проучвания, използващи негеномни техники, също са дефинирали, че редица бактериални видове, склонни към протеолитична ферментация, сред които видове клостридии, са по-разпространени [20].
Таблица 2.
Ферментиращи чревни бактериални видове a
| Клостридии |
| Clostridium bifermentans |
| Clostridium sporogenes |
| Clostridium clostridiforme |
| Clostridium leptum |
| Peptostreptococcus asaccholyticus |
| Peptostreptococcus indolicus |
| Бактероидети |
| Бактероиди теталотаомикрон |
| Bacteroides putredinis |
| Други |
| Fusobacterium nucleatum |
| Actinomyces israelii |
| Megalosfaera elsdinii |
| Propionibacterium acnes |
a Въз основа на Смит и Макфарлейн [20].
Второ, бактериите на дебелото черво при уремия са склонни да се придвижват до части от тялото, където обикновено не присъстват, освен в много ниски количества (транслокация). Това включва миграция на микроби в йеюнума [23], в мезентериалните лимфни възли и по-нататък в кръвта и останалата част на тялото [22, 28–31]. Bossola et al. откриха получени от бактерии фрагменти на ДНК в кръвта на пациенти на хемодиализа, но тъй като бактериите бяха открити и в диализат, извън чревен източник, т.е. замърсен диализат, не можеше да бъде изключен [28]. Въпреки това, Wang et al. съобщава за подобни открития при недиализирани пациенти с ХБН, посочвайки факта, че и източници, различни от диализат, могат да бъдат отговорни за тези ДНК фрагменти при уремични пациенти, а в този случай червата е основен виновник за кандидата [22]. По-убедително дори, че всички бактериални ДНК, открити в кръвта, са същите като тези от родовете, присъстващи в червата [22]. При уремични плъхове бактериална ДНК на ентерични видове е демонстрирана в мезентериалните лимфни възли, кръвта и дори в черния дроб и далака [30]. Както при хората, така и при животните, този бактериален свръхрастеж и транслокация са свързани с микро-възпаление [22, 30].
Трето, убедителни аргументи подкрепят загубата на чревната защитна бариера при уремия. След първите резултати в тази посока, публикувани през 1991 г. [32], Vaziri и колеги демонстрират in vitro и ex vivo, че уремичната среда нарушава чревната епителна защита [21, 33], като изчерпва протеиновите съставки на стегнатите връзки (Zona Occludens- 1 (ZO-1), Claudin-1 и Occludin). Последващото изтичане може да причини възпаление чрез разпространение на трансфер на ендотоксин в кръвния поток. Vaziri et al. може също да демонстрира, че уреята създава същия ефект [34], с допълнително подобрение чрез добавяне на уреаза, което предполага, че бактериите, произвеждащи уреаза, генериращи амоняк, усилват този ефект [34]. Същите автори също демонстрират, че прилагането на сорбента AST-120 (Kremezin R) защитава чревната бариера при уремични плъхове [35]. Тъй като AST-120 по същество е известен с това, че намалява концентрацията на свързаните с протеини уремични разтвори, а не тази на уреята, може основателно да се предположи, че и други уремични разтворени вещества освен уреята [36] или техните прекурсори нарушават чревната бариера.
По този начин, накратко, уремията причинява редица чревни промени (бактериална транслокация, изтичане на чревната бариера и генериране на свързани с протеини уремични токсини), които всички водят до възпаление, основна причина за заболеваемост и смъртност, както при ХБН, така и при популация, различна от ХБН.
Доказване на концепцията
Теорията, че чревната микробиота допринася за генерирането на уремичен токсин чрез метаболизиране на продуктите от разграждането, получени от приема на протеини в храната, е потвърдена в редица проучвания с доказателство за концепцията.
През 1965 г. Einheber и Carter демонстрират, че безплодните плъхове, направени анефрични, оцеляват по-дълго и губят по-малко тегло от своите колеги с чревни микроорганизми [37]. През 1982 г. Yokoyama et al. демонстрира, че стерилизирането на червата чрез комбинация от антибиотици при отбиване на свине с нормални бъбреци намалява фекалната и уринарната екскреция на фенолни и ароматни бактериални метаболити и увеличава телесното им тегло [38]. Неотдавнашно проучване показа, че антибиотичната профилактика за епизоди на неутропения при пациенти, получили алогенна трансплантация на стволови клетки, води до промяна на чревната микробиота и до драстично намаляване на концентрацията на индоксил сулфат в урината [39].
Наскоро Wikoff et al. в сравнение с нецелена метаболомна масспектрометрия плазмата на мишки без микроби с нормална бъбречна функция с тази на животни с нормална фекална микробиота и може да посочи редица дискриминатори, сред които са няколко съединения, известни като свързани с протеини уремични токсини като индоксил сулфат, хипурова киселина и фенилоцетна киселина [40], които също са субстрат на бъбречните тубулни органични анионни транспортери (ОАТ), обясняващи тяхното задържане при бъбречна недостатъчност, ако тубулите са повредени [41].
Аронов и др. прилага метаболомен анализ чрез масспектрометрия за сравняване на концентрацията на плазмените разтвори на шест пациенти на хемодиализа без дебело черво с тази на девет пациенти с дебело черво [42], като целта е идентифицирането на метаболити, различаващи тези две групи. Сред 30-те дискриминатора имаше няколко свързани с протеина уремични продукти за задържане. В повечето случаи съотношението на плазмените концентрации от 20 години преди това показва по-ниски серумни концентрации и фекални загуби на фенол и р-крезол при веганистите [44]. Увеличаването на приема на диетични фибри чрез прилагане на резистентно нишесте в продължение на 6 седмици в рандомизирано контролирано проучване (RCT) при пациенти на хемодиализа намалява индоксил сулфат без плазма, докато има тенденция за намаляване на свободния р-крезил сулфат [45].
Eloot et al. оцени връзката между концентрацията преди диализа на няколко по същество свързани с протеини уремични токсини и редица потенциални влияещи фактори като Kt/Vurea като индекс на адекватност на диализата, нормализирана скорост на катаболизма на протеините (nPCR) като индекс на приема на протеини в храната, остатъчна бъбречна функция, възраст, диабет, пол, телесно тегло и диализа реколта [46]. Намерена е корелация, по същество за остатъчната бъбречна функция и nPCR, а не за другите фактори, включително Kt/Vurea, което отново предполага роля за усвояването на хранителните протеини в генерирането и концентрацията на уремичен токсин, дори преодоляване на влиянието на адекватността на диализата.
Токсичност на съединенията от чревен произход
Без да следваме същия твърд подход, приложен в систематичния преглед, споменат [48], открихме поне пет нови публикации, съответстващи на критериите за включване на последното проучване, обхващащи инхибирането на лекарствения метаболизъм [55]; повишена кръстосана връзка между левкоцити и ендотел, разграждане на гликокаликса и съдово изтичане [56]; апоптоза на остеобласти [57]; индукция на рецептор на тубулен ендотелен растежен фактор, водещ до ремоделиране на тъканите [58] и инхибиране на разграждането на ангиотензин II [59].
Подобни ефекти са описани и за други токсини, свързани с протеини [60] като хипурова киселина [61–63], индол оцетна киселина [61, 62, 64–67], фенил оцетна киселина [61, 67, 68]; р-крезилглюкуронид [56, 67, 69] и кинуренова киселина [61, 67] (Таблица 3).
Таблица 3.
Свързани с протеини уремични токсини, различни от индоксил сулфат и р-крезил сулфат с токсично въздействие
- Синтетичната лигавица предлага по-добро доставяне на лекарства до тънките черва; Харвардски вестник
- Защитният ефект на диета с ниско съдържание на протеини срещу тубуло-интерстициални увреждания при бъбреци с диабет
- Начини да поддържате бъбреците си здрави
- Ефектът на животинския протеин върху бъбреците
- Защо ме болят бъбреците, когато пия сода