Джонатан К. Коен
1 Катедра по вътрешни болести, Югозападен медицински център на Тексаския университет, Далас, Тексас 75390–9046, САЩ.
Джей Д. Хортън
1 Катедра по вътрешни болести, Югозападен медицински център на Тексаския университет, Далас, Тексас 75390–9046, САЩ.
2 Катедра по молекулярна генетика, Югозападен медицински център на Тексаския университет, Далас, Тексас 75390–9046, САЩ.
Хелън Х. Хобс
1 Катедра по вътрешни болести, Югозападен медицински център на Тексаския университет, Далас, Тексас 75390–9046, САЩ.
2 Катедра по молекулярна генетика, Югозападен медицински център на Тексаския университет, Далас, Тексас 75390–9046, САЩ.
3 Медицински институт Хауърд Хюз, Югозападен медицински център на Тексаския университет, Далас, Тексас 75390–9046, САЩ.
Резюме
Безалкохолната мастна чернодробна болест (NAFLD) е процъфтяващ здравословен проблем, който засяга една трета от възрастните и все по-голям брой деца в развитите страни. Болестта започва с анормално натрупване на триглицериди в черния дроб, което при някои индивиди предизвиква възпалителен отговор, който може да прогресира до цироза и рак на черния дроб. Въпреки че NAFLD е силно свързан със затлъстяването и инсулиновата резистентност, неговата патогенеза остава слабо разбрана и терапевтичните възможности са ограничени. Тук обсъждаме скорошни механистични прозрения за NAFLD, като се фокусираме предимно върху онези, които са възникнали от генетични и метаболитни проучвания на човека.
В началото на еволюцията на еукариот, триглицеридите (TG) се появяват като предпочитано хранително вещество за съхранение, за да се защитят от колебанията в търсенето и наличността на енергия. Повсеместният избор на TG за тази роля се дължи на две физикохимични свойства: TG осигуряват по-голяма калорийна плътност (9 kcal/g), отколкото въглехидратите (4,5 kcal/g) или протеините (4 kcal/g), а TG са неразтворими във вода, така че те могат да се натрупват до високи нива без неблагоприятни осмотични или колоидни ефекти върху клетките. При висшите организми TG се натрупва в адипоцити и се натрупва в други видове клетки само при необичайни обстоятелства. Например, мигриращите птици съхраняват големи количества TG в черния дроб като енергиен източник в подготовка за продължителни сезонни полети, склонност, която е била използвана за производство на кулинарен деликатес fois gras. Подобно на мигриращите птици, някои хора, които консумират излишни калории, депозират мазнини в черния дроб. При хората обаче мастният черен дроб е неадаптивен и може да има тежки клинични последици.
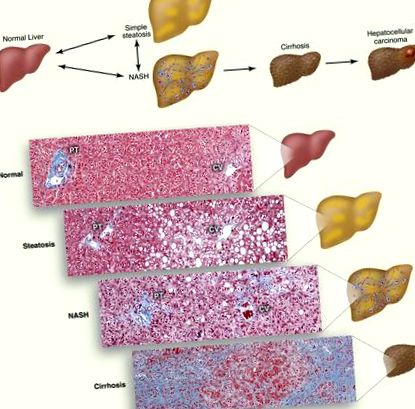
Болестният спектър на неалкохолната мастна чернодробна болест. (A) Схема на прогресия на NAFLD. Натрупването на TG в липидни капчици в хепатоцитите причинява стеатоза. Стеатозата, свързана с възпаление, клетъчна смърт и фиброза, се нарича NASH, която може да прогресира до цироза. Хората с цироза имат повишен риск от хепатоцелуларен карцином. (Б.) Хистологични разрези, илюстриращи нормален черен дроб, стеатоза, NASH и цироза. Колагеновите влакна са оцветени в синьо с трихромовото оцветяване на Masson. Показана е порталната триада (PT), която се състои от чернодробната артерия, порталната вена и жлъчния канал и централната вена (CV).
Факторите, които насърчават отлагането на TG в черния дроб и прехода от стеатоза към стеатохепатит и цироза при хората, не са ясно определени. Моделите на мишки, които рекапитулират някои характеристики на континуума на човешкото заболяване, са дали представа за възможните патологични механизми, допринасящи за неговото развитие (4), но относителните роли на тези пътища при хората не са окончателно определени. В този преглед ние се фокусираме предимно върху нови прозрения, които са възникнали от генетичните изследвания на човека. Неотдавнашното идентифициране на вариации на последователности, които са свързани с пълния спектър на NAFLD, вероятно ще предостави нови молекулярни улики за патогенезата на това все по-често срещано разстройство (5, 6).
Патогенезата на чернодробната стеатоза при хората
Чернодробната стеатоза възниква от дисбаланс между придобиването и отстраняването на TG. TG се сглобяват чрез свързване на три мастни киселини към глицеринов скелет чрез естерни връзки. Както е показано на фиг. 2, мастните киселини, използвани за образуване на чернодробен TG, се получават от три източника: (i) диета, (ii) de novo синтез и (iii) мастна тъкан. Хранителните мазнини, поети в червата, се пакетират в богати на TG хиломикрони и се доставят в системната циркулация. При плъхове,
80% от TG в хиломикроните се хидролизира от липопротеин липаза (LPL), освобождавайки свободни мастни киселини (FFA) за поемане от периферните тъкани. Останалото
20% се доставят в черния дроб (7). Екстраполирайки се от тези експерименти, типична американска диета (100 g мазнини на ден) снабдява черния дроб с
20 g мазнини всеки ден, което се равнява на половината от общото съдържание на TG в средния черен дроб.
Метаболизъм на TG в черния дроб. Трите основни източника на FFA са диета, ендогенен синтез и периферни тъкани. FFA имат четири възможни съдби. Те могат да се метаболизират чрез β окисление (β-OX) в митохондриите, естерифицират се и се съхраняват като TG в липидни капчици, използват се за образуване на други липиди (не са показани) или се пакетират с апоВ във VLDL и се секретират в кръвта. Процесите, които увеличават FFA и TG входа или намаляват FFA и TG изхода, причиняват чернодробна стеатоза. Приемът на въглехидрати увеличава нивата на глюкоза и инсулин, които активират два транскрипционни фактора в черния дроб, които насърчават de novo липогенезата: ChREBP и SREBP-1c. Инсулинът инхибира липолизата в мастната тъкан чрез потискане на ATGL. Chylo, хиломикрон; TCA, трикарбоксилна киселина.
Храненето с въглехидрати насърчава de novo синтеза на FFA от ацетил-коензим А (CoA) (фиг. 2) чрез повишаване нивото на инсулин и наличието на субстрат. Инсулинът стимулира транскрипционния фактор стерол-регулаторен елемент-свързващ протеин-1c (SREBP-1c) чрез сигнална каскада, включваща AKT2, LXR и mTOR (8). SREBP-1c нагоре регулира ензимите, които катализират липогенезата (9). Глюкозата също така насърчава липогенезата чрез активиране на транскрипционния фактор, отговарящ на въглехидратите, свързващ елемент протеин (ChREBP) (10). Подобно на SREBP-1c, ChREBP стимулира експресията на множество гени в биосинтетичния път на мастните киселини. В допълнение, ChREBP увеличава експресията на пируват киназа от чернодробен тип, като по този начин осигурява повече субстрат за синтез на FFA и TG (10).
По време на гладно плазмените нива на инсулин падат, докато нивата на глюкагон и епинефрин се повишават, стимулирайки хидролизата на TG в адипоцитите (фиг. 2). Първият етап в хидролизата на TG се катализира от адипоцитна TG хидролаза (ATGL) (11). FFAs се освобождават и транспортират до черния дроб, предимно свързани с албумин. FFA в черния дроб имат три основни съдби: Те могат да бъдат окислени в митохондриите, за да произведат енергия и кетонни тела, реестерифицирани до TG и съхранявани в липидни капчици, или свързани с аполипопротеини и секретирани като съставна част на липопротеините с много ниска плътност (VLDL). FFA в черния дроб също се включват във фосфолипиди и други липиди. Потокът на FFA през циркулацията възлиза на
100 g/ден, като 20% се извличат от черния дроб. По този начин дневният принос на TG от диетата (
20 g/ден) и FFA от мастна тъкан (
20 g/ден) се доближава до цялото съдържание на TG в черния дроб.
Изследванията на хора с редки наследствени нарушения показват, че нарастването на чернодробната TG от увеличен хранителен прием, преразпределяне на TG от мастна тъкан към черния дроб или повишена de novo липогенеза води до чернодробна стеатоза (12). Вродената генерализирана липодистрофия неизменно се свързва с тежка чернодробна стеатоза (12). Болестта за съхранение на гликоген тип 1а и дефицитът на цитрин водят до засилена de novo липогенеза и причиняват масивна чернодробна стеатоза дори при липса на затлъстяване или инсулинова резистентност (13, 14). Недостигът на цитрин се причинява от мутации в митохондриалния аспартат-глутамат транспортер. Инактивирането на този транспортер ускорява обмена на малат-цитрат, което води до увеличаване на цитоплазмения цитрат, който се превръща в ацетил-КоА.
Генетични дефекти, които предотвратяват отстраняването на TG от черния дроб, също причиняват стеатоза. Мутациите в ATGL или неговия кофактор, сравнителна идентификация на гена-58 (CGI-58), предотвратяват мобилизирането на FFA от липидни капчици (Фиг. 2). Дефектите в ензимите, необходими за окисляване на FFA в митохондриите (хидроксиацил-CoA трансферазите), също причиняват чернодробна стеатоза (12). Основният износен път за чернодробните TG е секрецията в кръвта като VLDL (фиг. 2). Мутациите в структурния протеин на VLDL [аполипопротеин (апо) В] или в протеина, който добавя TG към зараждащата се липопротеинова частица в ендоплазмения ретикулум (ER) (микрозомален TG трансферен протеин, MTTP) са допълнителни причини за чернодробна стеатоза. Индивидите, хетерозиготни за инактивиране на мутации в APOB, произвеждат по-малко VLDL частици и имат трикратно увеличение на чернодробния TG спрямо здрави индивиди (15).
Каква е връзката между затлъстяването, инсулиновата резистентност и чернодробната стеатоза?
Констатацията, че генетичните заболявания, които насърчават притока на енергийни субстрати към мастни киселини, като заболяване за съхранение на гликоген тип 1а и дефицит на цитрин, причиняват стеатоза дори при липса на инсулинова резистентност, показва, че увеличеният поток на FFA към черния дроб е достатъчен, за да причини стеатоза ( 13, 14). При затлъстели индивиди увеличеното снабдяване с FFA в черния дроб от диетата, от мастната тъкан и чрез повишена de novo липогенеза, всички служат за насърчаване на чернодробната стеатоза. Относителният принос на трите пътя към чернодробната стеатоза при хората е определен само в едно проучване: Donnelly et al. (18) съобщава, че 59% от чернодробните мазнини се получават от циркулиращи FFAs, с по-малък принос от липогенезата de novo (26%) и диетата (15%).
Основен нерешен въпрос е дали NAFLD е причина или последица от инсулиновата резистентност. В черния дроб инсулинът инхибира производството на глюкоза и насърчава синтеза на мастни киселини. С развитието на чернодробна инсулинова резистентност инхибиторният ефект на инсулина върху производството на глюкоза намалява, докато стимулиращият ефект на инсулина върху липогенезата се запазва (19). Инсулиновата резистентност е силно свързана със стеатозата и интервенциите, които подобряват инсулиновата резистентност, водят до по-ниски нива на инсулин и намалено съдържание на мазнини в черния дроб. Множество животински модели поддържат пряка причинно-следствена връзка между инсулинова резистентност, хиперинсулинемия и чернодробна стеатоза (4). Доказателствата, че инсулиновата резистентност причинява стеатоза при хората, произтичат от пациенти с мутации в AKT2 (20). Тези пациенти имат дълбока резистентност към глюкорегулаторните действия на инсулина, но вероятно запазват чувствителност към липогенните ефекти на хормона. Изследванията на метастатични инсулиносекретиращи тумори (инсулиноми) и от трансплантации на панкреатични островни клетки предоставят допълнителни доказателства, че инсулинът пряко насърчава натрупването на мазнини в чернодробните клетки. Хепатоцитите, заобикалящи метастатичните инсулиноми, се натрупват с TG, както и хепатоцитите, заобикалящи трансплантирани островни клетки (21).
Съвпадението на чернодробна стеатоза и инсулинова резистентност доведе до хипотезата, че излишъкът на TG в черния дроб причинява инсулинова резистентност. Чернодробната стеатоза и инсулиновата резистентност се срещат заедно при няколко щама на генетично модифицирани мишки (4, 22). Представата, че чернодробната стеатоза причинява инсулинова резистентност, обаче е в противоречие с наблюдения при мишки с дефекти в различни пътища, които причиняват чернодробна стеатоза без инсулинова резистентност. Мишките с намален синтез на мастни киселини (23), мобилизация (24) или окисление (4), както и дефектна цитокинова сигнализация (25) или синтез на холин (26), поддържат нормална или подобрена инсулинова чувствителност въпреки натрупването на TG в черния дроб. TG може да бъде маркер за друга молекула, която пречи на инсулиновото действие, като диацилглицерол (DAG), дълговерижен ацил-КоА или керамид. Въпреки това, чернодробното натрупване на който и да е от тези липиди не произвежда неизменно инсулинова резистентност, поне при мишки [за преглед вж. (22)]. Остава възможно тези липиди да допринасят за инсулинова резистентност само ако се натрупват в специфични субклетъчни отделения или ако имат определен набор от мастни киселини.
При хората естествените мутации предоставят мощен инструмент за разплитане на механистичните връзки между силно корелиращите метаболитни черти. Ако повишеното съдържание на TG в черния дроб причинява инсулинова резистентност, тогава хората с генетични варианти, които насърчават чернодробната стеатоза, трябва да бъдат изложени на повишен риск от развитие на инсулинова резистентност. Все по-голям брой менделови генетични дефекти разединяват тези две променливи. Хората с инактивиращи мутации в APOB имат повишени нива на чернодробна TG, но поддържат нормална инсулинова чувствителност (15). Пациентите с автозомно-рецесивни нарушения, причинени от мутации или в ATGL, или в CGI58, имат тежка стеатоза, но не са резистентни към инсулин [прегледано в (12)]. В популационни проучвания генетичен вариант на PNPLA3, който е свързан с чернодробна стеатоза, не е свързан с инсулинова резистентност (вж. По-долу) (5). Варианти на последователност в APOC3 са свързани както с чернодробна стеатоза, така и с инсулинова резистентност (25), но тази връзка не е наблюдавана при други независими популации (26, 27). По този начин преобладаването на доказателства не е съвместимо с хипотезата, че натрупването на TG в хепатоцитите причинява инсулинова резистентност при хората.
Генетични рискови фактори за чернодробна стеатоза
Въпреки че затлъстяването и инсулиновата резистентност са най-разпространените рискови фактори за NAFLD, съдържанието на чернодробна мазнина варира значително при лица с еквивалентно затлъстяване, което показва, че други фактори допринасят за това състояние. Един от тези фактори е полът. Преди 60-годишна възраст мъжете са значително по-склонни да развият стеатоза, отколкото жените (16), но в по-напреднала възраст разстройството е по-разпространено при жените. Причини за този пол диморфизъм не са известни. Друг фактор е етническата принадлежност. В Далаското сърдечно проучване чернодробна стеатоза е открита при 45% от испанците, 33% от индивидите с европейски произход и 24% от афро-американците (16). По-високото разпространение на чернодробната стеатоза при испанците се дължи отчасти на по-голямото разпространение на затлъстяването и инсулиновата резистентност в тази популация, но по-ниското разпространение при афро-американците не може да се обясни с етнически разлики в ИТМ, инсулинова резистентност, поглъщане на етанол или употреба на лекарства . Друга етническа група с повишено разпространение на чернодробната стеатоза са азиатските индианци. Изследване на 482 слаби млади индивида разкрива двойно по-високо съдържание на TG в азиатските индианци, отколкото мъжете от европейски произход (28).
Чернодробна стеатоза, NASH и цироза в семейства (29), като наследствеността на NAFLD се оценява като
39% (30). Един генетичен вариант, който е последователно свързан с NAFLD, е мисенс мутация [Ile 148 → Met 148 (I148M)] в съдържащ пататин подобен фосфолипазен домен (PNPLA) 3 ген PNPLA3 (наричан още адипонутрин) (5). Този вариант първоначално е идентифициран чрез проучване за асоцииране на 9299 несинонимни вариации на последователността и връзката със съдържанието на чернодробна TG е потвърдена в много независими проучвания [за преглед, виж (31)]. Честотата на варианта на чувствителност (PNPLA3-148M) в етническите групи отразява разпространението на NAFLD и отчита
70% от разликите в честотата на чернодробната стеатоза между испанците, афроамериканците и индивидите от европейски произход (5). Хомозиготите за алела на риска в PNPLA3 (MM) имат a
двойно по-високо съдържание на TG в черния дроб, въпреки че степента на ефекта е силно повлияна от затлъстяване и чувствителност към инсулин.
PNPLA3 е член на семейството PNPLA, най-много приличащ на ATGL (PNPLA2) (фиг. 2) (11). PNPLA3 е най-силно експресиран в мастната тъкан и черния дроб и се транскрипционно регулира от инсулин чрез сигнална каскада, която включва LXR и SREBP-1c; чернодробните нива на PNPLA3 иРНК се намаляват до почти неоткриваеми нива по време на гладуване и се увеличават 80 пъти с повторно хранене при мишки (32). Над 90% от PNPLA3 в хепатоцитите се намира в липидни капчици, които са специализирани органели, които участват в разделяне на протеини, трафик и разграждане [за преглед вж. (33)].
Физиологичната роля на PNPLA3 и механизмът, чрез който изоформата I148M причинява затлъстяване на черния дроб, не са известни. Пречистеният протеин има както TG хидролазна, така и трансацилазна активност (34, 35). Заместването I148M значително намалява активността на TG хидролазата in vitro (35), което предполага, че заместването I148M причинява загуба на функция. Въпреки това, инактивирането на Pnpla3 при мишки не успява да увеличи съдържанието на чернодробен TG (36, 37), а аденовирусната медиирана свръхекспресия на PNPLA3-I148M в черния дроб на мишка причинява повишаване на чернодробното съдържание на TG (35), което е по-съвместимо със заместването на I148M предоставяне на печалба от функция. Ще бъдат необходими допълнителни проучвания за определяне на молекулярния механизъм, чрез който варирането в PNPLA3 придава чувствителност към NAFLD.
Неотдавнашно геномно проучване за асоцииране на чернодробна стеатоза при 7176 участници (6) разкри допълнителни локуси на чувствителност към NAFLD. Изненадващо, нито един от новоидентифицираните геномни интервали не съдържа гени, свързани с редки менделевски нарушения на чернодробната стеатоза, като APOB, ATGL, CGI-58 или гени, свързани с липодистрофия. Алелът с най-голям ефект е PNPLA3-I148M, който дава коефициент на шанс за NAFLD от 3.26. Другите геномни области, свързани с чернодробна стеатоза в това проучване, включват NCAN и PPP1R3B (Таблица 1). Анализ на независима кохорта с хистологично дефинирана NAFLD от същата група установява връзка с NCAN, GCKR и LYPLAL1, но не и с PPP1R3B, като коефициентите на шансовете варират от 1,37 (LYPLAL1) до 1,65 (NCAN). Алелите за загуба на функция в GCKR и PPP1R3B ще се предвиди да повишат нивата на глюкозо-6-фосфат и по този начин да стимулират синтеза на мастни киселини. Механистичната връзка между NAFLD и другите два замесени гена, NCAN и LYPLAL1, остава да бъде дефинирана. Изясняването на ролята на тези гени може да даде нови прозрения за метаболитните пътища, които допринасят за често срещаните форми на NAFLD в популацията.
маса 1
Често срещани варианти, свързани с нехалечна мастна чернодробна болест. Съотношенията на шансовете за NAFLD са изчислени чрез използване на случаи с доказана биопсия NAFLD и в контролите, съвпадащи с предците (6). EA, европейски американец; АА, афроамериканец; ND, не е определено.
- Високата консумация на протеини намалява мастните чернодробни заболявания, диабет тип 2
- Списък на безалкохолните мастни чернодробни лекарства (11 сравнени)
- Липотоксичност и стеатохепатит в модел на прехранена мишка за безалкохолна мастна чернодробна болест -
- Повече протеини след загуба на тегло могат да намалят мастните чернодробни заболявания
- Повече протеини след загуба на тегло могат да намалят мастната чернодробна болест Повишено протеин по време на тегло