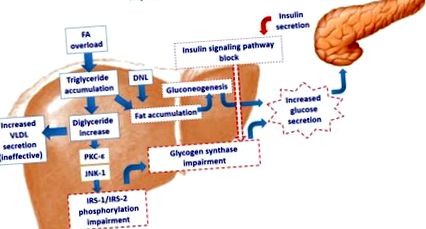
Претоварването с мастни киселини в хепатоцита активира протеин киназата c-epsilon (PKC-ε) и/или c-Jun N-терминалната киназа (JNK-1), с последващо увреждане на фосфорилирането на инсулиновия рецепторен субстрат (IRS) -1 и IRS-2. Това води до увреждане на инсулиновия сигнален път. Намаленото действие на инсулина върху гликоген синтазата предизвиква повишена секреция на глюкоза. И все пак натрупването на мазнини стимулира неоглюкогенезата, като допълнително увеличава чернодробната секреция на глюкоза. Опитът на хепатоцитите да изхвърли прекомерното натрупване на триглицериди чрез повишена секреция на VLDL е неефективен, като допълнително допринася за натрупване на чернодробна мазнина. DNL: de novo липогенеза.
Излишното натрупване на мазнини насърчава повишената „de novo липогенеза“ (DNL) и бета-окисляването на мастните киселини (FA). Тези механизми водят до генериране на реактивни кислородни видове (ROS), което индуцира оксидативно увреждане на митохондриите и стрес на ендоплазмения ретикулум (ER). Успоредно с това, натрупването на свободен (неестерифициран) холестерол и керамиди усилва както митохондриалната дисфункция, така и ER стрес и предизвиква активирането на звездни клетки, както и на клетки на Купфер, като по този начин насърчава възпалението и фиброзата. Освен това, тумор некротизиращият фактор алфа (TNFα) и интерлевкин-6 (IL-6) от мастната тъкан усилват възпалителния процес и насърчават натрупването на церамид, допринасяйки за инсулинова резистентност по различни пътища. В крайна сметка тези събития задействат апоптотичния път на хепатоцитите, което води до клетъчна смърт. ПКК: протеин киназа; CJNK-IRS: субстрат на N-терминален N-краен киназа-инсулинов рецептор; PP2A: Протеин фосфатаза 2А.
Резюме
Претоварването с мастни киселини в хепатоцита активира протеин киназата c-epsilon (PKC-ε) и/или c-Jun N-терминалната киназа (JNK-1), с последващо увреждане на фосфорилирането на инсулиновия рецепторен субстрат (IRS) -1 и IRS-2. Това води до увреждане на инсулиновия сигнален път. Намаленото действие на инсулина върху гликоген синтазата предизвиква повишена секреция на глюкоза. И все пак натрупването на мазнини стимулира неоглюкогенезата, като допълнително увеличава чернодробната секреция на глюкоза. Опитът на хепатоцитите да изхвърли прекомерното натрупване на триглицериди чрез повишена секреция на VLDL е неефективен, като допълнително допринася за натрупване на чернодробна мазнина. DNL: липогенеза de novo.
Излишното натрупване на мазнини насърчава повишената „de novo липогенеза“ (DNL) и бета-окисляването на мастните киселини (FA). Тези механизми водят до генериране на реактивни кислородни видове (ROS), което индуцира оксидативно увреждане на митохондриите и стрес на ендоплазмения ретикулум (ER). Успоредно с това, натрупването на свободен (неестерифициран) холестерол и керамиди усилва както митохондриалната дисфункция, така и ER стрес и предизвиква активирането на звездни клетки, както и на клетки на Купфер, като по този начин насърчава възпалението и фиброзата. Освен това, тумор некротизиращият фактор алфа (TNFα) и интерлевкин-6 (IL-6) от мастната тъкан усилват възпалителния процес и насърчават натрупването на церамид, допринасяйки за инсулинова резистентност по различни пътища. В крайна сметка тези събития задействат апоптотичния път на хепатоцитите, което води до клетъчна смърт. ПКК: протеин киназа; CJNK-IRS: субстрат на N-терминален N-краен киназа-инсулинов рецептор; PP2A: Протеин фосфатаза 2А.
- Детски безплатни пълнотекстови педиатрични затлъстели черен дроб и затлъстяване Не винаги е въпрос на безалкохолно
- Централна роля на мастния черен дроб в патогенезата на инсулиновата резистентност при затлъстяващи юноши
- Затлъстяване на черния дроб Преминаване между липидните видове - Европейски медицински вестник
- Нарушения на метаболизма на липидите и липопротеините - общ преглед на ScienceDirect теми
- Център за мастни чернодробни заболявания - NYC ColumbiaDoctors Детско здраве