Мишел Д. Марко
1 Катедра по биология, Concordia College, Moorhead, MN, САЩ
Джейсън С. Уайт
2 Катедра по аналитична химия, Селскостопанска експериментална станция в Кънектикът, Ню Хейвън, CT, САЩ
Свързани данни
Резюме
Въведение
Евразийско водно фолио [Myriophyllum spicatum L. (Haloragaceae); оттук нататък, milfoil] е сред най-широко разпространените и агресивни инвазивни водни растения в Северна Америка (Smith и Barko, 1990). Местният ареал на M. spicatum е в цяла Азия, Европа и части от Африка; въпреки че сегашното му разпространение включва 48 щата на Съединените щати, както и големи части от Канада (EDDMapS, 2015). Този широк диапазон всъщност е доста забележителен; изглежда растението расте също толкова добре след презимуване под леда в Нова Англия, колкото и през годината на вегетация на юг. Milfoil е потопен, вкоренен многогодишен двусемеделен растение, който обикновено се среща на средна дълбочина на водата от 0,5-3,5 m. Веднъж въведен във водно тяло, M. spicatum често расте, за да образува плътни насаждения, които превъзхождат местните растения (Smith и Barko, 1990; Madsen et al., 1991). Леглата на M. spicatum също могат да възпрепятстват корабоплаването по водните пътища и правят лодката и плуването опасни. Документирани са и преки отрицателни въздействия върху популациите на птици и риби (Aiken, 1979; Madsen et al., 1995; Schultz and Dibble, 2012; Simbanegavi et al., 2018). Размножаването на M. spicatum е предимно вегетативно, до голяма степен обяснява потенциала му за експлозивен прираст на популацията. Разпространението сред езерата може да се осъществи по различни начини, включително хлабава растителност, прикрепена към лодки/ремаркета, и фрагменти, пренасяни от птичи видове, допълнително застрашаващи местните растителни популации (Madsen et al., 1988).
Също така има голям интерес към възможностите за биологичен контрол на инвазивни водни растения като M. spicatum (Reeves et al., 2008; Havel et al., 2017). Три насекоми са свързани с намаляване на популациите на M. spicatum (вж. Рецензия от Newman, 2004). Доказано е, че Cricotopus myriophylli Oliver (Diptera: Chironomidae) консумира меристеми на M. spicatum и потиска растежа. Доказано е, че Acentria ephemerella (Denis и Schiffermüller) (Lepidoptera: Pyralidae) намалява биомасата на M. spicatum в експерименти с мезокосмос и е свързана с драстично намаляване на биомасата на M. spicatum в езерата в Ню Йорк (Johnson et al., 2000; Gross et al. ., 2001). Euhrychiopsis lecontei (Dietz) (Coleoptera: Curculionidae) може да контролира популациите на M. spicatum и е особено интересно, тъй като неотдавнашните проучвания показват, че дървесът всъщност предпочита инвазивния M. spicatum пред родния си гостоприемник (M. sibiricum Komarov) (Haloragaceae) (Solarz and Newman, 1996, 2001; Sheldon and Jones, 2001). Въпреки това, поради забавянето на времето за реакция на дълговете при увеличаване на популацията на M. spicatum, местното разнообразие може да бъде увредено и популациите от милфили могат да станат проблем.
Целта на настоящото проучване беше директно сравняване на въздействието на три различни възможности за лечение върху M. spicatum при контролирани условия. Два често прилагани системни хербицида, изброени за контрол на M. spicatum, 2,4-дихлорофеноксиоцетна киселина и флуридон, бяха сравнени с въведен биоконтролен агент, E. lecontei. Определено е въздействието на тези обработки върху биомасата от милфойл, както и специфичното за тъканите съдържание на полифеноли, въглехидрати, нишесте, пепел и въглерод: азот. Преди това не е извършвано пряко сравнение на въздействието на милфолията с хербициди в контролирана среда. Това сравнение е важна част от определянето на оптималните средства за контрол с цел намаляване на употребата на хербициди и насърчаване на дългосрочното планиране и възстановяване.
Материали и методи
Дизайн на микрокосмоса
Експериментални резервоари за микрокосмос бяха създадени във фермата Lockwood в Хамдън, Тексас, САЩ. Шестнадесет 387 L (132 cm × 69 cm × 71 cm, L × W × H) резервоари (Rubbermaid) бяха подредени в произволен блок. Всеки резервоар беше поправен с 32 пластмасови саксии (10,5 cm × 10,5 cm × 11 cm), съдържащи смес от езерни утайки/земеделски глинести (50:50). Дехлорирана чешмяна вода бавно се добавя на дълбочина 30 cm. M. spicatum, събрана от езерото Кунипог, Гилфорд, CT, САЩ (Lat. 41.388923 °, Lon. -72.698632 °), е инспектирана за повреди, почистена от безгръбначни, нарязана на 20 см дължина и засадена с плътност от четири стъбла на гърне. Растенията се оставят да се вкоренят и установят за около 3 седмици. Плаващите или неустановените стъбла се подменяха ежедневно. По време на експеримента растежът на водорасли е минимален, но при необходимост се отстранява от резервоарите на ръка. Нивата на водата се поддържат в резервоари на приблизително 60 cm или приблизително 350 L.
Експериментален дизайн
В нашата лаборатория приблизително 1 месец преди лечението са установени култури от милфолиовия дългоносител E. lecontei, събрани от Dooley Pond, Middletown, CT, САЩ (Lat. 41.5116712 °, Lon. -72.6679638 °). За да се постигне желаната плътност от 1-2 лъжички на стъбло, за които е известно, че контролират M. spicatum (Newman, 2004), към всеки резервоар се добавят десет възрастни дългоноси (поне пет женски) и се оставят да яйцеклетки за 10-14 дни. Меристемите на M. spicatum се инспектират ежедневно, за да се постигне крайната плътност от 1-2 яйца на стъбло. Плеверите обикновено излизат от какавидацията след около 25 дни (Mazzei et al., 1999); популациите се наблюдават през следващите 40 дни.
Въпреки внимателната проверка и отстраняване на безгръбначните в началото на експеримента, някои безгръбначни са останали върху растенията или в събраната утайка. Следователно щетите от дългоносици, заедно с характерни щети от други безгръбначни, като охлюви, кадифили, A. ephemerella и Paraponyx sp. бе отбелязано. Наличието и увреждането на безгръбначните се определят чрез индивидуални инспекции на всички стъбла, събрани от всякакви лечения на всеки две седмици. Присъствието на зърна се изброява по етапа на живот (яйце, ларва, какавида, възрастен). Общото въздействие на дрънчака се оценява чрез наличие на някакъв жизнен етап или характерно увреждане на ларвите.
Растеж на растенията
На месечна база от всеки репликиран резервоар бяха избрани на случаен принцип поне два саксии с четири стъбла за определяне на биологични и химични параметри. За анализи бяха използвани средни стойности на резервоар. Биологичните параметри, които се наблюдават, включват плътност на дългите дървета, най-дългата дължина на стъблото (cm), най-дългата дължина на корена (cm), влажна и суха маса (mg), както и определяне на броя на меристемите на растение. Растенията бяха разделени на растителни части: горните 15 см („върхове“), останалата надземна част („средата“) и корените. При анализите на биомаса надземните части (върховете и средата) се комбинират като обработки на земята.
Химичен анализ на растенията
Растенията се разделят на части (върхове, средата и корените), лиофилизират се, смилат се на фин прах с кафемелачка (Braun) или хоросан и пестик и се претеглят за химически анализи. Химичните анализи включват определяне на процентния състав на въглерода, азота и елементарното съотношение въглерод: азот, въглехидрати, нишесте, органични вещества, полифеноли и пепел. Стъблата на Milfoil са анализирани за съдържание на въглерод и азот с PerkinElmer Series II, CHN/O Analyzer 2400 (Norwalk, CT, САЩ). Моларните съотношения на C: N бяха изчислени и използвани при статистически анализи. Общите фенолни съединения (TPC) бяха определени с анализа на Folin-Ciocalteau, използвайки танинова киселина като стандарт (Bowyer et al., 1983). Резултатите бяха изразени като еквиваленти на танинова киселина на базата на суха маса (TAE). Съдържанието на въглехидрати и нишесте се определя чрез разграждане на тъканите, последвано от HPLC анализ съгласно метода на Gent (1984); за въглехидратите обаче скоростта на потока е модифицирана до 0,6 ml/min. Концентрациите на глюкоза, фруктоза и захароза се измерват отделно и се сумират за концентрациите на въглехидрати. Съдържанието на пепел се определя чрез определяне на масата на суха проба от растението преди и след нагряване при 350 ° С в продължение на 24 часа.
Хербициден анализ
Количество на хербицидите
Статистически анализ
Данните бяха анализирани със SAS 9.1 (SAS Institute Inc., Cary, NC, САЩ). Данните за биомасата на Milfoil бяха тествани за нормално разпределение (K-S тест или тест на Shapiro-Wilk) и дисперсионна хомогенност (тест на Levene’s). Премахнати бяха крайни крайни стойности. Проведена е дневна трансформация с данни за биомаса, които не отговарят на тестовете за нормалност и хомогенност. Променливите на отговора бяха анализирани отделно по част от растението. Статистическите разлики бяха определени чрез двупосочна ANOVA (GLM процедура), като се използва лечение, дата на събиране (DAT, дни след лечението) и лечение чрез DAT взаимодействие. Когато датата е значително различна, променливите на отговора се анализират отделно чрез лечение за всеки DAT. Третираните 2,4-D растения бяха мъртви при последното събиране на растения и бяха изключени от анализи на проби при окончателното събиране. Присъствието на охлюви и кадифи се оценява с помощта на логаритарен модел (процедура GENMOD, разпределение на отровите) с дата на третиране и събиране като обяснителни променливи.
Резултати
Ефективност на лечението
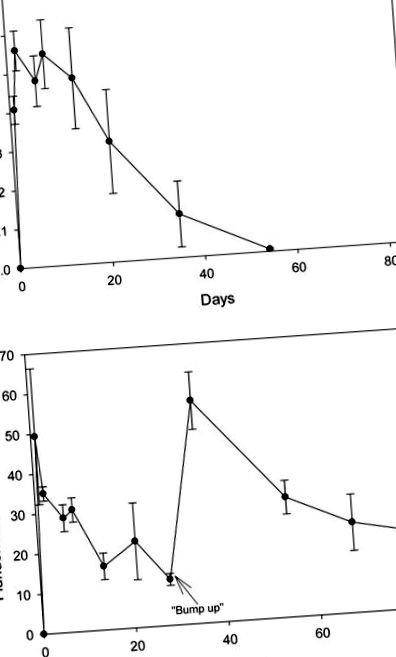
Възстановяването на 2,4-D и флуридон с вода чрез SPE е съответно 103 ± 5,16% и 135 ± 13,6%. Както пробите с контролна вода, които не са добавени, така и пробите за вода от резервоара за предварителна обработка имат неоткриваеми нива на хербицидите. Един ден след приложението, нивата на 2,4-D са 0.41 mg/L; на осмия ден концентрацията беше 0,55 mg/L и впоследствие започна да намалява (Фигура (Фигура 1А). 1А). Към 53-ия ден нивата бяха само малко над границите на откриване. Един ден след приложението, концентрацията на флуридон достига 49 μg/L, но постепенно намалява до 12 μg/L на ден 28, в който момент се добавя допълнителен флуридон (Фигура (Фигура 1В). 1В). Към 38-ия ден концентрацията се е повишила до 56 μg/L и постепенно намалява до 19 μg/L до ден 84. Има неоткриваеми нива както на хербицидите във водата от контролни, така и от резервоари за дървесни чаши.
(А) Концентрация на 2,4-D (Navigate ®) във водата от резервоари, третирани с хербицида на 24.07.2007 г. (Б) Концентрация на флуридон (Sonar TM) във водата от резервоари, третирани с хербицида на 24.07.2007 г. Остатъците от флуридон са измерени след редовния експеримент, за да се гарантира, че дозата се поддържа поне 60 дни.
Нито хербицид не е открит в проби от утайки, взети през периода на експозиция. Освен това 2,4-D не е открит в нито една от събраната растителност. Флуридон е открит в проби от растителност, събрани 14 и 48 дни след третирането. Средната концентрация на флуридон (сухо тегло) в събраните издънки и корени на милфоли е била съответно 31,8 (± 20,3, ± 1 стандартно отклонение) ng/g (сухо тегло) и 14,3 (± 20,3, ± SD) ng/g (сухо тегло) . Нямаше значителни разлики в съдържанието на флуридон в корена или летораста между двата периода на вземане на проби.
Стабилни популации от E. lecontei, образувани във всички инокулирани резервоари, достигащи целевата плътност от 2 дръвника/стъбло (2,08 ± 0,376, средно ± 1 SE). По време на експеримента охлювите бяха открити във всички резервоари в малък брой (0,49 ± 0,12) и не се различаваха значително по отношение на третирането или датата след третирането (χ 2 = 121,5, df = 131, P> 0,1). Caddflies са открити в много резервоари и са извадени при ежедневни инспекции (0,12 ± 0,012) и не се различават съществено по лечение или дата след третирането (χ 2 = 56,4, df = 131, P> 0,1).
Растеж на растенията
Таблица 2
F-стойности на двупосочните ANOVA при лечение, DAT и тяхното взаимодействие като фактори за химичните параметри на M. spicatum.
| ° С | 10,89 ∗∗ | 1.72 | 3,78 ∗∗ | 1.28 | 0,85 | 1.45 | 1.87 | 1,65 | 0,47 |
| н | 2.65 | 2.09 | 1.04 | 1.41 | 10.27 ∗∗∗ | 0,72 | 1.07 | 2.00 | 2.00 |
| C: N | 5,85 ∗ | 7,34 ∗∗ | 2.10 | 1.57 | 14,55 ∗∗∗ | 1.05 | 0,97 | 0,72 | 1.03 |
| Пепел и органични продукти | 1.07 | 5.47 ∗ | 0,43 | 1.10 | 8,61 ∗∗ | 3,20 ∗ | Размерът на пробата е твърде малък | ||
| Въглехидрати | 3,87 ∗ | 2.67 | 8,96 ∗∗∗ | 18,52 ∗∗∗ | 2.11 | 31,58 ∗∗∗ | 9,31 ∗∗ | 12,83 ∗∗∗ | 2.52 ∗ |
| Нишесте | 9,65 * | 15,71 ∗∗∗ | 5,82 ∗∗∗ | 23.32 ∗∗∗ | 24.27 ∗∗∗ | 5.73 ∗∗∗ | 4.21 ∗ | 20,98 ∗∗∗ | 6,32 ∗∗∗ |
| Феноли | 1.98 | 8.18 ∗∗∗ | 2.88 ∗ | 1.29 | 2.48 | 0,77 | 2.98 | 2.02 | 0,64 |
ТАБЛИЦА S1
F-стойности на двупосочните ANOVA при лечение, DAT и тяхното взаимодействие като фактори за химичните параметри на M. spicatum.
- Гранични преки сравнения на хербицидно или биологично лечение при контрол на Myriophyllum spicatum
- Сравнение на лечението на запек с Chang Run Tong и Forlaxin при пациенти в старческа възраст с диабет
- Билкова акупунктура за лечение на затлъстяване - тема на изследователска работа в биологичните науки
- Компулсивно преяждане (разстройство на преяждането) Симптоми, лечение и причини за
- Повишени чернодробни ензими Причини, симптоми, тестове и лечение