Резюме
ОБЕКТИВЕН
Метформин предизвиква загуба на тегло и забавя или предотвратява диабета в Програмата за профилактика на диабета (DPP). Изследвахме неговата дългосрочна безопасност и поносимост заедно със загуба на тегло и промяна в обиколката на талията по време на DPP и дългосрочното му проследяване.
ПРОЕКТИРАНЕ И МЕТОДИ НА ИЗСЛЕДВАНИЯТА
Рандомизираното двойно-сляпо клинично изпитване на метформин или плацебо, последвано от 7-8-годишно отворено удължаване и анализ на нежеланите събития, поносимостта и ефекта от придържането върху промяната в теглото и обиколката на талията.
РЕЗУЛТАТИ
Не са установени значителни проблеми с безопасността. Стомашно-чревните симптоми са по-чести при метформин, отколкото при участниците в плацебо и намаляват с течение на времето. По време на DPP средните нива на хемоглобин и хематокрит са малко по-ниски в групата на метформин, отколкото в групата на плацебо. Намаляване на хемоглобина и хематокрита в групата на метформин е настъпило през първата година след рандомизацията, без да се наблюдават допълнителни промени с течение на времето. По време на DPP участниците в метформин имат намалено телесно тегло и обиколка на талията в сравнение с плацебо (тегло с 2,06 ± 5,65% срещу 0,02 ± 5,52%, P 2 (≥22 kg/m 2 при азиатски американци), повишена глюкоза на гладно (95– 125 mg/dL) и нарушен глюкозен толеранс (140–199 mg/dL) 2 часа след орално натоварване от 75 g. Участниците бяха изключени за предварителна диагноза на диабет или състояния или лекарства, които биха нарушили способността им да участват или влияят върху загубата на тегло. Всички участници са дали писмено информирано съгласие, одобрено от всеки институционален съвет за преглед.
Метформин или съответстващо плацебо се започва с 850 mg веднъж дневно и се увеличава с 1 месец до 850 mg два пъти дневно, освен ако стомашно-чревните симптоми не налагат по-дълъг период на титриране. Ежегодно се предоставяха стандартни препоръки за начина на живот и писмена информация за здравословното хранене, здравословното тегло и физическата активност (4). Мениджърите на случаи насърчават придържането към лекарствата за изследване на DPP, използвайки кратко структурирано интервю и стандартен подход за решаване на проблеми.
Първата фаза на DPP е завършена през 2001 г. след средно 3,2 години проследяване по съвет на Съвета за мониторинг на данните и безопасността поради ефективността на начина на живот и метформин за предотвратяване на диабет (4). След обявяването на резултатите от DPP участниците преминаха 1- до 2-седмично проучване/период на измиване на лекарството, последвано от повторен тест за толерантност към глюкоза (9). Впоследствие те бяха разплетени и предложиха 6-месечна, 16-сесийна, групово внедрена програма със съдържание, идентично на оригиналната намеса за начин на живот на DPP (10). Всички участници в DPP, независимо дали се е развил диабет, бяха насърчени да се присъединят към DPPOS и 88% го направиха (6). Участниците следваха първоначалните си лечебни задачи и на всички бяха предложени тримесечни групови класове за начин на живот. Плацебо лечението е прекратено. Участниците, първоначално назначени на метформин, продължиха да приемат открит метформин, освен ако няма противопоказания или плазмената глюкоза на гладно е ≥140 mg/dL в DPP или HbA1c е ≥7% по време на DPPOS, което изисква управление извън протокола.
Обобщение на събирането на данни по време на DPP и DPPOS може да се намери в Допълнителна таблица на допълнение 1. Нежеланите събития бяха установени, както следва: 1) По време на DPP, но не и на DPPOS, всички участници в проучването бяха запитвани на всяко тримесечие, като питаха „По време на интервала от последното посещение има ли участникът някакви нови симптоми, наранявания, заболявания или странични ефекти или влошаване на вече съществуващи състояния? " Отговорите бяха кодирани с помощта на системата за кодиране на COSTART (Кодиращи символи за Тезаурус на условията за нежелани реакции) на Американската администрация по храните и лекарствата (FDA). Възможни хипогликемични събития бяха идентифицирани чрез търсене на „ХИПОГЛИЯ“, „СЪЗНАНИЕ“ и „КОМА“ и за възможна анемия като „АНЕМИЯ“ или „В12“. Сериозните нежелани събития (SAE) бяха третирани, както е определено от FDA. 2) Стомашно-чревни симптоми се идентифицират ежегодно по време на DPP и DPPOS, като се пита участниците за всяка болка в стомаха, подуване на корема, гадене, диария или загуба на апетит. 3) Стомашно-чревни симптоми, приписвани на изследваното лекарство, са установени по време на DPP и за тези участници, които активно приемат метформин по време на DPPOS.
Теглото се измерва два пъти годишно и обиколката на талията годишно (4,8). Хемоглобинът и хематокритът се измерват ежегодно във всяка лаборатория на всяка клиника на всички участници, рандомизирани на лекарства по време на DPP и на участници, които активно приемат метформин по време на DPPOS. Ниският хематокрит е определен като таблица 1). Участниците бяха цензурирани от групата за придържане към метформин, когато доставеният от проучването метформин беше преустановен поради неконтролирана хипергликемия и лечението на лекарства за диабет се управляваше извън протокола. Всички участници, различни от тези, които са цензурирани, бяха включени в мерките за придържане, независимо от причините за ниско придържане (напр. Безопасност или стандартни противопоказания), за да изследват изцяло излагането на метформин и загуба на тегло.
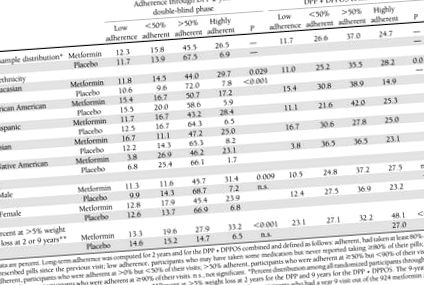
маса 1
Разпределение на придържането към метформин и плацебо като цяло и по раса/етническа принадлежност и пол по време на DPP (2 години) и за DPP + DPPOS комбинирано (9 години) и процент от участниците в DPP/DPPOS, постигнали над 5% загуба на тегло по време на всеки период от време
За оценка на дългосрочната безопасност и поносимост на метформин, всички посещения след диагностициране на диабета бяха изключени, за да се избегне объркване от лечението на диабета (напр. Чрез използване на непроучвани лекарства).
Модели с фиксирани ефекти с допускане на нормално разпределени грешки бяха използвани за изчисляване на коригирани средства за повтарящи се мерки в телесното тегло и обиколката на талията между категориите на придържане и групите на лечение. Моделите бяха коригирани спрямо базовото тегло и обиколката на талията (11). Използвани са обобщени уравнения за оценка за оценка на симптомите и нежеланите събития с течение на времето от групата на лечението (11).
РЕЗУЛТАТИ
DPP - резултат от фазата на двойно сляпо
Съобщени са характеристики на участниците в DPP (4). Делът на участниците, приемащи ≥80% от предписаната доза с течение на времето по време на DPP, е бил по-нисък при метформин (71%), отколкото при плацебо групата (77%) (Р Таблица 1). Мъжете са по-привързани към метформин по време на DPP, но не и през целия период на проследяване. Не са наблюдавани разлики между участниците в плацебо. В края на 1 година загубата на тегло в групата на метформин е била 2,7 ± 4,7% (средна стойност ± SD) в сравнение със загуба от 0,43 ± 4,7% в групата на плацебо (P Фигура 1 показва промени в телесното тегло и обиколката на талията във всяка група за лечение според придържането към хапчета по време на 2-годишната двойно-сляпа фаза. Седемдесет и два процента от групата на метформин и 74% от групата на плацебо са били в ≥50% привържени или силно придържащи се категории (Таблица 1), въпреки че по-малко участници в плацебо са силно придържащи се. Придържането е силно свързано със загуба на тегло в групата, лекувана с метформин. Трайността на загубата на тегло също се влияе от придържането. Средното тегло на силно придържащите се участници е 3,5 ± 0,35% под изходното ниво за 2 години, много близо до тяхната 1-годишна загуба на тегло. Тези с ниско придържане се бяха върнали към изходното тегло до 2-ра година (фиг. 1А) (P Таблица 1), с изключение на 7%, които бяха силно привързани към плацебо, които имаха малко наддаване на тегло от 1,2% (P 50% привързана група; всички останали P va лус> 0,05). Асоциациите на придържане към лекарства с промени в обиколката на талията не са статистически значими нито за метформин, нито за плацебо групи. (Фиг. 1C и D).
Ефект от придържането към метформин или плацебо върху процентното изменение на теглото (A и B) и промяната в обиколката на талията (C и D) по време на 2-годишно лечение по време на двойно-сляпата фаза на DPP.
Резултати, включително DPPOS - открито лечение
По време на целия период на проследяване 62% от участниците в метформин са били в ≥50% или силно придържащи се категории в сравнение със 72% във 2-годишната двойно-сляпа фаза (Таблица 1). Плацебо е прекратено, когато е започнала фазата на отворено етикетиране и не може да се определи спазването.
Самоотчитани стомашно-чревни (GI) проблеми (A) и стомашно-чревни симптоми, приписвани на изследваното лекарство (B) чрез DPP и DPPOS.
Не са установени неочаквани нежелани събития или различия в групите на лечение при нежелани събития, нито от Съвета за наблюдение на данните и безопасността на изследването, нито в този анализ. По-рано са докладвани нежелани събития по време на DPP (4). Честотата на стомашно-чревните симптоми е по-висока в групата на метформин. Несериозните нежелани събития за хипогликемия и анемия по време на DPP също са били необичайни и подобни при участниците в метформин и плацебо, като седем участници в метформин и осем участници в плацебо, които някога са съобщавали за хипогликемия, и петдесет участници в метформин и тридесет и осем участници в плацебо, които някога са съобщавали за анемия. SAE, потенциално свързани с изследваните лекарства, са редки. Има три доклада за SAE за анемия (два метформин и един участник в плацебо) и няма такива за лактатна ацидоза или хипогликемия по време на почти 18 000 пациент-години проследяване.
По време на DPP средните нива на хемоглобин и хематокрит са едни и същи в началото и с течение на времето са малко по-ниски в групата на метформин, отколкото в групата на плацебо (хемоглобин: 13,6 срещу 13,8 mg/dL; хематокрит: 40,6 срещу 41,1%; P 1; Sharon L. Edelstein, ScM 2; Jill P. Crandall, MD 3; Vanita R. Aroda, MD 4; Paul W. Franks, MD 5,6; Wilfred Fujimoto, MD 7; Edward Horton, MD 8; Susan Jeffries, BSN, MSN 9; Maria Montez, RN, MSHP, CDE, CCRA 10; Sunder Mudaliar, MD 11; F. Xavier Pi-Sunyer, MD 12; Neil H. White, MD 13; и William C. Knowler, MD, DrPH 14. .
От Биомедицинския изследователски център 1 Pennington, Батън Руж, Луизиана; 2 Центърът по биостатистика на университета Джордж Вашингтон, Роквил, Мериленд; 3 Медицински колеж „Алберт Айнщайн“, Бронкс, Ню Йорк; 4 Институт за здравни изследвания Medstar, Хаятсвил, Мериленд; Университетският център за диабет 5 в Лунд, Университетско училище в Сконе, Малмьо, Швеция; 6-то Харвардско училище за обществено здраве, Бостън, Масачузетс; 7 Университета във Вашингтон, Сиатъл, Вашингтон; 8 Диабетния център Joslin, Бостън, Масачузетс; 9-ият университет в Питсбърг, Питсбърг, Пенсилвания; 10-тият център за здравни науки в Тексас в Сан Антонио, Сан Антонио, Тексас; 11-ият Калифорнийски университет, Сан Диего, Сан Диего, Калифорния; 12 болничен център „Сейнт Лука-Рузвелт“, Ню Йорк, Ню Йорк; 13 Медицинско училище във Вашингтон, Сейнт Луис, Мисури; и 14 Национален институт по диабет и храносмилателни и бъбречни заболявания, Финикс, Аризона.
Бележки под линия
* Пълен списък на членовете на Изследователската група за програми за профилактика на диабета, центрове и персонал може да се намери в Допълнителни данни онлайн, а членовете на групата за писане са изброени в приложението .
Изказаните мнения са на разследващите и не отразяват непременно възгледите на финансиращите агенции.
Вижте придружаващите статии, стр. 663, 717 и 723.
- Дългосрочно отслабване с интерформиране на метформин или начин на живот в програмата за профилактика на диабета
- Дългосрочно отслабване с метформин или начин на живот интервенция Анали на вътрешните болести
- Лутеранският център за отслабване предлага дългосрочни, цялостни грижи SCL Health
- Хипноза за упражнения за отслабване Ежедневни форуми за диабет
- Загубата на чиста маса е свързана с нисък прием на протеини по време на диетично предизвикано отслабване през