Лаборатория по физиологична генетика, Сибирският клон на Руската академия на науките, Федерален изследователски център Институт по цитология и генетика, Новосибирск, Русия
Кореспонденция
Надежда М. Бажан
Институт по цитология и генетика, проспект Лаврентьева 10, Новосибирск 630090, Русия.
Тел: +7 (383) 363‐49‐63
Факс: +7 (383) 333‐12‐78
Лаборатория по физиологична генетика, Сибирският клон на Руската академия на науките, Федерален изследователски център Институт по цитология и генетика, Новосибирск, Русия
Катедра по физиология, Новосибирски държавен университет, Новосибирск, Русия
Лаборатория по физиологична генетика, Сибирският клон на Руската академия на науките, Федерален изследователски център Институт по цитология и генетика, Новосибирск, Русия
Лаборатория по физиологична генетика, Сибирският клон на Руската академия на науките, Федерален изследователски център Институт по цитология и генетика, Новосибирск, Русия
Лаборатория по физиологична генетика, Сибирският клон на Руската академия на науките, Федерален изследователски център Институт по цитология и генетика, Новосибирск, Русия
Кореспонденция
Надежда М. Бажан
Институт по цитология и генетика, проспект Лаврентьева 10, Новосибирск 630090, Русия.
Тел: +7 (383) 363‐49‐63
Факс: +7 (383) 333‐12‐78
Лаборатория по физиологична генетика, Сибирският клон на Руската академия на науките, Федерален изследователски център Институт по цитология и генетика, Новосибирск, Русия
Катедра по физиология, Новосибирски държавен университет, Новосибирск, Русия
Лаборатория по физиологична генетика, Сибирският клон на Руската академия на науките, Федерален изследователски център Институт по цитология и генетика, Новосибирск, Русия
Лаборатория по физиологична генетика, Сибирският клон на Руската академия на науките, Федерален изследователски център Институт по цитология и генетика, Новосибирск, Русия
Информация за финансиране:
Това проучване беше подкрепено от Руската научна фондация, грант № 17‐05–01036.
Резюме
Въведение
При хората и гризачите разпространението на затлъстяването се увеличава от раждането до средната възраст (Barzilai et al. 1998; Facchini et al. 2001; Mizuno et al. 2004). При лабораторни мишки средната възраст включва периода от 9 до 12 месеца (Flurkey et al. 2007; Jacobson 2002; Rusli et al. 2016). Въпреки това, много преди средна възраст в късната възрастна възраст (6 месеца) мишките показват нарушен метаболизъм на глюкозата, при който концентрациите на инсулин и глюкоза в кръвта се увеличават (Stenbit et al. 1997) и чувствителността към инсулин намалява (Mizuno et al. 2004). Физиологичните механизми, причиняващи дисрегулация на въглехидратния метаболизъм в късната възрастна възраст при нормално развитие, са неизвестни.
Това проучване показва, че мишките C57Bl по време на нормално развитие имат повишени WAT и BAT индекси и намален глюкозен толеранс в късния стадий на възрастни. Нашите открития предполагат, че тези промени могат да бъдат причинени от свързания с възрастта спад в дейностите на ензимната система за β- окисляване на FFA в мускулите, TG липолиза в WAT и термогенеза в BAT. Нашите данни предоставят нова информация за механизмите, залегнали в основата на затлъстяването и дисрегулацията на въглехидратно-липидния метаболизъм преди средна възраст при мишки.
Методи
Етично одобрение
Всички експерименти са извършени в съответствие с „Европейската конвенция за защита на гръбначните животни, използвани за експериментални и други научни цели“ и руските национални инструкции за грижи и използване на лабораторни животни. Протоколите са одобрени от Независимия комитет по етика на Института по цитология и генетика, Сибирски клон, Руска академия на науките (протокол № 35 от 26 октомври 2016 г.). Всички усилия бяха положени да минимизират страданията на животните и да намалят броя на използваните животни.
Животни и експериментален протокол
C57Bl мишки бяха отгледани във вивариума на Института по цитология и генетика (Сибирски клон, Руска академия на науките, Новосибирск). Мишките бяха настанени под 12: 12-часов режим светлина-тъмнина при температура на околната среда от 22 ° C. На мишките беше осигурен ad libitum достъп до търговска мишка (Assortiment Agro, Московска област, Тураково, Русия) и вода. Мъжките мишки бяха отделени от майки на 28-дневна възраст и настанени индивидуално до лечението.
Животните бяха разделени на случаен принцип в три възрастови групи: 10 седмици (млади мишки), 15 седмици (ранни възрастни мишки) и 30 седмици (късни възрастни мишки) съгласно класификационната схема от Flurkey et al. (2007). На подходящата възраст мишките се претеглят в 10:00, лишават се от храна от 18:00 до 10:00, претеглят се отново след нощно гладуване (достъпът до вода остава ad libitum) и се подлагат на OGTT (12–13 мишки на група). За да се извърши OGTT, глюкозата се прилага перорално (2 mg/g телесно тегло) след гладуване от 18:00 до 10:00 и се взема проба от вената на опашката преди и 15, 30, 60 и 120 минути след прилагане на глюкоза . Концентрациите на кръвната глюкоза се определят, както е описано по-долу.
Четири дни след OGTT, мишките от всяка възрастова група бяха разделени на две подгрупи: контролна и на гладно (6-7 мишки на подгрупа). В групата на гладно мишките са лишени от храна от 18:00 до 10:00 (достъпът до вода е бил ad libitum) и убити чрез обезглавяване в рамките на няколко секунди без анестезия. Кръвта от багажника се събира в пластмасови епруветки с EDTA и се охлажда върху лед. Плазмата се отделя чрез центрофугиране и се замразява при -20 ° С до анализи. Перигонадалната WAT и интерскапуларната BAT веднага се дисектират, претеглят и бързо се замразяват в течен азот за по-късно измерване на генната експресия. Индексите на масата на мастната тъкан се изчисляват като съотношение на масата на мастната тъкан към телесното тегло (BW). Също така бяха събрани и замразени проби от бедровия мускул.
Биохимични анализи
Концентрациите на глюкоза в кръвта се определят с глюкомер (One Touch Basic Plus, Lifescan, Русия). Плазмените концентрации на глюкоза, инсулин, FFA и TG бяха измерени с помощта на търговски комплекти (Fluitest GLU, Analyticon Biotechnologies, Lichtenfels, Германия, за глюкоза; комплект ELISA за плъхове/мишки, EMD Millipore, Мисури, САЩ, за инсулин; DiaSys Diagnostic Systems GmbH, Holzheim, Германия, за FFA; и DAIKON-DC, Пущино, Русия, за TG). Концентрациите на инсулин не бяха измерени в плазмата на гладни мишки, тъй като някои проби бяха загубени поради техническа повреда (недостиг на енергия) извън нашия контрол.
Относителна количествена оценка в реално време PCR
Статистически анализ
Всички данни са изразени като средни стойности ± SEM. Двупосочен ANOVA беше използван за сравняване на всички данни (с изключение на кръвната глюкоза от OGTT и плазмените нива на инсулин) с възрастта (10, 15 и 30 седмици) и експерименталните условия (хранени и на гладно) като обяснителни фактори. Концентрациите на глюкоза в кръвта по време на OGTT се анализират чрез двупосочни повторни мерки ANOVA с възрастта (10, 15 и 30 седмици) и времето след прилагане на глюкоза (0, 15, 30, 60 и 120 минути) като обяснителни фактори. Плазмените концентрации на инсулин се измерват само при хранени животни и се анализират чрез еднопосочен ANOVA с възрастта (10, 15 и 30 седмици) като обяснителен фактор. Тестът на Дънкан с множество обхвати беше използван за post hoc сравнения между групите. За всички анализи е използван софтуерният пакет STATISTICA 6 (StatSoft). Разликите се считат за статистически значими при P
Резултати
Телесно тегло, тегло на тъканите и кръвни параметри
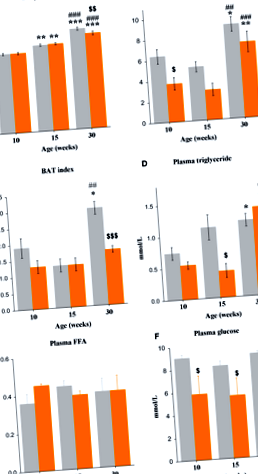
Телесното тегло се увеличава с възрастта (F2,65 = 100,3, P
Концентрациите на TG в плазмата се увеличават с възрастта (F2,27 = 7,6, P
Плазмените концентрации на инсулин при хранени мишки се увеличават от 10 до 30-седмична възраст (F2,26 = 6,6, P
Експресия на скелетни мускули на гени, свързани с енергийния метаболизъм
При хранени мишки, мускули Ucp3 генната експресия се променя с възрастта. Ucp3 нивата на иРНК при 15-седмични мишки са били по-високи, отколкото при 10-седмични мишки (P
Експресия на мастна тъкан на гени, свързани с енергийния метаболизъм
При хранени мишки, експресията на WAT иРНК на Липе променени с възрастта (F2,28 = 37,8, P
Дискусия
Изследователите са натрупали значителни данни, показващи, че по време на нормалното развитие при хората (Daviglus et al. 2003; Mizuno et al. 2004; Yoneshiro et al. 2011) и гризачите (Gruenewald и Matsumoto 1991; Jacobson 2002; Sasaki 2015), индивиди на средна възраст ( дефинирани като 40-50 години при хората [Mizuno et al. 2004] и 9-12 месеца при мишки [Flurkey et al. 2007; Gruenewald and Matsumoto 1991]) показват по-висока честота на затлъстяване и нарушен метаболизъм на глюкозата в сравнение с по-младите възрасти. Нашето проучване на метаболитните индекси при мишки от три възрастови групи, включително млади (10 седмици), ранни възрастни (15 седмици) и късно възрастни (30 седмици) (Flurkey et al. 2007) разкри, че свързаните с възрастта промени в въглехидратно-липидния метаболизъм се срещат при мишки много преди средна възраст, тоест в късния стадий на възрастни. По време на нормалното развитие, късните мишки за възрастни показват доказателства за появата на затлъстяване, включително двукратно увеличение на индексите WAT и BAT, повишени нива на триглицериди в плазмата и инсулин и намален глюкозен толеранс. Механизмите, причиняващи промени в енергийния метаболизъм в късна възраст, все още не са идентифицирани.
Нашето проучване разкри, че хранените късни възрастни мишки едновременно с начално затлъстяване показват нарушен метаболизъм на глюкозата, включително повишени нива на инсулин в плазмата, намален глюкозен толеранс в сравнение с по-младите мишки и намалена експресия на Slc2a4 ген в WAT (в сравнение с ранни възрастни мишки). Glut4 е инсулинозависим транспортер на глюкоза, чиято активност влияе върху усвояването на глюкозата на нивото на целия организъм. Показано е, че свързаното с възрастта намаляване на WAT Slc2a4 генната експресия е свързана с развитието на намален глюкозен толеранс (Li et al. 2014) и инсулинова резистентност (Hofmann et al. 1991), докато Slc2a4 свръхекспресията подобрява инсулиновата резистентност (Carvalho et al. 2005). Може да се предположи, че в късния стадий на възрастни, глюкозният толеранс при мишки също е бил намален поради увеличаване на дела на WAT, тъй като е известно, че адипоцитните продукти потискат вътреклетъчните сигнални пътища за инсулин (Ye 2013). Данните за нарушен метаболизъм на глюкозата в късните възрастни възраст са в съгласие с резултатите от други проучвания, показващи повишени концентрации на инсулин и кръвна глюкоза (Stenbit et al. 1997) и намалена чувствителност към инсулин при 30-седмични мишки C57Bl (Mizuno et al. 2004).
Свързаното с възрастта намаляване на Ucp3 генна експресия в мускулите и Slc2a4 в WAT, наблюдавано при хранени късно възрастни мишки, няма ефект върху транскрипционните отговори на тези гени на гладно в сравнение с отговора в други възрастови групи. По време на пост, Ucp3 експресията на гени при мишки рязко се е увеличила във всички възрасти, което съответства на данните, получени в други проучвания с гризачи (De Lange et al. 2006; Sánchez et al. 2009) и хора (Millet et al. 1997). Ucp3 Активирането на генната експресия е важен компонент на адаптацията към гладуването, тъй като UCP3 намалява митохондриалния мембранен потенциал, предпазва мускулните клетки от претоварване с мастни киселини и намалява прекомерното производство на реактивни кислородни видове (Amat et al. 2007). Известно е, че гладуването причинява не само натоварване на метаболитната система, но и емоционален стрес, а също така повишава нивата на глюкокортикоиди в периферната кръв (Bazhan et al. 2017; Viscarra and Ortiz 2013) стимулиращо Ucp3 генна експресия при мишки (Amat et al. 2007; Nagase et al. 2001). Изглежда, че реакцията на стрес, предизвикан от гладуване при мишки в изследваните възрасти, не се различава, което води до сходни увеличения на Ucp3 генна експресия в мускулите.
Транскрипционни отговори на гладуване за Cpt1 генът в скелетните мускули при късни възрастни мишки се различава значително от този на по-младите мишки. Млади мишки в отговор на гладно значително увеличиха мускулите Cpt1 генната експресия. Този резултат е в съответствие с констатациите от други изследвания на мускулите на плъхове (De Lange et al. 2006). За ранните и късните възрастни мишки гладуването не успя да се промени Cpt1 нива на иРНК. Ние вярваме, че при ранните възрастни мишки липсата на стимулация може да се обясни с ефекта на "тавана", т.е., Cpt1 Нивото на иРНК при хранени мишки беше толкова високо, колкото при млади гладни мишки. Гладуването не повишава нивото на иРНК на мускулна Cpt1 при ранни възрастни мишки, тъй като транскрипцията на гена вече е била в или в близост до върхова точка, поради активиране, индуцирано от някои фактори, свързани с възрастта. Смята се, че липсата на промяна при късни възрастни мишки представлява свързано с възрастта увреждане на реакцията към специфичен фактор, който се активира по време на гладуване, вероятно към FFA. Запазване на ниски нива на мускулите Cpt1 генната експресия по време на гладуване може да попречи на адаптацията поради използването на мастни киселини като енергиен източник в мускулите.
Възрастните мишки C57Bl се използват широко за изследване на различни аспекти на въглехидратно-липидния метаболизъм. Трябва да се отбележи, че значителни промени, свързани с възрастта в генната експресия в мускулите, както и WAT и BAT в постпуберталните етапи, предшестват късната възрастна възраст и че появата на затлъстяване в късна възрастна възраст може да повлияе на тези резултати.
По този начин, това изследване за първи път разкрива, че по време на нормалното развитие дори в късна възраст за възрастни експресията на гени, участващи в хидролизата на TG, усвояването на WAT глюкоза, окислението на FFA в мускулите и термогенезата на BAT рязко намаляват (в сравнение с ранните възрастни възрастни). Заключението за ролята на ензимите на периферните метаболитни органи в нарушен липиден и глюкозен метаболизъм в късна възраст може да се направи само след измерване на експресията на съответните протеини и ензимната активност. Изследването на механизмите, задействащи затлъстяването по време на нормално развитие при мишки, е от значение, тъй като затлъстяването в по-късна възраст ги предразполага към животозастрашаващи състояния като инсулинова резистентност, диабет тип 2 и сърдечно-съдови заболявания.
- Наследихте ли мастните гени Истината за биологията и телесните мазнини Мускули и сила
- Може ли загубата на телесни мазнини и чистата мускулна маса да бъдат насочени с хранителни добавки
- Вземете силна желязо с мускулни водорасли; Фитнес
- Включете повече гръцко кисело мляко в диетата си, за да изградите чиста мускулна маса и да отслабнете
- Вземете шест опаковки корема с тази 10-минутна тренировка за изгаряне на мастните мускули; Фитнес