Грация Пениси
1 Секция по гастроентерология и хепатология, PROMISE, Policlinico Universitario Paolo Giaccone, Piazza delle Cliniche 2, 90127 Палермо, Италия; moc.liamg@oricaslec (C.C.); moc.liamg@1991alotapsaciredef (F.S.); [email protected] (S.P.)
Ciro Celsa
1 Секция по гастроентерология и хепатология, PROMISE, Policlinico Universitario Paolo Giaccone, Piazza delle Cliniche 2, 90127 Палермо, Италия; moc.liamg@oricaslec (C.C.); moc.liamg@1991alotapsaciredef (F.S.); [email protected] (S.P.)
Федерика Спатола
1 Секция по гастроентерология и хепатология, PROMISE, Policlinico Universitario Paolo Giaccone, Piazza delle Cliniche 2, 90127 Палермо, Италия; moc.liamg@oricaslec (C.C.); moc.liamg@1991alotapsaciredef (F.S.); [email protected] (S.P.)
Марчело Далио
2 Катедра по прецизна медицина, Университет на Кампания, Луиджи Ванвили, през Пансини 5, 80131 Неапол, Италия; [email protected]
Алесандро Федерико
2 Катедра по прецизна медицина, Университет на Кампания, Луиджи Ванвили, през Пансини 5, 80131 Неапол, Италия; [email protected]
Салваторе Пета
1 Секция по гастроентерология и хепатология, PROMISE, Policlinico Universitario Paolo Giaccone, Piazza delle Cliniche 2, 90127 Палермо, Италия; moc.liamg@oricaslec (C.C.); moc.liamg@1991alotapsaciredef (F.S.); [email protected] (S.P.)
Резюме
Безалкохолната мастна чернодробна болест (NAFLD) бързо се превръща в най-честата причина за хронично чернодробно заболяване, както и в първата причина за чернодробна трансплантация. NAFLD обикновено се свързва с метаболитен синдром (MetS) и това е най-важната причина, поради която е изключително трудно да се лекува това заболяване, като се има предвид огромното количество взаимовръзки между черния дроб и други системи за поддържане на метаболитното здраве. Лечението на NAFLD е ключов момент за предотвратяване прогресирането на NASH към напреднала фиброза, за предотвратяване на цироза и за предотвратяване на развитието на чернодробните му усложнения (като чернодробна декомпенсация и HCC) и дори екстрахепатална. Част от добре познатия здравословен ефект на диетата и физическите упражнения в тази обстановка е важно да се създаде правилната фармацевтична стратегия, за да се противодейства на прогресията на заболяването. В тази връзка настоящият преглед има обхвата да даде панорамен поглед върху възможната стратегия за фармакологично лечение при пациенти с НАЖБП.
1. Въведение
Безалкохолната мастна чернодробна болест (NAFLD) бързо се превръща в най-честата причина за хронично чернодробно заболяване, чернодробна цироза, чернодробна декомпенсация, хепатоцелуларен карцином (HCC) и чернодробна трансплантация (LT) в света [1].
В действителност, степента на разпространение в световен мащаб се оценява на около 25,2% от общото население, особено в Западния свят, с най-нисък процент в Африка [2].
NAFLD е спектър от патологични състояния, които включват неалкохолна стеатоза (NAFL), неалкохолен стеатохепатит (NASH) и цироза. При NAFL има чернодробна стеатоза без данни за възпаление, докато при NASH чернодробната стеатоза е свързана с чернодробно възпаление (със или без фиброза) и накрая еволюира до цироза, основен рисков фактор за краен стадий на чернодробна недостатъчност и/или хепатоцелуларна карцином (HCC) [3].
NAFLD обикновено се свързва с метаболитен синдром (MetS) и има натрупващи се доказателства, които показват, че NAFLD е независим рисков фактор за сърдечно-съдови заболявания (ССЗ) при възрастни [4].
Следователно, лечението на NAFLD е ключов момент за предотвратяване прогресирането на NASH към напреднала фиброза, за предотвратяване на цироза и за предотвратяване на развитието на чернодробните му усложнения (като чернодробна декомпенсация и HCC) и дори екстрахепатална.
Значителни доказателства предполагат силна връзка между NASH и модификациите на начина на живот, включително загуба на тегло, физически упражнения и промени в диетата. Загубата на тегло и повишената физическа активност са свързани с трайно подобряване на чернодробните ензими, хистологията, серумните нива на инсулин и качеството на живот при пациенти с NAFLD. Най-високите нива на намаляване на NASH, разделителна способност на NASH и регресия на фиброзата се наблюдават при пациенти със загуба на тегло ≥ 10% [5]. Освен това тези интервенции помагат за управление и свеждане до минимум на риска от свързаните съпътстващи заболявания, като ССЗ.
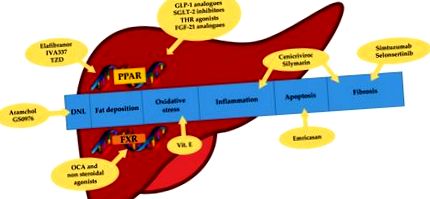
Към днешна дата много лекарства са изследвани във фаза 2 и 3; обаче няма одобрени лекарства за NASH. Няколко цели са проучени за фармакологичната терапия на NASH, които включват противовъзпалителни, анти-фиброзни и анти-апоптотични фактори, както и метаболитни регулатори и антиоксидантни пътища (Фигура 1). Едно възможно обяснение на голямата трудност при разработването на полезни лекарства срещу NAFLD вероятно е свързано с несъгласието в дефиницията и оценката на крайните точки на изследванията поради не напълно известните механизми около заболяването, както и липсата на последователни диагностични и стадиативни методи, с изключение на чернодробна биопсия.
Цели на терапията с NASH. DNL: de novo липогенеза. TZD: тиазолидиндиони. ОСА: обетиколова киселина. PPAR: активирани от пероксизомен пролифератор рецептори. FXR: фарнезоидни X рецептори. GLP-1: глюкагоноподобен пептид 1. SGLT-2: транспортен протеин на натрий-глюкоза 2. THR: рецептор на тиреоиден хормон. FGF-21: фибробластен растежен фактор 21.
Освен това има някои разлики по отношение на предразположението, естествената история, отговора на терапията поради етническата принадлежност на анализираната популация, които правят тълкуването на резултатите от изследването трудно предизвикателство.
2. Фармакологично лечение: Различни лекарства за различни терапевтични цели
Всички знания, съдържащи се в следващия раздел, се основават на насоките за управление на NAFLD.
2.1. Инсулинови сенсибилизатори и антиоксиданти
2.3. Силимарин
Силимаринът се извлича от растението бял трън Silybum marianum и от дълго време се счита за билков лек при чернодробни заболявания. Състои се от смес от 6 основни флавонолигнани (силибини А и В, изосилибини А и В, силихристин и силидианин) и други незначителни полифенолни съединения [18]. Антиоксидантните, противовъзпалителните и антифибротичните свойства на силимарина се демонстрират от няколко проучвания in vitro и върху животни [19,20,21,22] Неговите функции включват: защита срещу индуцирано от радикали увреждане на клетъчната мембрана, симулация на полимераза и РНК транскрипция и регулиране на някои клетъчни сигнални пътища и биологични оси като инсулиновия рецепторен субстрат 1/фосфатидилинозитид 3-киназа/Akt път и оста на никотинамид аденин динуклеотид/сиртуин 1 [23,24].
IVA337 (Lanifibranor) е пан-PPAR агонист, който действа умерено и по балансиран начин върху трите PPAR изоформи. Интересни резултати са наблюдавани при няколко предклинични модела. In vitro са показани анти-фибротични ефекти, особено инхибирането на индуцирана от тромбоцитите растежен фактор (PDGF) и индуцирана от скованост активация на чернодробни звездни клетки (HSC). Когато се прилага на животински модели, IVA337 показва положителни ефекти при намаляване на телесното тегло, подобряване на инсулиновата резистентност, профилактика на стеатохепатит, намаляване на стеатозата, балониране, възпаление и намаляване на профибротичната и провоспалителна генна експресия. Интересното е, че IVA337 демонстрира антифибротична ефикасност в индуцирания от CCl4 модел на чернодробна фиброза по отношение на профилактика или реверсия на фиброза [68]. Поради това се спекулира, че комбинираното активиране на трите PPAR изоформи може да бъде по-добро от специфични или двойни агонисти, чрез взаимодействието с различни фиброзни пътища в NASH. Поради тези причини IVA337 представлява обещаващ кандидат за лечение с NASH.
3.3. Инхибитори на De Novo Lipogenesis
При хората инхибиторите на АСС първо се оценяват в рандомизирано контролирано кръстосано проучване, проведено при наднормено тегло и затлъстяване, но иначе здрави мъже, показващи добър профил на безопасност и обещаващи дозозависими резултати по отношение на намаляването на de novo чернодробна липогенеза в отговор прием на фруктоза [71].
3.4. Агонист на рецептора за тиреоиден хормон
Тиреоидните хормони играят ключова роля в регулирането на хомеостазата, липидния и глюцидния метаболизъм, регулирането на телесното тегло и адипогенезата чрез ефектите върху рецептора на щитовидната жлеза β (THR β), който представлява и преобладаващата изоформа на THR в черния дроб [78]. Доказано е, че дисфункциите на щитовидната жлеза, особено хипотиреоидизмът, са свързани с инсулинова резистентност и дислипидемия и със сърдечно-съдова смъртност. Освен това наскоро хипотиреоидизмът е показан като независим рисков фактор за NAFLD [79,80,81,82,83,84]. Поради тези причини агонистите на THR β, особено MGL-3196 и VK-2809, все още са в процес на разследване.
MGL-3196 (Resmetirom) е високоселективен THR β агонист, който показва положителни ефекти върху намаляването на LDL холестерола и триглицеридите във фаза I проучвания. Оценява се при многоцентрово двойно заслепено RCT спрямо плацебо при пациенти с NAS резултат ≥ 4 и стадий на фиброза F1-F3 [85]. Дозировка от 80 mg веднъж дневно е била назначена на 78 пациенти и 38 пациенти са получавали плацебо в продължение на 36 седмици. Първичната крайна точка след 12 седмици (относително намаление на MRI-PDFF) е постигната (-36% в третираната група срещу -9% в групата на плацебо). Обратно, хистологичната крайна точка на 36 седмици (2-точково намаляване на NAS с ≥1 точки намаление при балониране или възпаление) не е била постигната (51% в лекуваната ръка срещу 32% в групата на плацебо, p = 0,09). Въпреки това, ограничавайки анализа до пациенти, лекувани с MGL-3196, които са получили намаление от поне 30% в MRI-PDFF, степента на отговор е значително по-висока (65%, p = 0,006) в сравнение с плацебо, което предполага връзка между ранното намаляване в чернодробните мазнини на 12 седмици и NASH хистологично подобрение на 36 седмици. Освен това MGL-3196 показа ефективност при постигане на разделителна способност на NASH (27% срещу 6%, p = 0,02) и при значително намаляване на нивата на ALT, биомаркери на фиброза и липиди, с приемлив профил на безопасност. Наскоро започна изпитване фаза III, което продължава и продължава (> NCT03900429).
Симтузумаб (по-рано GS-6624) е хуманизирано моноклонално антитяло с изотип на имуноглобулин IgG4, което е насочено срещу човешка лизил оксидаза-подобна молекула 2 (LOXL2). LOXL2 е ензим, който насърчава омрежването на колаген и еластин, поради което води до ремоделиране на извънклетъчния матрикс, представляващ ключов компонент в основния регулаторен път на фиброгенезата [137]. Предклиничен анализ от миши модел на напреднала фиброза предполага, че симтузумаб показва адитивен ефект, когато се комбинира с инхибитор на ASK1 [138, 139]. Две проучвания във фаза 2b на пациенти с мостова фиброза или компенсирана цироза, дължаща се на NASH, показват, че симтузумаб не е ефективен при намаляване на съдържанието на чернодробен колаген или градиента на чернодробното венозно налягане.
4. Заключения
През следващите няколко години пандемията на NAFLD ще доведе до увеличаване на броя на пациентите с NASH и тези с фиброза с по-висок риск от развитие на чернодробни усложнения. Тази картина подчертава необходимостта от ефективна фармакологична терапия. Редица лекарства, насочени към различни патогенетични пътища, са в процес на разследване, дори ако само няколко от тях вече са потвърдили своята ефикасност в проучвания фаза III, някои категорично не са успели да докажат своето превъзходство по отношение на плацебо, а някои други все още се разследват (Таблица 1) . В заключение, предизвикателството за следващото бъдеще е правилният подход към терапията с NASH, който ще вземе предвид корекцията на начина на живот - гръбнакът на терапията с NASH, контрол на свързаните метаболитни нарушения и, когато е налице, рационална употреба на специфични лекарства с потенциално различна цел според фенотипа на пациента с NASH.
маса 1
Обобщение на анализираните лекарства, техните механизми на действие и научни доказателства.
- Безалкохолна мастна чернодробна болест Carr Lab Perelman School of Medicine в Университета в
- Новини за преглед на решения за безалкохолни мастни чернодробни заболявания
- Безалкохолна мастна чернодробна болест Статия по радиология
- Безалкохолна мастна чернодробна болест MedlinePlus Genetics
- Плазматични по-високи нива на хомоцистеин при безалкохолно мастно чернодробно заболяване (NAFLD) Хранене