Резюме
Въведение
Детските модификации могат да доведат до значителни разлики в рисковете и честотата на няколко вида рак. Напоследък употребата на естествени хранителни вещества, открити в плодовете, зеленчуците и билките, е получила значително внимание като химиопрофилактични и химиотерапевтични агенти по целия свят (14, 26, 28, 70). Подходът за превенция на рака с използване на нетоксични нови растителни агенти се насърчава от много изследователи. Флавоноидите често се срещат в повечето растения и упражняват значителен набор от биологични дейности като антиоксидант, антикарциноген, противовъзпалително, антибактериално, имуностимулиращо и антивирусно (13, 24, 55). Флавоноидите и техните полимери съставляват една от най-големите групи фитонутриенти, които осигуряват полезни ефекти върху здравето. Тези важни полифенолни съединения от класа на растителните вторични метаболити оказват значително въздействие в биологичната система. Съобщава се, че средният общ прием на флавоноиди в Съединените щати е бил 1 g/ден (34, 58); приемът обаче се различава значително (7).
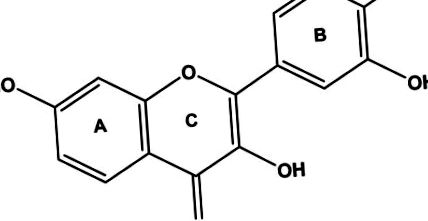
Структура на физетин.
Диетични източници на физетин. Концентрацията на физетин е измерена в лиофилизирани зеленчуци и плодове след киселинна хидролиза на изходните гликозиди. Адаптирано от Kimira et al. (33).
Физетин като антиоксидант
Доказано е, че физетинът повишава вътреклетъчните нива на глутатион (GSH) в мишките хипокампални клетки HT-22 както в присъствието, така и в отсъствието на глутамат. Увеличението на метаболизма на GSH осигурява защита от глутамат, тъй като глутаматът намалява нивото на GSH чрез инхибиране на усвояването на цистин, необходим за производството на GSH (23). Лечението на първични неврони на плъхове с физетин осигурява защита срещу донора на пероксинитрит, медиирани от SIN-1 промени в индуцирането на извънклетъчна сигнално-регулирана киназа (ERK1/2)/c-myc фосфорилиране, ядрен NF-E2-свързан фактор-2 (Nrf2) нива, нива на глутамат цистин лигаза, концентрация на GSH и жизнеспособност на клетките (8). Наскоро ефектът на физетин върху регулирането на хем оксигеназа-1 (HO-1) беше изследван в ендотелните клетки на човешката пъпна вена. Индукцията на HO-1 в ендетелни клетки, стимулирани от физетин, е намалена чрез малки интерфериращи РНК и фармакологични инхибитори на PKC-δ и р38 митоген-активирана протеин киназа (MAPK). Лечението с физетин причинява повишена ядрена транслокация и активност на Nrf2. Наблюдава се и намаляване на индуцираната от водороден пероксид клетъчна смърт след лечение с физетин, което е обърнато от ZnPP, инхибитор на HO-1 (36).
Физетин и рак
Появяващите се данни от in vitro и in vivo проучвания показват, че физетинът притежава антипролиферативни свойства срещу няколко ракови заболявания (66). Неговата потенциална стойност в превенцията и лечението на рака беше допълнително подчертана от неотдавнашни доклади, които показват, че физетинът може да намали ангиогенезата и следователно да потисне туморния растеж чрез инхибиране на урокиназния плазминогенен активатор (uPA) (25). Скринингово проучване, което оценява ефекта на 17 структурно свързани флавоноиди, установява, че физетинът е мощен инхибитор на активността на матричната металопротеиназа (ММР) -1, ключов ензим в ремоделирането и разграждането на извънклетъчния матрикс, с важна роля в прогресията на рака (40).
Известно е, че Fisetin бързо компрометира индуцирания от микротубули митотичен блок по протеазомен начин в няколко човешки клетъчни линии. Той причинява преждевременно започване на хромозомна сегрегация и излизане от митоза без нормална цитокинеза в необезпокоявани човешки ракови клетки. Последиците от лечението с физетин върху локализацията и фосфорилирането на няколко митотични протеини бяха анализирани в проучвания на клетъчни култури и беше установено, че Aurora B, Bub1, BubR1 и Cenp-F бързо губят своята локализация на кинетохора/центромера при добавяне на физетин към културна среда. В допълнение, Aurora B киназата е идентифицирана като нова пряка цел на физетин и неговата активност е значително намалена от физетин in vitro (57).
Fisetin индуцира апоптотична клетъчна смърт в различни ракови клетъчни линии. Има обаче ясни доказателства, че медиираните от физетин антипролиферативни и проапоптотични ефекти са насочени специално към раковите клетки, а нормалните клетки са много по-малко засегнати от лечението с физетин (27, 29, 30). Възможно е диференциалната модулация на клетъчно-сигналните пътища в раковите клетки спрямо техните нормални аналози да е отговорна за този селективен ефект на физетин. В следващия раздел прегледахме наличната литература за ефектите на физетин при различни видове рак, както в клетъчни линии, така и in vivo модели. Молекулните цели на физетин са показани на фигура 3. Антикарциногенните ефекти на физетин в модели in vitro и in vivo са дадени съответно в таблици 1 и и 2, 2.
Молекулни цели на физетин.
маса 1.
Обобщение на антикарциногенните ефекти на физетин при проучвания in vitro
| Бял дроб | Намалена жизнеспособност и клоногенност на раковите клетки, повишен PTEN, намалено фосфорилиране на PI3-K и Akt, активиран TSC и AMPK, намалено фосфорилиране и активиране на mTOR, намалено фосфорилиране на p70S6K1, eIF-4E и 4E-BP1, инхибираха mTORC съставните части като Rictor, Raptor, GβL и PRAS40 | 27 |
| Инхибира адхезия, миграция и инвазия чрез инхибиране на ERK1/2, понижено регулиране на MMP-2, uPA, NF-κB и AP-1 | 38 | |
| Дебело черво | Намалена жизнеспособност на раковите клетки | 35, 61 |
| Индуциран арест на клетъчния цикъл, инхибира cdk-4 и 6 | 41 | |
| Индуцирана цитотоксичност чрез разграждане на секурин, независимо от р53 | 72 | |
| Индуцирана апоптоза чрез външни и вътрешни пътища, активиран р53, повишени нива на TRAIL протеин | 39, 61 | |
| Инхибира EGFR и NF-kB, намалени COX2 и PGE2, инхибира Wnt/β-катенин сигнализиране, понижено регулиране на TCF-4, намален циклин D1 и MMP-7 | 61 | |
| Подобрена радиочувствителност на р53-мутантни ракови клетки на дебелото черво, увеличен радиационно-индуциран G2/M арест и апоптоза | 9 | |
| Простата | Антипролиферативно | 20. |
| Индуцира спиране на клетъчния цикъл, индуцирана клетъчна смърт чрез апоптоза и автофагия | 29, 62 | |
| Повишена TRAIL-медиирана цитотоксичност, повишена експресия на TRAIL протеин, инхибира NF-kB | 67 | |
| Индуцирана автофагия, активиран AMPK, инхибирана активност на mTOR, образуване на mTOR комплекс, инхибирани mTOR цели rpS6, eIF4B и 4EBP1, потиснат Cap-зависим транслация, Akt фосфорилиране | 62 | |
| Инхибира адхезия, миграция и инвазия, потиснати PI3K/Akt/JNK сигнализиране за регулирани MMPs | 11. | |
| Инхибира AR трансактивация на целеви гени, включително PSA, чрез взаимодействие с AR | 30 | |
| Панкреас | Инхибиран клетъчен растеж, индуцирана апоптоза, инхибирана инвазия, потиснато DR3-медиирано активиране на NF-κB, намален MMP-9 | 48 |
| Меланом | Намалена жизнеспособност на клетките, индуциран G1-фазен арест, понижен Wnt протеин и неговите корецептори, повишени Wnt инхибитори Dickkopf и WIF-1, намалени нива на ядрен β-катенин, понижени регулирани цели на β-катенин като c-myc, Brn-2 и MITF | 65 |
AMPK, AMP-активирана протеин киназа; AR, андрогенен рецептор; COX, циклооксигеназа; DR, рецептор за смърт; EGFR, рецептор за епидермален растежен фактор; eIF4B, еукариотен иницииращ фактор 4В; ERK1/2, извънклетъчна сигнално-регулирана киназа; MITF, свързан с микрофталмия транскрипционен фактор; ММР, матрична металопротеиназа; NF-кВ, ядрен фактор-капа В; PGE2, простагландин Е2; PSA, специфичен за простатата антиген; PTEN, фосфатаза и тензин хомолог; TCF, транскрипционен фактор Т-клетъчен фактор; TRAIL, TNF-свързан индуциращ апоптоза лиганд; uPA, урокиназен плазминогенен активатор; WIF-1, Wnt инхибиторен фактор; XIAP, Х-свързан инхибитор на апоптозата.
Таблица 2.
Обобщение на антикарциногенните ефекти на физетин в проучвания In vivo
| Бял дроб | Предпазва от белодробна канцерогенеза, индуцирана от B (a), намалени хистологични лезии, възстановени ензимни и неензимни антиоксиданти | 54 |
| Антиангиогенно, намалена плътност на микросъдовете, намален обем на тумора по-ефективно с циклофсофамид | 69 | |
| Простата | Забавен растеж на тумора, намалени серумни нива на PSA | 30 |
Физетин и рак на белия дроб
Сигнализиране на Fisetin и mTOR. (А) Хипотетичен модел на мишена на бозайник на рапамицин (mTOR) молекула в комплекс с физетин. (i, iii) Сляпото докинг на фисетин към mTOR целта се извършва с autodock 4 чрез задаване на размери на мрежата, които включват цялата mTOR молекула. Структурата се състои от четири подредени алфа спирали. Размерът на мрежата за докинг мястото беше разширен, за да включи цялата молекула mTOR и физетинът беше докиран. Използвайки autodock 4, беше показано, че fisetin се свързва с две места на mTOR целта. Енергиите на свързване бяха в диапазона от -7 до -8 kcal/mol за константата на свързване. (ii, iv) Свързването в най-доброто място включва водородно свързване към глутамат от две хидроксилни групи. Адаптиран от Khan et al. (27). (Б) Предложен механизъм, чрез който физетинът насочва mTOR сигнализирането в раковите клетки.
Физетин и рак на дебелото черво
Физетин и рак на простатата
Проучвания, проведени за идентифициране на нови флавоноиди с антипролиферативна активност, установяват, че физетинът е мощен инхибитор на растежа на клетките на рака на простатата (20). Ефикасността на синтетичния флавоноид 2,2′-дихидроксихалкон (DHC) е сравнена с тази на естествения физетин. И двете съединения намаляват клетъчната жизнеспособност и клоногенността, свързани със съпътстващо увеличаване на апоптозата в раковите клетки на простатата. Синтетичното съединение DHC обаче показва цитотоксична активност при по-ниски концентрации (19). Изследванията на генната експресия показват, че регулаторните гени на клетъчния цикъл са сред най-силно представената функционална категория на променените гени. От стоте гени на клетъчния цикъл, променени от DHC и физетин, 27 гена с ключови функции във фаза G2/M бяха понижени от двете съединения. Другите функционални категории, които са модулирани, включват хромозомна организация, гени за апоптоза и отговор на стреса (19).
Установено е, че физетинът индуцира клетъчна смърт в раковите клетки на простатата чрез активиране на апоптотичния и автофагичния път (19, 29, 62, 67). Ние показахме, че лечението с физетин води до индукция на апоптоза в LNCaP клетки, с активиране на каспазната каскада. Това беше придружено от арест на клетки във фаза G0/G1 на клетъчния цикъл (29). Fisetin намалява жизнеспособността на раковите клетки на простатата, но има минимален ефект върху нормалните епителни клетки на простатата (29). Както при раковите клетки на дебелото черво (39), физетинът усилва TRAIL-медиираната цитотоксичност и апоптоза в раковите клетки на простатата чрез активиране на външния и вътрешния апоптотичен път (67). Лечението с TRAIL и физетин причинява значително активиране на каспаза-8 и каспаза-3 и нарушаване на митохондриалния потенциал в тези клетки. Физетин увеличава протеиновата експресия на TRAIL рецептора и намалява активирането и ядрената транслокация на NF-kB (67).
Физетин и рак на панкреаса
Известно е, че раковите клетки на панкреаса изразяват свързания с резистентност към различни лекарства протеин (MRP) -1, отговорен за изтичането на лекарства от клетката. Nguyen и сътр. провери ефекта на диетичните флавоноиди върху транспорта на дауномицин и винбластин в клетъчната линия на панкреаса аденокарцином. Те установяват, че физетинът значително намалява натрупването и на двете лекарства в плазмата за разлика от други флавоноиди (51). Друго проучване, направено върху резистентни на доксорубицин клетки на човешки сарком, показва, че физетинът значително засилва натрупването на доксорубицин в тези клетки (3). Тези очевидно контрастни данни предполагат, че са необходими задълбочени проучвания за изследване на ефикасността на физетин при рак на панкреаса.
Физетин и меланом
- Диетичен контрол на свръхрастежа на Candida - Храносмилателен здравен институт
- Диетични фактори, свързани с консистенцията на фекалиите и други показатели за здравето на стомашно-чревния тракт
- Диетичните влакна предпазват от хранителни алергии Наука, здраве и др
- Диетични фибри и пшенични трици при детски запек и здраве - ScienceDirect
- Диетичните фибри и здравето на белите дробове се хранят добре, дишат спокойно