Болница Lenox Hill, Институт по диабет Friedman, Northwell Health, Ню Йорк, Ню Йорк, САЩ
Файнщайн институтите за медицински изследвания, Northwell Health, Manhasset, NY, САЩ
Училището по медицина на Доналд и Барбара Зукър в Хофстра/Нортуел, Хемпстед, Ню Йорк, САЩ
Кореспонденция
Димитър Автански, доктор по медицина, Институт по диабет Фридман, Northwell Health, 110 E 59th Street, Suite 8B, стая 837, Ню Йорк, Ню Йорк 10022, САЩ.
Файнщайн институтите за медицински изследвания, Northwell Health, Manhasset, NY, САЩ
Училището по медицина на Доналд и Барбара Зукър в Хофстра/Нортуел, Хемпстед, Ню Йорк, САЩ
Файнщайн институтите за медицински изследвания, Northwell Health, Manhasset, NY, САЩ
Училището по медицина на Доналд и Барбара Зукър в Хофстра/Нортуел, Хемпстед, Ню Йорк, САЩ
Болница Lenox Hill, Институт по диабет Friedman, Northwell Health, Ню Йорк, Ню Йорк, САЩ
Файнщайн институтите за медицински изследвания, Northwell Health, Manhasset, NY, САЩ
Училището по медицина на Доналд и Барбара Зукър в Хофстра/Нортуел, Хемпстед, Ню Йорк, САЩ
Болница Lenox Hill, Институт по диабет Friedman, Northwell Health, Ню Йорк, Ню Йорк, САЩ
Файнщайн институтите за медицински изследвания, Northwell Health, Manhasset, NY, САЩ
Училището по медицина на Доналд и Барбара Зукър в Хофстра/Нортуел, Хемпстед, Ню Йорк, САЩ
Кореспонденция
Димитър Автански, доктор по медицина, Институт по диабет Фридман, Northwell Health, 110 E 59th Street, Suite 8B, стая 837, Ню Йорк, Ню Йорк 10022, САЩ.
Институтите за медицински изследвания на Файнщайн, Northwell Health, Манхасет, Ню Йорк, САЩ
Училището по медицина на Доналд и Барбара Зукър в Хофстра/Нортуел, Хемпстед, Ню Йорк, САЩ
Файнщайн институтите за медицински изследвания, Northwell Health, Manhasset, NY, САЩ
Училището по медицина на Доналд и Барбара Зукър в Хофстра/Нортуел, Хемпстед, Ню Йорк, САЩ
Болница Lenox Hill, Институт по диабет Friedman, Northwell Health, Ню Йорк, Ню Йорк, САЩ
Файнщайн институтите за медицински изследвания, Northwell Health, Manhasset, NY, САЩ
Училището по медицина на Доналд и Барбара Зукър в Хофстра/Нортуел, Хемпстед, Ню Йорк, САЩ
Резюме
Заден план
Животински модели на диета, предизвикано от затлъстяване (DIO), често се използват в медицински изследвания за имитиране на човешки заболявания. Няма универсален животински модел и при проектирането на нови експерименти трябва да се има предвид внимателна оценка на разнообразието от фактори. Тук изследвахме ефекта от 9-седмичната интервенция с високо съдържание на мазнини (HFD), осигуряваща 60% енергия от мазнини, върху параметрите на възпалението и инсулиновата резистентност при мъжки мишки C57BL/6J.
Методи
Шестседмични мишки са били инициирани с редовна диета (RD) или HFD, осигуряващи 60 kcal енергия от мазнини за 9 седмици. Нивата на кръвната глюкоза на гладно се измерват с глюкометър, а плазмените нива на гладно на инсулин и проинфламаторни цитокини чрез анализ Luminex. Инсулиновата чувствителност беше оценена чрез използване на индекси QUICKI и HOMA2.
Резултати
Показаха се HFD мишки
40% по-високо телесно тегло и
20% по-голяма коремна обиколка, поради увеличаване на масата на бялата мастна тъкан. Чернодробното изследване разкрива увеличен размер и по-високо чернодробно натрупване на липиди в черния дроб от HFD мишки в сравнение с техните аналози на RD. Животните от групата на HFD се характеризираха със значително по-високо присъствие на короноподобни структури (CLS) в WAT и по-високи плазмени нива на възпалителни цитокини (TNF-α, IL-6, лептин, MCP-1, PAI-1 и резистин) . Хранените с HFD мишки също демонстрират нарушена инсулинова чувствителност (по-ниска QUICKI, по-висока HOMA-инсулинова резистентност (HOMA-IR) и по-ниска HOMA-процентна чувствителност (HOMA-% S)).
Заключение
Мъжки мишки C57BL/6J на 9 седмици HFD, осигуряващи 60 kcal енергия от мазнини, нарушена инсулинова чувствителност и хронично възпаление, което прави този модел DIO мишка подходящ за проучвания на ранните етапи на свързаната със затлъстяването патология.
1. ВЪВЕДЕНИЕ
Мастната тъкан е активен ендокринен орган, който усеща състоянието на хранителните вещества и регулира мобилизирането на енергия. 1 Въпреки че генетичната предразположеност играе роля, затлъстяването до голяма степен е резултат от неравномерно равновесие между енергийния прием и енергийните разходи, тъй като приемът на хранителни мазнини се счита за основен фактор за увеличаване на затлъстяването. 2 Затлъстяването се характеризира със смърт на адипоцити, инфилтрация в макрофаги на мастната тъкан (АТМ) и моноцити, нарушена диференциация и секреция на адипоцитите и хронично възпаление. Затлъстяването е свързано с множество съпътстващи заболявания като чернодробно заболяване, метаболитен синдром и захарен диабет тип 2, наред с други.
Целта на това проучване е да се изследва ефектът от 60% мазен режим на хранене за 9 седмици при мъжки мишки C57BL/6J. Оценихме морфологични характеристики (телесно тегло и обиколка на корема), депа за WAT и кафява мастна тъкан (BAT), натрупване на мазнини в черния дроб, плазмени нива на циркулиращи провъзпалителни цитокини, както и инсулинова резистентност, използвайки индекси QUICKI и HOMA2.
2. МАТЕРИАЛИ И МЕТОДИ
2.1 Животни
Експериментът in vivo е извършен в съответствие с насоките на Националния институт по здравеопазване (NIH) по протокол, одобрен от Институционалния комитет за грижи и употреба на животните (IACUC) към Институтите за медицински изследвания на Файнщайн, Northwell Health, Manhasset, Ню Йорк.
Шестседмични мъжки мишки C57BL/6J DIO Control (Stock # 380056) и C57BL/6J DIO (Stock # 380050, Лабораторията Jackson) са поставени на изокалорична диета с ниско съдържание на мазнини (10% kcal енергия от мазнини) (Research Diets, Cat. # D12450B) (група с редовна диета (RD)) или HFD (60% ккал енергия от мазнини) (Research Diets, Cat. # D12492) (HFD group), съответно и на възраст от 12 седмици са доставени на Институти за медицински изследвания на Файнщайн, където режимите на диета продължават до 15-седмична възраст. Пълната формулировка и информация за калориите на използваните диети са изброени в таблици S1 и S2. Мишките бяха евтаназирани чрез излагане на летална доза CO2, последвано от цервикална дислокация.
2.2 Вземане на кръв и измерване на глюкоза и адипокин
Мишките бяха през нощта (14-15 часа) на гладно. Кръвни проби бяха взети от вената на бузата сутрин, непосредствено преди жертвата, и нивата на глюкоза бяха измерени с помощта на OneTouch Verio Flex ™ System (LifeScan). Статистиката на регресията на тази система е, както следва: 95% CI наклон = 0,97-1,01; 95% CI интервал = -1,59-7,55 mg/dL; стандартна грешка (Sy.x) = 14,0 mg/dL; R 2 = .98. След умъртвяването, крайните кръвни проби се събират чрез сърдечна пункция в епруветки, съдържащи 5,4 mg EDTA (BD). Пробите се поставят незабавно върху лед за 3 часа и се центрофугират при 5000 ж/ 15 min/4 ° C, за да се отдели плазмената фракция, след това пробите се аликвотират и незабавно се замразяват при -86 ° C, докато се обработят допълнително. Плазмените нива на IL-6, инсулин, лептин, MCP-1, PAI-1 (общо), резистин и TNF-α бяха измерени чрез анализ Luminex с помощта на MILLIPLEX Map Mouse Adipokine Magnetic Bead Panel-Endocrine Multiplex Assay (Millipore, Cat. # MADKMAG-71K). Чувствителността, точността и точността на анализа са както следва: чувствителността е (минимална откриваема концентрация (MinDC) [pg/mL], MinDC + 2SD [pg/mL]): IL ‐ 6 (2.3, 6.3), инсулин (13.0, 27.7), лептин (4.2, 8.2), MCP ‐ 1 (4.9, 11.9), PAI ‐ 1 общо (4.0, 10.3), резистин (1.1, 3.7), TNF-α (5.3, 11.0); прецизност (интра-тест% CV, между-тест% CV) за всички седем аналитични вещества беше (
2.3 Оценка на инсулиновата чувствителност при мишки
Инсулиновата чувствителност се оценява с помощта на количествен индекс за проверка на инсулиновата чувствителност (QUICKI) (1/log инсулин (mU/L) + log глюкоза (mg/dL)) 6 и индекс за оценка на модела на хомеостаза-2 (HOMA2) с помощта на онлайн калкулатор на звеното за изпитания за диабет на уебсайта на университета в Оксфорд (https://www.dtu.ox.ac.uk/homacalculator/), предоставящо стойности за инсулинова резистентност (HOMA-IR), стабилна β-клетъчна функция (HOMA%) B) и инсулинова чувствителност (HOMA-% S).
2.4 Дисекция и подготовка на тъкани
Животните бяха перфузирани с формалдехид и различни депа на мастна тъкан (епидидимални, ингвинални, мезентериални, интерскапуларни, ретроперитонеални, перикардни WAT и интерскапуларни BAT) и черният дроб бяха дисектирани, претеглени и съхранявани в PBS. Пробите бяха изпратени до ядрото по хистопатология на Медицинското училище в Ню Йорк в Ню Йорк, Ню Йорк за вграждане на парафин, нарязване и оцветяване с хематоксилин и еозин (H&E).
2.5 Оценка на чернодробното натрупване на липиди
Чернодробното натрупване на липиди се оценява чрез преброяване на броя на съдържащите липиди хепатоцити. Данните са представени като процент на съдържащи липиди хепатоцити на микроскопично зрително поле.
2.6 Статистически анализи
Статистическите анализи бяха извършени с помощта на софтуера GraphPad Prism 7 (GraphPad Software). Статистически значимата разлика между средните стойности на две групи (RD и HFD) беше изчислена с помощта на Student т тест и двустранно разпределение. Резултатите се считат за статистически значими, ако P ≤ .05. Резултатите бяха представени като средна стойност ± SEM.
3 РЕЗУЛТАТА
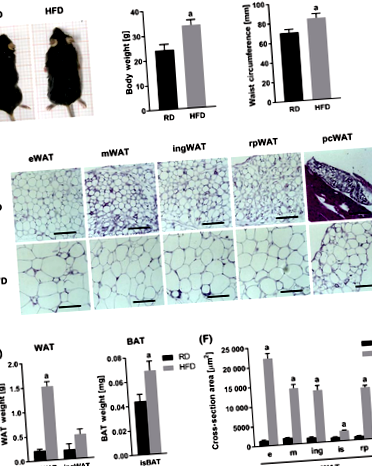
3.1 Телесно тегло и мастна тъкан
Изложени изхранвани с HFD мишки
40% увеличение на телесното тегло (Таблица 1 и Фигура 1А и В) и
20% увеличение на коремната им обиколка (Таблица 1 и Фигура 1C). Различават се и се анализират различни депа за WAT (епидидимална WAT (eWAT), мезентериална WAT (mWAT), ингвинална WAT (ingWAT), ретроперитонеална WAT (rpWAT) и перикардна WAT (pcWAT)) и BAT (интерскапуларна (isBAT)) (Фигура 1D ). Увеличението на телесното тегло при мишките с група HFD се дължи главно на натрупването на eWAT (Таблица 1 и Фигура 1Е). Значително увеличение на натрупването на мазнини също е установено в депо isBAT (Таблица 1 и Фигура 1Е). Във всички изследвани депа за WAT режимът на HFD доведе до значително увеличение на размера на адипоцитите (Фигура 1D, F и Таблица 1).
3.2 Черен дроб
Хранените с HFD мишки развиват по-големи черен дроб (Фигура 2А), които са значително по-тежки от тези на мишките от групата на RD (Таблица 1 и Фигура 2Б). Визуално черният дроб от хранените с HFD животни се отличава от тези на мишките от групата на RD като бледо на цвят (Фигура 2А). Микроскопското изследване на тъканни стъкла разкрива по-високо натрупване на хепатоцитни липидни капчици в черния дроб от HFD, в сравнение с тези от групата на RD (Фигура 2C и D, и Таблица 1).
3.3 Хронично възпаление
Отличителна черта на затлъстяването е по-високата честота на смъртност на адипоцитите и инфилтрацията на моноцити и макрофаги, образуващи короноподобни структури (CLS) (Фигура 3А). Изследването на WAT проби показва по-високо присъствие на CLS в WAT от мишки, хранени с HFD, в сравнение с тези на RD (Фигура 3В и Таблица 1). Мишките от групата на HFD също показаха значително по-високи нива на базалната циркулация на проинфламаторни цитокини (фактор на туморна некроза-алфа (TNF-α), интерлевкин-6 (IL-6), лептин, моноцитен хемоаттрактант протеин-1 (MCP-1), плазминоген активатор инхибитор-1 (PAI-1) и резистин) (Фигура 3С и Таблица 2).
| TNF-α [pg/ml] | 6,60 ± 0,73 | 12,62 ± 0,50 | .0209 |
| IL ‐ 6 [pg/mL] | 15,95 ± 4,97 | 59,95 ± 6,43 | .0002 |
| Лептин [ng/ml] | 0,45 ± 0,10 | 11,27 ± 2,68 | .0024 |
| MCP ‐ 1 [pg/mL] | 12,57 ± 4,22 | 27,69 ± 4,45 | .0328 |
| PAI ‐ 1 [ng/mL] | 1,46 ± 0,12 | 2,36 ± 0,31 | .0151 |
| Резистин [ng/mL] | 0,77 ± 0,04 | 2,04 ± 0,29 | .0008 |
- Стойности на P ≤ .05 са отбелязани с удебелен шрифт.
- Съкращения: RD, редовна диета; HFD, диета с високо съдържание на мазнини; TNF-α, фактор на туморна некроза-алфа; IL-6, интерлевкин-6; MCP ‐ 1, моноцитен хемоаттрактант протеин ‐ 1; PAI ‐ 1, инхибитор на плазминогенов активатор ‐ 1.
3.4 Инсулинова чувствителност
Както нивата на кръвната глюкоза на гладно, така и плазмените инсулини са значително повишени при мишките с група HFD (Фигура 4А и Таблица 3). Въз основа на тези измервания изчислихме индекса на инсулинова резистентност, като използвахме количествен индекс за проверка на инсулиновата чувствителност (QUICKI) и индекс на оценка на модела на хомеостазата (HOMA). Хранените с HFD мишки показаха по-ниски индекси на QUICKI и по-високи индекси на HOMA-инсулинова резистентност (HOMA-IR) (Фигура 4В и С и таблица 2). Въпреки че имаше тенденция за нарушена функция на β-клетките, изчислена въз основа на HOMA индекса (HOMA%% β-клетки (HOMA‐% B)), не открихме никаква статистически значима разлика между двете групи животни ( Фигура 4С и Таблица 3). Мишките от групата на HFD демонстрираха значително нарушена инсулинова чувствителност въз основа на стойности на HOMA индекс (HOMA% чувствителност (HOMA% S)) (Фигура 4С и Таблица 3).
4. ДИСКУСИЯ
Моделите DIO на мишки се оказаха безценни за проучвания за хронично възпаление и инсулинова резистентност. Съществуват разнообразни модели на затлъстяване с HFD мишка с инсулинова резистентност, показващи различни патофизиологични реакции. Тук изследвахме ефекта от 9-седмично HFD хранене при мъжки мишки C57BL/6J с диета, осигуряваща 60% енергия от мазнини върху развитието на инсулинова резистентност и хронично възпаление. Заключихме, че този животински модел би могъл да бъде подходящ за проучвания, които имат за цел да изследват подходи за превенция и лечение, насочени към относително ранните етапи на свързаната със затлъстяването патология.
ПРИЗНАВАНИЯ
Тази работа беше подкрепена от безвъзмездните средства от Джералд Дж. И Дороти Р. Фридман Нюйоркска фондация за медицински изследвания.
- Борба с PCOS с диета Изчерпателна книга за диети за инсулинова резистентност за жени, които имат PCOS за борба
- Намалява ли кетогенната диета дългосрочно инсулинова резистентност
- Сърдечната дисфункция, предизвикана от диета с високо съдържание на мазнини, е свързана с променен инсулин на миокарда
- Диета и възпаление в дерматологията - практична дерматология
- Сравнение на нискокалорична високо протеинова и нискокалорична стандартна протеинова диета с обиколка на талията