OA Mogilnaya
1 Институт по биофизика СО РАН, Академгородок, 50, 660036, Красноярск, Русия
AP Puzyr
1 Институт по биофизика СО РАН, Академгородок, 50, 660036, Красноярск, Русия
А. В. Барон
2 Институт по фундаментална биология и биотехнологии, Сибирски федерален университет, проспект Свободен 79, 660041, Красноярск, Русия
VS Бондар
1 Институт по биофизика СО РАН, Академгородок, 50, 660036, Красноярск, Русия
Резюме
Хематологичните параметри и състоянието на чернодробните клетки на плъхове бяха изследвани in vivo, след като животните получиха афлатоксин В1 (AfB1) самостоятелно и заедно с модифицирани нанодиаманти (MND), синтезирани чрез детонация. Плъховете, които са получили MND хидрозол, са имали повишени нива на левкоцити, главно поради по-висок брой гранулоцити и малко увеличен брой на моноцитите в сравнение с контролните плъхове. Хематологичните параметри на плъховете, които са получавали само AfB1, се различават от тези на контролните плъхове по друг начин: общият брой на белите кръвни клетки е значително по-нисък поради намаления брой на лимфоцитите. При плъхове, които са консумирали AfB1 с хидрозола MND, промените в хематологичните параметри са по-слабо изразени, отколкото при плъхове, които са консумирали AfB1 или MND. Електронната микроскопия показа, че хепатоцитите на плъховете, които са получили MND хидрозола или AfB1 с MND хидрозола, съдържат повишени нива на липидни включвания и лизозоми. Хиперплазия на гладкия ендоплазмен ретикулум (EPR) е разкрита в чернодробни образци на плъхове, получили AfB1. Резултатите от изследването предполагат заключението за взаимно смекчаване на ефектите от наночастиците и микотоксина върху кръвта и чернодробните клетки на плъхове, след като AfB1 се адсорбира върху MND.
Въведение
Афлатоксините са вторични метаболити, произвеждани от Aspergillus - широко разпространен род плесенни гъби. Хранителните и фуражните продукти, заразени с плесенни гъби, могат да бъдат замърсени с афлатоксини. Това е сериозна опасност за здравето на животните и хората, тъй като афлатоксините са мутагенни и канцерогенни. Афлатоксин В1 (AfB1) е най-опасният микотоксин в тази група и няма прагова концентрация за неговия токсичен ефект. Основната цел на AfB1 е черният дроб и той претърпява трансформации в хепатоцитите: биотрансформация в активен AfB1-8,9-епоксид, който се свързва с ДНК; необратимо хидроксилиране, образувайки метаболити M1, P1 и Q1; обратимо хидроксилиране, образувайки афлатоксикол [1-5]. Афлатоксините, които попадат в животински и човешки стомашно-чревни системи със замърсена храна, могат да бъдат смекчени от различни ентеросорбенти [6-9].
Модифицирани нанодиаманти (MND), синтезирани чрез детонация, могат да бъдат предложени като чревен адсорбент на микотоксини. Силно развитата MND повърхност, както и наличието на различни химически активни функционални групи, въглеводородни фрагменти и метални микро примеси на повърхността на наночастиците, определя техния висок афинитет за сорбция на биомолекули [10-12]. Някои физикохимични свойства на нанодиамантената повърхност са представени в работата на Gibson et al. [13]. MND имат добра колоидна стабилност в дисперсионните среди и са пригодени за биологични и медицински изследвания. По този начин, MND хидрозолите могат да се използват за всички видове инжекции и орално приложение на наночастици на животни в дългосрочни експерименти. В експерименти с животни доказахме, че MND са силно биосъвместими [14]. Ниска токсичност на нанодиамантите е докладвана от A. Schrand et al. [15].
В това проучване изследвахме ефекта на AfB1 върху хематологичните параметри и състоянието на чернодробните клетки на плъхове, които перорално са приемали AfB1 самостоятелно и заедно с MND.
Експериментални произведения
Проведени са експерименти върху възрастни плъхове Wistar, които са били държани във вивариум при подобни условия. Плъховете бяха разделени на случаен принцип в 4 групи (3 животни на група). Всеки плъх беше държан в собствена клетка. Животните от контролата (група 1) пиеха вода. Животните от третираните групи пият MND хидрозол, съдържащ 0,4 тегл.% Наночастици (група 2), воден разтвор на AfB1 (група 3), MND хидрозол (0,4 тегл.%), Съдържащ AfB1 (група 4). Всеки плъх от групи 3 и 4 получава количеството течност, пропорционално на телесната му маса. По този начин общите количества AfB1 на 1 g тегло, получени перорално от плъховете, са равни за всички животни от тези групи. След като плъховете консумираха съдържащи AfB1 течности в продължение на 10 дни, те получиха вода (група 3) или MND хидрозол (група 4) в рамките на приблизително 25 дни. Този 25-дневен период се използва за по-пълно проявление на кумулативния ефект на AfB1 при животни. Общата продължителност на експеримента беше 35 дни.
Афлатоксин В1
AfB1, използван в това проучване, е с аналитичен клас и се доставя от «Ecolan» (Русия) като стандарт за HPLC. Една ампула съдържа 10 μg микотоксин, разтворен в 1 ml ацетонитрил. Воден разтвор на AfB1 се приготвя чрез заместване на дестилирана вода с ацетонитрил.
Подготовка на MND и MND с AfB1
В експериментите са използвани MND от 4 до 250 nm клас (марка RUDDM 0–0,25), получени чрез детонация в „Real-Dzerzhinsk” Ltd. (Русия). MND хидрозолът (0.4 тегл.%) Се приготвя чрез добавяне на дестилирана вода към прах от наночастици. MB-хидрозолът, съдържащ AfB1, се приготвя чрез добавяне на воден разтвор на микотоксин към хидрозола на наночастиците. Количествата свободни AfB1 и AfB1, свързани с наночастици, бяха определени чрез спектрален анализ. За тази цел, след добавяне на воден разтвор на AfB1 към хидрозолните проби на MND, те се разбъркват във Vortex-Genie 2 g-560E (Scientific Industries, Inc., САЩ) в продължение на 10 s и се инкубират в продължение на 2 минути при стайна температура и След това частиците бяха събрани чрез центрофугиране (Centrifuge 5415R, Eppendorf, Германия) при 14 100 g за 10 минути. Способността на наночастиците да се коагулират е използвана за тяхното по-пълно отстраняване. За тази цел образците бяха допълнени с NaCl в концентрация 80–100 mM преди центрофугиране. Получените супернатанти бяха оценени чрез спектрален анализ в диапазона от 200–500 nm на UVIKON-943 UV/VIS спектрофотометър (Kontron Instruments, Италия).
Хематологични и електронно-микроскопски анализи
След края на експеримента взехме проби кръв от животните за хематологичен анализ. Хематологичните параметри бяха оценени с помощта на хематологичен анализатор ABX MICROS-60 (Франция). След това плъховете бяха убити в съответствие с принципите на евтаназия и бяха взети чернодробни проби за изследване с трансмисионно електронно микроскопско изследване (TEM). Проби от чернодробна тъкан се фиксират в 2,5% глутаралдехид в 0,1 М какодилатен буфер при рН 7,2; след това те бяха допълнително фиксирани в 1% разтвор на OsO4 в същия буфер. Пробите се дехидратират в степенувани серии от етанол и в ацетон; след това те бяха вградени в смес от епоксидна смола Epon 812-Araldite M („Serva“). Ултратънките срезове се изрязват с помощта на ултрамикротом Reichert Um-03 (Австрия) и се оцветяват с 3% уран ацетат в 30% разтвор на етанол и 0,2% воден разтвор на оловен цитрат и се изследват в JEM 1400 (JEOL, Япония).
Данните са обработени статистически от софтуера Microsoft Excel 2003. Нивото на доверие е α = 0,05.
Резултати и дискусия
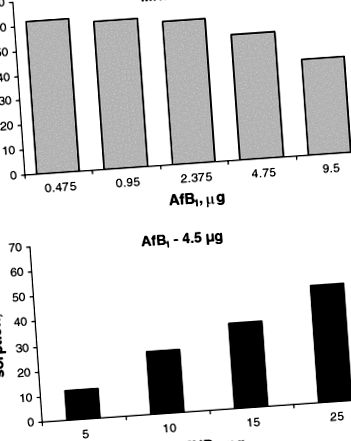
Нашите по-ранни експерименти in vitro показаха, че добавянето на MND води до бърза адсорбция на AfB1 от наночастици, времето на инкубация не надвишава 2-3 минути. Увеличаването на времето за инкубация от няколко минути на няколко часа не повишава количеството на адсорбирания микотоксин [11]. Доказано е (фиг. (Фиг. 1) 1), че способността за сорбция на MND на AfB1 зависи от съотношението на микотоксина към сорбента. Например, данните показват, че адсорбцията на малки количества AfB1 достига 60% при 25 mg MND в пробата (1 mL); в този случай обаче капацитетът за сорбция на MND е нисък. С увеличаване на количествата на микотоксина, сорбционният капацитет на наночастиците се повишава с един порядък. Аналогично, увеличаването на количеството MND води до увеличаване на количеството на свързания микотоксин; обаче сорбционният капацитет в този случай намалява.
MND сорбционни характеристики в зависимост от съдържанието на AfB1 в пробата при постоянно количество наночастици (а) и в зависимост от съдържанието на наночастици в пробата при постоянно количество AfB1 (обем 1 ml) (б)
Добре известно е, че животинските видове проявяват различна устойчивост към токсичния и канцерогенен ефект на AfB1. Това беше причината, поради която проведохме експерименти върху плъхове: те са по-чувствителни към AfB1, отколкото например мишки [16]. Всеки плъх от група 3 получава 0,1 μg AfB1 на грам тегло по време на експеримента. Същото количество AfB1 се прилага перорално с MND хидрозол на всяко животно от група 4. Спектралният анализ показва, че 81% от микотоксина, съдържащ се в MND хидрозола, се адсорбира върху наночастици и 19% е свободен (Фиг. (Фиг. 2 2).
Спектрални параметри на водния разтвор на AfB1 и супернатанта в резултат на смесване на водния разтвор AfB1 и MND хидрозола и последващо центрофугиране за отстраняване на наночастици с адсорбиран микотоксин
Анализът на кръвни проби, взети от животни от различни групи, показва следните разлики в хематологичните параметри (фиг. (Фиг. 3). 3). Кръвта на плъхове от група 2 съдържа значително по-високи нива на левкоцити от кръвта на контролните животни (група 1), вероятно поради значително увеличение на гранулоцитите. По-рано направихме предположението, че увеличаването на общото ниво на белите кръвни клетки при мишки, получили орално MND, може да бъде следствие от взаимодействието между наночастици и стомашно-чревни макрофаги [17]. Плъховете от група 3 са имали по-ниски нива на левкоцити, очевидно поради значително (повече от два пъти) намаляване на броя на лимфоцитите. Това може да е показателно за влошаване на имунния статус при плъховете от тази група в отговор на токсичния ефект на AfB1. Данните от литературата показват, че различните дози AfB1 могат или да стимулират, или да потискат имунната система на организма [18-20]. Животните от група 4, които са получили AfB1 с хидрозола MND, показват по-слабо изразени различия в общото ниво на левкоцитите, включително тези в броя на лимфоцитите и гранулоцитите, от съответните параметри на плъхове от група 1.
Нива на левкоцити в кръвта на плъхове, които перорално са получавали вода (контрол), MND хидрозол, воден разтвор AfB1 и AfB1 с MND хидрозол. Забележка: WBC левкоцити, LYM лимфоцити, MON моноцити, GRA гранулоцити. Хематологичните параметри бяха определени в края на експеримента
Не са открити значителни разлики между броя на еритроцитите на който и да е от лекуваните плъхове и контролната група (фиг. (Фиг. 4а). 4а). Броят на тромбоцитите е по-висок при животните от група 2 и 3 (фиг. (Фиг. 4б). 4Ь). Броят на тромбоцитите в кръвта на плъховете от група 4 обаче е подобен на този на животните от група 1. Според нас тези резултати могат да предполагат взаимно смекчаване на ефектите на MND и AfB1 (след като микотоксинът се адсорбира върху наночастиците) върху белите кръвни клетки. Същото обяснение може да бъде предложено за регистрираните разлики в броя на тромбоцитите между третираните животни и контролната група.
Червени кръвни телца (а) и броя на тромбоцитите (б) при плъховете от третираните групи и контролните животни. Хематологичните параметри бяха определени в края на експеримента
Ултраструктура на хепатоцити на животни: а Плъхове от група 1, които перорално са получавали вода, б Плъхове от група 2, които перорално получават MND хидрозола, ° С Плъхове от група 3, които перорално са получили водния разтвор AfB1, д Плъхове от група 4, които перорално са получавали AfB1 с хидрозола MND. Лента - 2 μm. Стрелките показват хиперплазия на гладък ендоплазмен ретикулум в изображение на хепатоцити. Забележка: n ядро, m митохондрии, липидни включвания на устните, лизозоми
Заключение
По този начин, резултатите от изследването на хематологичните параметри на кръвта и състоянието на чернодробните клетки на плъхове могат да предполагат, че пероралното приложение на AfB1 заедно с MND хидрозола произвежда по-малко токсичен ефект върху животните, отколкото само перорално приложение на AfB1. След като AfB1 се адсорбира върху MND, ефектите на микотоксина и наночастиците трябва да бъдат смекчени взаимно. Нашите предишни експерименти in vitro доказаха, че MND може да адсорбира AfB1 от водни разтвори с подкиселинно, киселинно и алкално рН, които са характерни за различни секции на стомашно-чревната система [11]. Друго предимство на MND като чревен адсорбент е високата степен на адсорбция на AfB1 (процесът отнема не повече от 2-3 минути) и много добра биосъвместимост на наночастиците, доказана чрез експерименти in vivo с животни от различни видове [14]. Следователно, MND може да се предложи като чревен адсорбент за свързване и неутрализиране на микотоксини, по-специално AfB1.
Благодарности
Изследването е финансово подкрепено от Руската фондация за фундаментални изследвания (RFBR) (грант № 06-04-90234) и Президиума на RAS (програма № 27, проект № 64).
Свободен достъп
Тази статия се разпространява при условията на некоммерческия лиценз Creative Commons Attribution, който позволява всякакво нетърговско използване, разпространение и възпроизвеждане на какъвто и да е носител, при условие че оригиналните автори и източник са кредитирани.
- Устни отзиви за Claritin и оценки на потребителите Ефективност, лекота на използване и удовлетворение
- Почистете черния дроб и отслабнете за 72 часа с тази напитка; Модната домакиня
- Почистване на червата и черния дроб - Parkland Natural Health
- Лесни начини за отслабване за здравословен черен дроб - Amsety
- Дебела чернодробна болест Бостън деца; s Болница