Резюме
Следователно целта на настоящото проучване е да се определи дали появата на инсулинова резистентност в скелетните мускули, причинена от остра липидна и инсулинова инфузия, е свързана с дефектна инсулинова сигнализация.
Животни
Всички хирургични и експериментални процедури са одобрени от Комитета по етика на животните (Институт Гарван/Болница Св. Винсент) и са в съответствие с насоките на Националния съвет за здравни и медицински изследвания на Австралия за експериментиране с животни.
Възрастни мъжки плъхове Wistar (Animal Resources Center, Perth, Australia) са били поместени в общи условия при 22 ± 0,5 ° C с контролиран 12: 12-часов цикъл светлина-тъмнина (светлините са включени от 0700 до 1900). Хранени са ad libitum със стандартна диета за гризачи (диета за поддържане на плъхове, Gordons Specialty Feeds, Сидни, Австралия), съдържаща 10% мазнини, 69% въглехидрати и 21% (тегло/тегло) протеин плюс фибри, витамини и минерали. След 1 седмица на аклиматизация, плъховете се упояват с комбинация от кетамин (Ketalar, 80 mg/kg) и ксилазин (Ilium Xylazil, 20 mg/kg), инжектирани интраперитонеално. Канюлите са имплантирани в дясната и лявата югуларна вена при асептични условия. Катетрите бяха екстериоризирани в задната част на врата. Плъховете се настаняват индивидуално след операцията и се обработват ежедневно, за да се сведе до минимум стресът. Средното телесно тегло в експерименталния ден е 300-350 g.
Липидна инфузия
Аналитични методи
Нивата на кръвната и плазмената глюкоза се определят чрез метод на имобилизирана глюкоза оксидаза (модел YSI 2300, Yellow Springs Instruments, Yellow Springs, OH). Плазменият инсулин се измерва чрез комплект за радиоимуноанализ (Linco, Сейнт Луис, МО). Нивата на нестерифицирани мастни киселини в плазмата (NEFA) бяха определени спектрофотометрично, използвайки наличен в търговската мрежа комплект (NEFA-C, WAKO Pure Chemical Industries, Осака, Япония).
Измерват се плазмени и тъканни нива на 3 H- и 14 С-белязани маркери, както е описано по-горе, за да се изчисли усвояването на глюкоза в цялото тяло и мускулите; също бяха изчислени концентрацията на гликоген в тъканите и [14 C] степента на включване на глюкозата в гликоген (23). Червените квадрицепси (RQ) триглицериди се екстрахират, използвайки метода на Folch et al. (10) и количествено определени с помощта на ензимен колориметричен метод (GPO-PAP реагент, Roche Diagnostics). DAG, церамид и дълговерижни ацил-КоА (LCACoAs) бяха извлечени и количествено определени съгласно публикувани методи (2, 41). Активността на комплекса на пируват дехидрогеназа (PDH) (PDHC) беше измерена в хомогенати от цяла тъкан, приготвени в 5 об. 50 mM калиев фосфат, 10 mM EGTA, 2 mM дитиотреитол, 2% BSA, 10 μg/ml апротинин, 10 μM левпептин и 1 mM PMSF. PDHC активността се определя спектрофотометрично при 30 ° C, както е описано по-горе (27). PDHC активността се изразява по отношение на цитрат синтазната активност, която се определя при 30 ° C, както е описано по-рано (35).
Хомогенатите на скелетните мускули бяха подложени на екстракция на протеини и имуноблотинг, както беше описано по-рано (22). Денситометрията се извършва с помощта на софтуера IPLab Gel (Signal Analytics, Виена, Вирджиния). Антитела за анти-инсулинов рецептор-β са получени от BD Biosciences (Сан Хосе, Калифорния); анти-фосфо-Tyr 1162/63 инсулинов рецептор от BioSource International (Camarillo, Калифорния); анти-фосфо-Tyr 612 IRS-1 от Sigma-Aldrich (Сейнт Луис, Мисури); анти-Akt, анти-фосфо-Ser 473 Akt, анти-гликоген синтаза киназа (GSK) -3β, анти-GSK3α, анти-фосфо-Ser 21/9 GSK3α/β, анти-IRS-1, анти-IκBα, анти -phospho-Thr 183/Tyr 185 JNK и anti-JNK от Cell Signaling Technology (Danvers, MA); анти-AS160 от Биотехнология на Upstate (Лейк Плесид, Ню Йорк); и анти-14-3-3β от Santa Cruz Biotechnology (Санта Круз, Калифорния). Anti-phospho-Thr 642 AS160 е подарък от Symansis (Окланд, Нова Зеландия).
Статистически анализ
Статистическите анализи бяха извършени с помощта на Prism5 (Graphpad Software, Сан Диего, Калифорния). Различията между съответните групи бяха оценени с помощта на несдвоени студентски т-тест или ANOVA с Tukey-Kramer post hoc тестове, според случая. P 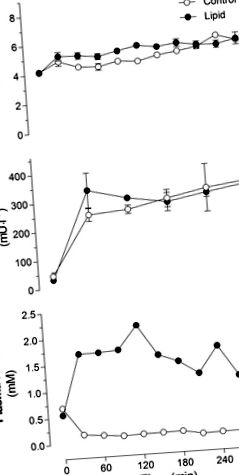
Фиг. 1.Кръвна захар (A), плазмен инсулин (Б.) и плазмени нестерифицирани мастни киселини (NEFA; ° С) при плъхове, инфузирани с липид или глицерол (контрол) в продължение на 5 часа. Стойностите са средни стойности ± SE (н = 10–12 плъхове на група).
Глюкозен метаболизъм и инсулинова чувствителност
Метаболизъм на глюкозата в цялото тяло.
GIR, необходим за поддържане на еугликемия, е бил стабилен по време на 5-часовата инфузия за контролната група (Фиг. 2А). В групата, инфузирана с липиди, GIR е стабилна през първите 2 часа, но е значително намалена след 3, 4 и 5 часа в сравнение с 1 час липидна инфузия (Фиг. 2A). Продължителността на инфузията не е оказала значителен ефект върху изчезването на глюкозата в цялото тяло в контролната група или групата, инфузирана с липиди (Фиг. 2Б.). Няма значителен ефект върху Rd между контролните животни и инфузираните с липиди животни. Изходът на чернодробна глюкоза остава потиснат в контролната група (-0,34 ± 2,24 и 0,97 ± 0,89 mg · min -1 · kg -1 на 3 и 5 часа в контролната група, съответно). Въпреки това, имаше силна тенденция за увеличаване на изхода на чернодробна глюкоза в 5-часовата група с инфузия на липиди в сравнение с 5-часовата група с инфузия на контрола (4,75 ± 0,24 и 10,79 ± 4,12 mg · мин -1 kg/-1 на 3 и 5 часа, съответно, в групата с инфузия на липиди, P = 0,07).
Фиг. 2.Ефект на липидната инфузия върху индексите за инсулинова чувствителност на цялото тяло. A: скорост на инфузия на глюкоза (GIR), необходима за поддържане на евгликемия при плъхове, инфузирани с липид или глицерол и инсулин в продължение на 5 часа. *P
Чувствителност към инсулин на скелетните мускули и метаболизъм на глюкозата.
Способността на инсулина да стимулира усвояването на глюкоза в мускулите на контролните животни беше сходна след 3 и 5 часа инфузия (Фиг. 2° С). Поглъщането на глюкоза в RQ е значително намалено след 5 часа в сравнение с 3 часа липидна инфузия (31%, P = 0,008; Фиг. 2° С). При тибиалис краниалис със смесени влакна и бял квадрицепс също се наблюдава значително намаляване на усвояването на глюкоза след 5 часа в сравнение с 3 часа липидна инфузия [33% (P = 0,005) и 37% (P = 0,04), съответно; данните не са показани]. В съответствие с намаляването на усвояването на глюкоза, in vivo скоростите на синтез на гликоген в RQ мускулите са значително намалени в 5-часовата група, вливана с липиди, в сравнение с 3-часовата група, вливана с липиди (38%, P = 0,02; Фиг. 2д). Това намаляване на скоростта на синтеза на гликоген не е свързано със съдържанието на гликоген, което е подобно на съдържанието на гликоген в контролната група (Фиг. 2Е.).
Сигнализиране за инсулин на скелетните мускули.
За да се определи дали промените в инсулиновата сигнализация са съпътствали развитието на инсулинова резистентност в RQ, е изследвано състоянието на активиране на няколко ключови компонента на инсулиновия сигнальен път, участващи в метаболизма на глюкозата. Фосфорилиране на инсулиновия рецептор (Tyr 1162/1163; Фиг. 3A) е увеличен и остава повишен при контролни и инфузирани с липиди животни. Освен това, фосфорилирането на IRS-1 (Tyr 612) беше значително увеличено и поддържано при контролни и инфузирани с липиди животни (Фиг. 3Б.). Фосфорилиране на Akt (Ser 473; Фиг. 3° С) и неговите цели надолу по веригата, участващи в метаболизма на глюкозата, AS160 (Thr 642; Фиг. 3д), GSK3β (Ser 21; Фиг. 3Е.) и GSK3α (Ser 9; Фиг. 3F), се увеличава и поддържа с продължителен контрол и липидна инфузия. Няма промяна в експресията на общия протеин на нито един от тези сигнални компоненти. Денситометричните измервания не показват значително намаляване на състоянието на фосфорилиране за повечето междинни продукти между контролните и липидните животни в рамките на 3 или 5 часа, въпреки значителното увреждане на усвояването на глюкоза през този период на липидна инфузия (Фиг. 2° С).
Фиг. 3.Ефект на липидната инфузия върху междинните сигнали за инсулин на скелетните мускули, изразен като съотношение на фосфорилиран (p) към общ (t) междинен продукт. A: активиране на инсулиновия рецептор (IR) (Tyr 1162/63). Б.: активиране на инсулинов рецептор субстрат 1 (IRS-1) (Tyr 612). ° С: Akt (Ser 473). д: AS160 (Thr 642). Е.: гликоген синтаза киназа (GSK) -3β (Ser 21). F: GSK3α (Ser 9). Междинните продукти се измерват в червен квадрицепс в основното състояние и след 3 и 5 часа глицеролова или липидна инфузия при наличие на хиперинсулинемия. Стойностите са средни стойности ± SE (н = 5-7 плъхове на група). *P
Възпалително сигнализиране на скелетните мускули.
Предполага се възпалителна сигнализация като механизъм, който може да наруши инсулиновата сигнализация (47). Няма промяна в общото съдържание на протеин в IκBα, който се използва като сурогатен маркер на IKK-NF-κB сигнално активиране, в липидна или контролна група (фиг. 4).A). Фосфорилирането на JNK също не е променено при продължителен контрол или липидна инфузия (Фиг. 4Б.). Липсата на промени във възпалителната сигнализация е в съответствие с липсата на промени в инсулиновата сигнализация при този модел на хиперинсулинемия и хиперлипидемия.
Фиг. 4.Ефекти от липидната инфузия върху сигналите за възпаление на скелетните мускули. IκBα и JNK (Thr 183/Tyr 185) са измерени в червени квадрицепси от контролни и инфузирани с липиди животни в присъствието на инсулин.
Съдържание на липиди в скелетните мускули.
Налице е значително увеличение на съдържанието на триглицериди след 5 часа липидна инфузия в сравнение с 3 часа липидна инфузия и 5 часа контролна инфузия (P
Фиг. 5.Ефекти от липидната инфузия върху липидни междинни продукти на скелетните мускули: триглицерид (A), диацилглицерид (Б.), керамид (° С) и дълговерижен ацил-КоА (LCACoA, д) съдържание и натрупана експозиция (вложки). Липидните междинни продукти са измервани в червени квадрицепси от контролни и инфузирани с липиди животни в присъствието на инсулин. Стойностите са средни стойности ± SE (н = 5-7 плъхове на група). #P
Инсулинът бързо потиска съдържанието на LCACoA в контролната група и групата, вливана с липиди, и остава подтиснато по време на контролната инфузия (Фиг. 5д). Съдържанието на LCACoA обаче показва тенденция към увеличаване след 3 часа липидна инфузия в сравнение с контролната инфузия. Натрупаната експозиция на LCACoA по време на инфузията (измерена като площ под кривата) се увеличава със 70% при липидна инфузия в сравнение с контролната инфузия (Фиг. 5д, вложка). Предполага се, че LCACoAs инхибират активността на хексокиназата (HK) и по този начин влияят върху усвояването на глюкозата (46). Като индиректен маркер на активността на HK, има 34% намаление на съотношението на [3 H] 2DG-6-фосфат към [3 H] 2DG след 5 h липидна инфузия в сравнение с контролната група (5.70 ± 1.55 vs. 3,77 ± 0,84). Това представлява потенциален механизъм, чрез който скоростта на усвояване на глюкозата и синтеза на гликоген е намалена при животни, инфузирани с липиди (Фиг. 2, ° С и д), независимо от инсулиново-сигнализиращ дефект (фиг. 3).
Съдържание на PDK и активност на PDHC.
PDHC регулира навлизането на глюкозни въглероди в цикъла на митохондриалната трикарбоксилна киселина (TCA) за пълно окисление до CO2. Активността на PDH се регулира от PDK, който фосфорилира PDH, за да инхибира неговата активност. Съдържанието на протеин в PDK4 е значително намалено от базалните нива (2,07 ± 0,23 произволни единици) след 3 часа контрол или липидна инфузия [42% (P = 0,01) и 30% (P = 0,04), съответно; Фиг. 6A]. PDK4 беше допълнително намален след 5 часа контролна инфузия (28%, P = 0,04). PDK4 обаче е непроменен след 5 часа липидна инфузия и към този момент е значително повишен в сравнение с 5 часа контролна инфузия (59%, P = 0,01; Фиг. 6A). Това показва, че липидната инфузия може да намали способността на инсулина да намалява протеина PDK4.
Фиг. 6.Ефект на липидната инфузия върху съдържанието на скелетната мускулатура на пируват дехидрогеназа киназа (PDK4) (A) и активност на пируват дехидрогеназен комплекс (PDHC) (Б.). Дейностите се измерват в основното състояние и след 3 и 5 часа глицеролова или липидна инфузия при наличие на хиперинсулинемия при червени квадрицепси. Стойностите са средни стойности ± SE (н = 5-7 плъхове на група). *P
За да се определи дали промените в съдържанието на протеин PDK4 са променили активността на неговата цел надолу по веригата, PDHC активността е изследвана. PDHC активността е повишена в сравнение с базалното ниво след 3 и 5 часа контролна инфузия [1,2 пъти (P = 0,02) и 1,7 пъти (P = 0,005), съответно; Фиг. 6Б.]. След 5 часа липидна инфузия PDHC активността е намалена (43%, P = 0,02) в сравнение с 5 часа контролна инфузия, което съответства на по-високото ниво на протеин PDK4.
В това проучване ние изследвахме дали свръхпредлагането на липиди в присъствието на висок инсулин е довело до инсулинова резистентност на скелетните мускули поради инсулинов сигнален дефект. Въпреки инсулиновата резистентност на скелетната мускулатура, не наблюдаваме отслабване на протеиновото фосфорилиране на междинните продукти на инсулино-сигналната каскада, включително инсулиновия рецептор IRS-1, Akt и неговите целеви нива AS160 и GSK3α/β. Инсулиновата резистентност при този модел на хиперлипидемия и хиперинсулинемия потенциално се дължи на промени в активността на PDHC в резултат на променено съдържание на PDK4 и продължителна експозиция на повишен LCACoA. Като цяло, нашите резултати показват, че метаболитната обратна връзка, а не значителни промени в инсулиновата сигнализация, може да медиира появата на инсулинова резистентност в този модел.
Точният механизъм, свързващ повишеното съдържание на LCACoA и намалената активност на PDHC с намаленото усвояване на глюкоза, остава да бъде напълно разрешен. От наблюденията, направени в модела, използван в настоящото изследване, може да се предположи, че намалената активност на PDHC би довела до намален поток през окислителния път на метаболизма на глюкозата. Това може да доведе до алостерично регулиране на ключовите гликолитични ензими от междинни продукти, включително HK от глюкозо-6-фосфат, както и LCACoA. Това възможно намаляване на активността на HK води до намалено усвояване на глюкоза, както беше предложено по-рано, при което стъпката, ограничаваща скоростта, се измества от транспорта на глюкоза към фосфорилирането на глюкозата (13–15, 26).
Като цяло резултатите от настоящото проучване, което предполага роля за метаболитна обратна връзка, допълват тези, докладвани в предишното ни проучване за инфузия на глюкоза (22). Инсулиновата резистентност, генерирана от инфузия на глюкоза, не е свързана с дефекти в състоянието на фосфорилиране на ключови междинни продукти, сигнализиращи за инсулина. Освен това инсулиновата резистентност в модела за инфузия на глюкоза е придружена от намален поток през пътя на синтеза на гликоген, както и намаляване на съдържанието на глюкоза 6-фосфат. Следователно, ние предложихме роля за метаболитна обратна връзка, което доведе до промяна в стъпката за ограничаване на скоростта от транспортиране на глюкоза към фосфорилиране на глюкоза, предшестваща промените в междинните продукти, сигнализиращи за инсулина, участващи в транспорта на глюкоза. Като цяло нашите настоящи и предишни проучвания (инфузия на глюкоза) предполагат, че метаболитната обратна връзка може да бъде първоначален защитен механизъм, който ограничава усвояването на глюкоза в скелетните мускули в опит да се предотврати свръхпредлагането на хранителни вещества.
В обобщение, настоящото проучване съобщава, че появата на инсулинова резистентност в скелетната мускулатура чрез липидна и инсулинова инфузия не е придружена от дефекти в активирането на множество възли на инсулино-сигналния път. Намаленият метаболизъм на мускулната глюкоза при плъхове с хиперлипидемия и хиперинсулинемия обаче е свързан с промени в метаболитите (LCACoA) и важен регулаторен протеин (PDK4).
Това проучване е финансирано от безвъзмездни средства от Националния съвет за здравни и медицински изследвания (NHMRC) на Австралия и Национален институт по диабет и храносмилателни и бъбречни заболявания грант DK-067509. A. J. Hoy е подкрепен от австралийска награда за следдипломна квалификация от Университета на Нов Южен Уелс. N. Turner и M. J. Watt са подкрепени от наградите за кариерно развитие от NHMRC на Австралия. C. R. Bruce е подкрепен от NHMRC Peter Doherty Postdoctoral Fellowship 325645. G. J. Cooney и E. W. Kraegen са подкрепени от NHMRC на Австралийската схема за научни стипендии.
Благодарим на Ема Полкингхорн и Сюзън Бийл за техническата помощ, д-р. Bronwyn Hegarty, Kyle Hoehn и Niil Ruderman за полезна дискусия, както и съоръжението за биологично изпитване в института Garvan за помощ при грижите за животните.
- Инсулиновата резистентност и отслабването действат антаголин Health24
- Инсулинова резистентност, дислипидемия и сърдечно-съдови заболявания при диабет
- Интермитентната хипоксия при обструктивна сънна апнея медиира инсулинова резистентност през мастната тъкан
- Дългосрочно лечение с метформин при юноши със затлъстяване и инсулинова резистентност, резултати от
- Как стресът саботира целите за изграждане на мускули и отслабване
