Резюме
Заден план
Цялото геномно и екзомно секвениране предостави енциклопедия на гени, които участват в развитието и прогресията на рака, като част от програми като Атласът на генома на рака (TCGA). Тези героични усилия разкриха, че много ракови клетки отвличат дефинирани пътища на рак чрез придобити мутации, които активират онкогени или инактивират туморни супресори [1]. И все пак, тези усилия също така демонстрират, че генетичният произход на различните видове рак е изключително хетерогенен, което води до голям брой случаи с неточна прогноза и неефективни химиотерапевтични лечения. Прецизната терапия срещу рак, която има за цел да приспособи схемата на лечение към уникалния генетичен фон на всяко заболяване, е целенасочен и обещаващ подход. Тази стратегия разчита на насочване към определени мутанти при използване на техните генетични зависимости чрез идентифициране и механистична характеристика на генетичните взаимодействия, участващи в туморогенезата, отговора на лечението и развитието на лекарствена резистентност.
В тази статия ние обсъждаме скорошни целенасочени, геномни и високопроизводителни скринингови проучвания, които са използвали двойна загуба на функция, химико-генетично взаимодействие и комбинации от методи за генно активиране и инхибиране, за да идентифицират съответните генетични взаимодействия. Ние също така правим преглед на тръбопроводите за клъстериране и анализ, използвани в екраните за генетично взаимодействие с висока производителност за бързо превеждане на генерираните данни в ефективни терапии за лечение на рак. Освен това предлагаме комбинирането на екрани за генетично взаимодействие с ортогонални количествени подходи за генериране на глобални мрежи може да улесни развитието на рационални комбинирани терапии.
Генетични взаимодействия като терапевтични цели при рак
Използването на инхибитори на PARP1 като монотерапия за пациенти с BRCA-мутирал рак показва колко ефективни могат да бъдат скринитите за летална синтетичност за разработване на лекарства. И все пак, както при много други терапии, резистентността към инхибиторите на PARP1 възниква при напреднало заболяване, което предполага, че най-ефективните отговори на лечението с инхибитори на PARP1 могат да бъдат предизвикани или в ранен стадий на заболяването, или чрез разработването на рационални лекарствени комбинации [16]. За да се справят и с двата въпроса, няколко клинични проучвания в момента оценяват ефикасността на терапиите, които комбинират инхибитори на PARP1 с химиотерапия или специфични за мутацията инхибитори (ClinicalTrials.gov справка NCT02576444) [17]. Инхибиторът на PARP нирапариб също е тестван за използване като поддържаща терапия при чувствителен към платина рак на яйчниците, независимо от неговата BRCA1 статус [18]. Средната продължителност на преживяемостта без прогресия е значително по-голяма при пациентите, получаващи нирапариб. Тези резултати, заедно с наблюдението, че около 50% от епителните пациенти с рак на яйчниците без BRCA1 мутациите показват дефектна хомоложна рекомбинация, вече показват потенциалния по-широк обхват на тези PARP инхибиторни терапии [19].
Следователно разработването на екрани за високоефективно генетично взаимодействие със стабилен анализ и клъстериране на тръбопроводи е наложително за ускоряване на идентифицирането на нови синтетично-летални или други генетични взаимодействия, които могат да се лекуват, и за насочване на подобреното предсказване на лекарствени синергии и рационални комбинирани лекарствени терапии.
Ракови модели в клетки на бозайници и техните приложения при откриването на противоракови лекарства
Ключовите двигателни мутации, причиняващи онкогенеза, и факторите, свързани с пренареждането на раковите клетки в отговор на терапията, остават неясни. Систематичните и високопроизводителни подходи за дисекция на тези функционално взаимосвързани пътища могат да бъдат от клинична полза. Неотдавнашните усилия за идентифициране на генетични взаимодействия в платформа с висока производителност включват комбинаторни двойни смущения на два гена в масивен или широкогеномен формат (Таблица 2). Най-често срещаните до момента подходи са двойни генни нокаути или комбинация от генно нокаут и инхибиране на наркотици. По-скорошен и по-малко изследван подход е да се комбинира генно активиране с генно инхибиране, въпреки че активирането на мутирал ген в момента не е осъществимо в клиниката.
Двойни методи за загуба на функция
Картиране на химико-генетични взаимодействия
Количествените химико-генетични изследвания, при които инхибирането от дадено съединение се комбинира с генно нокаутиране или нокаут, са алтернатива на двойните генни смущения [34, 35]. Например, разследването на влиянието на нокдауна на 612 ДНК-репарация и релевантни на рака гени върху отговора на 31 химиотерапевтични съединения разкри, че мутациите на загуба на функция в ARID1A и GPBP1 допринасят за PARP инхибитора и платиновата резистентност в MCF10A, не-туморогенна човешка епителна клетъчна линия на гърдата [34]. Този резултат е в контраст с констатациите от друг химико-генетичен скрининг, който тества изогенни ARID1A-дефицитни MCF10A клетки срещу панел от химиотерапевтични лекарства и инхибитори на ДНК-репарацията [36]. Този екран показва повишена чувствителност на ARID1A-дефицитни клетки към комбинация от йонизиращо лъчение с инхибиране на PARP [36]. Инактивиращи мутации в ARID1A са били открити при множество форми на човешки рак. ARID1A е компонент на комплекса за ремоделиране на хроматин SWI/SNF и е замесен в нехомологично свързване на края (NHEJ), което предполага, че може да бъде важен модулатор на отговора на инхибиторите на PARP и комбинираните терапии.
Картографиране на насочеността на генетичните взаимодействия
Функционалните и модулни данни, получени чрез методи за генетично взаимодействие, може да не успеят да предоставят информация за посоките и регулаторните зависимости. Ортогоналните подходи, които могат да бъдат включени в данните за генетичното взаимодействие за преодоляване на това ограничение, са разгледани в следващите раздели. Този недостатък е отстранен от няколко проучвания. Например в комбинаторни RNAi екрани, проведени през Дрозофила клетки, регулаторната и времевата насоченост е получена чрез математическо моделиране и зависим от времето анализ на диференциални генетични взаимодействия [50, 51].
Съображения за надежден тръбопровод за анализ
Заключението на функционални данни от широкомащабно картографиране на генетична мрежа в човешки клетки изисква стабилни и задълбочени тръбопроводи за анализ на данни. В този контекст работният процес за анализ на данни включва съображения за експериментален дизайн, контрол на качеството и математическо точкуване. Най-ранните проучвания върху използването на генетично взаимодействие за дисекция на функциите на протеиновите комплекси включват E-MAPs в дрожди [47, 53, 54], както беше споменато по-рано. Тези изследвания установиха основните правила по отношение на експерименталния дизайн за изолиране на попадения и изграждане на надеждна карта за генетично взаимодействие. Алгоритмите за изчислително точкуване и групиране, използвани за анализ на данните, включват статистически анализи на силата на всяко генетично взаимодействие, на корелацията между репликатите и на групирането на биологични комплекси [55]. Подобни изчислителни алгоритми за точкуване могат да бъдат приложени към системи за бозайници.
В системите на бозайници са проведени няколко високопроизводителни екрана за генетично взаимодействие, като се използва целенасочен подход с известни предварителни познания за мрежите за взаимодействие на гените или пътищата, които трябва да бъдат изследвани [30,31,32, 34, 49]. Този вид подход намалява шума и минимизира потенциала за фалшиви отрицания в данните, позволявайки да се открият по-меки фенотипове. Въпреки че тези по-леки фенотипове може да не са добри цели за монотерапия, те могат да дадат улики за комбинаторния дизайн на лекарствата и за функционалната излишък в раковите клетки. Обещаваща стратегия за комбинаторно откриване на наркотици е насочване към компенсаторни пътища за блокиране на функционални съкращения. С настоящите методологии общогеномното картографиране на тригенни взаимодействия не е тривиално, но тези по-меки фенотипове могат да се използват за прогнозиране на целеви кандидати за комбинаторни лекарства и могат да бъдат тествани в комбинационен, тригенен контекст [56]. В сравнение с целевите екрани, анализът на целия геном позволява безпристрастно определяне на генетични взаимодействия без предварително познаване на физически или функционални мрежи [45, 57, 58]. Широкогеномните екрани имат потенциал да разкрият неочаквани взаимодействия между нехарактеризирани преди това генни двойки (Таблица 2).
Всеки анализ на генетичното взаимодействие, базиран на CRISPR-Cas9, обаче има три основни съображения. Първо, има хетерогенност в ефективността на редактиране, осигурена от различни sgRNAs. Това съображение се отнася за екрани, базирани на CRISPR-Cas9, изпълнявани или в масивен формат, или като обединени библиотеки. В допълнение към използването на най-малко три sgRNAs за всеки целеви ген, количествената оценка на ефективността на редактиране на гени в експерименти с нокаут с масив трябва да се извърши с помощта на инструменти като TIDE (Tracking of Indels by Decomposition) или използване на ICE (Inference of CRISPR Edits) анализ след Последователност на Sanger [59,60,61]. След като се потвърди ефективността на редактиране на гена за всяка sgRNA, корелацията между генотип и фенотип в масивни формати е направо напред. За сравнение, анализът на обединените екрани, обхващащи целия геном, изисква използването на технологии за последователност от следващо поколение (NGS) за корелация на генотип-фенотип.
Второто съображение е променливостта на клетъчната линия. Наборът от данни за рак на геномния рак (TCGA) показва, че 89% от туморите от 33 вида рак съдържат поне една соматична промяна в десет канонични сигнални пътища, за които е известно, че са силно мутирали при рак [1]. Тези данни представляват общи черти между различните видове рак. И все пак прогнозите за прогнозата на заболяването и чувствителността към лекарства при рак са изключително неточни поради разнообразния мутационен пейзаж на отделните тумори. Например, скорошно проучване предполага, че туморната линия определя дали мутациите в BRCA1 и BRCA2 са незаменими основополагащи събития или биологично неутрални събития за туморогенезата [62]. Освен това се предполага, че броят на геномните копия на различни клетъчни линии влияе върху насочването и токсичността на CRISPR след редактиране на генома [63, 64]. Тези наблюдения са показателни за важността на провеждането на екрани за функционално взаимодействие в множество различни клетъчни линии, не само за идентифициране на стабилни синтетични летални или други взаимодействия, но и за идентифициране на по-целенасочени възможности за прецизно лечение.
Трето, трябва да се имат предвид дозировката и времето на дозиране. Важно е, че за екрани, които измерват фенотипа при лечение с наркотици, динамичният обхват на експериментите силно зависи от концентрацията на лекарството и продължителността на лечението. Boettcher et al. [52] показа, че в сравнение с еднократно лечение многократното лечение с лекарства може да позволи по-голямо обогатяване на резистентните гени. За профилиране на хемогенетично взаимодействие, което отчита посочените съображения, наркотичното оценяване е въведено като софтуерен инструмент за идентифициране както на синергични, така и на супресорни взаимодействия [35, 65].
Комбиниране на екрани за генетично взаимодействие с ортогонални количествени подходи за генериране на глобални мрежи
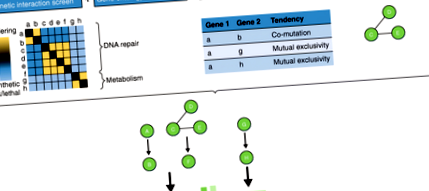
Основна цел на проучванията за картографиране на функционални взаимодействия е да се издигнат проучванията на генната асоциация от идентифицирането на отделни гени, които са свързани с фенотипи, до предоставянето на по-интерпретируема генетична информация за участващите биологични пътища. В допълнение, способността да се комбинират функционални взаимодействия с модули за физическо взаимодействие, за да се изградят глобални мрежи за взаимодействие, е важна за дисекция на ефектите от диференциалните мутации при рак. Екраните за генетично взаимодействие с висока производителност генерират безпрецедентно количество специфични за клетките функционални геномни данни, които могат да помогнат за разкриването на генетични мрежи. Профилите за генетично взаимодействие осигуряват количествено измерване на функционалното сходство. Тези карти могат да се припокриват с различни видове мрежова информация, получена чрез ортогонални подходи за допълнително информиране на функционалната интерпретация и прогнозирането на новата генна функция (фиг. 1) [67]. Тези подходи включват генно-онтологичен анализ, както и анализи на мутационния пейзаж на тумори на пациенти, генна регулация и взаимодействие протеин-протеин.
Хипотетична интеграция на екрани за генетично взаимодействие с ортогонални количествени подходи, за да се даде възможност за идентифициране на пътищата. От наляво да се нали, експерименталният тръбопровод е такъв, че генетичните взаимодействия се оценяват и групират, за да се идентифицират гени, които потенциално участват в същите или паралелни функционално значими пътища и/или в потенциални протеинови комплекси. Тези гени са анотирани с помощта на термините за генна онтология [66]. Мутационният пейзаж на гените от интерес се тества за статистически значима комутация или взаимна изключителност. Провежда се експеримент за съвместно имунопреципитация, за да се идентифицират протеините, които взаимодействат с протеина, кодиран от гена, който ни интересува. Данните, получени чрез тези ортогонални подходи, се комбинират, за да се изведе биологичния път
Заключения и бъдещи указания
Стратегия за рационален дизайн на комбинирана терапия. Взаимодействията се основават на пътя от фиг. 1. Мутацията със загуба на функция в ген а е посочена като мутация на двигател за развитие на рак. Хипотетичният случай показва синтетично-болно взаимодействие между ген а (който участва в възстановяването на ДНК) и ген g (който участва в клетъчния метаболизъм). От наляво да се нали, инхибирането на ген f или ген g в рака (a -/-) води до синтетична болест, но не и до летален изход. Синтетичната леталност в раковия фон се постига само чрез съвместно инхибиране на гените f и g (или на гените f и h)
Към днешна дата екраните за генетично взаимодействие в клетките на бозайници разчитат на диференциалния брой копия на гени и профилите на експресия в раковите клетки и показанията на клетъчната пролиферация. И все пак повечето тумори възникват в резултат на мутация, а не на пълното отсъствие на ген [71]. Разграничаването на мутациите на водача и техните специфични функции ще улесни откриването на целевите пътища. Следователно провеждането на скрининги за генно взаимодействие, използвайки патогенни мутантни версии на целевите гени, а не пълни генни нокаути, ще бъде важно за разработването на лекарства.
Анализите на мутационния пейзаж на туморите показват, че всеки тумор съдържа голям брой соматични мутации. Глобалният мрежов анализ може да разкрие, че тези мутации се сближават в няколко събития в центъра, като протеинови взаимодействия или регулация на транскрипцията. Интегрирането на набори от данни за генетично взаимодействие с други източници на информация, получена чрез ортогонални експериментални и изчислителни инструменти, е предизвикателство и изисква ефективно сътрудничество между молекулярни и ракови биолози, изчислителни биолози и клиницисти. Няколко групи са формирали подобни инициативи за съвместно картографиране в системи на бозайници [73, 75, 82]. В крайна сметка тези усилия обещават да доведат до глобални мрежови карти, които биха могли да позволят прогнози за ефективни комбинации лекарство-мишена за всеки отделен фон от ракови клетки.
- Изборът на здравословен начин на живот може да помогне на жените да преодолеят генетичния център за риск от рак на гърдата
- Възможности за лечение на рак на черния дроб; Разширени терапии CTCA
- Имунотерапия за рак на меланома Мемориал Слоун Кетъринг
- Условия на черния дроб при деца Медицина на Джон Хопкинс
- Въздействие - Интерактивни виртуални презентации - Управление на минута за затлъстяване - Вътрешни болести -