М. М. Мойсенович
Биологичен факултет, Московски държавен университет, Ленински гори, 1-12, 119991, Москва, Русия
А. Ю. Архипова
Биологичен факултет, Московски държавен университет, Ленински гори, 1-12, 119991, Москва, Русия
А. А. Орлова
Биологичен факултет, Московски държавен университет, Ленински гори, 1-12, 119991, Москва, Русия
М. С Друцкая
Биологичен факултет, Московски държавен университет, Ленински гори, 1-12, 119991, Москва, Русия
С. В. Волкова
Биологичен факултет, Московски държавен университет, Ленински гори, 1-12, 119991, Москва, Русия
С. Е. Захаров
Биологичен факултет, Московски държавен университет, Ленински гори, 1-12, 119991, Москва, Русия
И. И. Агапов
Институт по трансплантология и изкуствени органи Шумаков, Федерална агенция за високотехнологични медицински услуги, ул. Щукинская, 1, 113182, Москва, Русия
Академик М. П. Кирпичников
Биологичен факултет, Московски държавен университет, Ленински гори, 1-12, 119991, Москва, Русия
Резюме
Триизмерните (3D) копринени скелета са модифицирани с едно от основните производни на костната тъкан (нано-хидроксиапатит) и/или колагеново производно (желатин). Адхезията и пролиферацията на миши ембрионални фибробласти (MEF) в рамките на скелето бяха увеличени след модификация с нано-хидроксиапатит или желатин. Въпреки това, значително увеличение на адхезията и разпространението на MEF се наблюдава, когато и двете добавки са въведени в скелето. Такива модифицирани композитни скелета предоставят нова и по-добра платформа за изучаване на зарастването на рани, регенерацията на костите и други тъкани, както и биоинженерството на изкуствени органи. Тази система може по-нататък да се прилага за създаване на експериментални модели за изследване на взаимодействията между клетките и субстратите, клетъчната миграция и други сложни процеси, които може да са трудни за справяне с помощта на конвенционалните двуизмерни културни системи.
ВЪВЕДЕНИЕ
Сравнихме свойствата на скелета от фиброин и рекомбинантен спидроин в нашите предишни проучвания. Тези проучвания показват, че регенерираният фиброин поддържа адхезията и пролиферацията на фибробластите (един от основните компоненти, участващи в зарастването на рани и регенерацията на тъканите) в по-малка степен от субстрата, образуван от полимеризиран рекомбинантен спидроин от Nephila clavipes. Намалената способност на фиброиновите материали да поддържат клетъчна адхезия и пролиферация има потенциал да предизвика по-лоша способност за регенериране в сравнение с тази на спидроиновите скелета при експерименти с модел на костно увреждане. Възстановителните свойства на фиброиновите скелета в тези експерименти са значително подобрени чрез използването на минерализация на нано-хидроксиапатит [5]. Въведохме комбинация от две композитни добавки, нано-хидроксиапатит (компонент на костната тъкан) и желатин (производно на колаген), във формулировките на фиброинови скелета, за да подобрим способността им да поддържат адхезията и пролиферацията на фибробластите. Композитният субстрат, образуван от трите компонента, е оптималният материал, който поддържа MEF адхезия и пролиферация.
ЕКСПЕРИМЕНТАЛЕН
Шушулки с бомбицид, Bombyx mori, бяха любезно предоставени от В.В. Богословски, директор на Републиканската станция за изследване на шахтерството на Руската академия на земеделските науки (Железноводск, област Ставропол). Техниката на десерицинизация се използва за получаване на чист фиброин. Серицинът и други примеси се отстраняват от шушулките чрез кипене в 0,03 М разтвор на NaHCO3 (рН 8,4) в продължение на 1,5 часа, последвано от измиване с вода и сушене. Естественият хидроксиапатит е осигурен от проф. В.В. Гузеев (Северски технологичен институт, Национален изследователски ядрен университет МИФИ, Русия).
Производство на скелета
За производството на скеле, претеглена фиброинова проба (250 mg) се разтваря в 1000 µL 10% разтвор на литиев хлорид в 90% мравчена киселина при 60–70 ° C за 30 минути. Смес, съдържаща фиброин (225 mg) и желатин (25 mg) в 1000 µL от разтвора, се използва за образуване на композитно скеле с 10% съдържание на желатин. Полученият разтвор се центрофугира при 12 100 g за 5 минути; супернатантата се използва за оформяне на скелета. 50 µL от предварително нагрятата супернатанта се поставят в матрицата, слой по слой, и се смесват със 100 mg натриев хлорид с различни размери на частиците. Като разширяващ агент бяха използвани кристали NaCl (150–300 µm в диаметър). Претеглена проба от НА прах се смесва с разширяващи се NaCl частици (150-300 µm в диаметър), за да се получат композитни скелета с 30% съдържание на НА. Концентрацията на солта е избрана по такъв начин, че да образува скеле със сложна вътрешна пореста повърхност, свободна от изолирани кухини. Получените проби се сушат при 75–80 ° С в продължение на 3 часа, държат се при стайна температура в продължение на 16 часа, обработват се с 96% етанол за 120 минути, измиват се в бидистилирана вода за 120 минути и се дегазират и съхраняват в 70% етанол.
Сканираща електронна микроскопия (SEM)
Използвана е сканираща електронна микроскопия за изследване на структурата на скелета.
Пробите от SEM бяха приготвени по стандартните процедури: фиксиране в глутарен алдехид и дехидратация в градуирани серии от етанол и ацетон. След това пробите бяха изсушени по метода на критичната точка в сушилня за критична точка HCP-2 (Hitachi Ltd., Япония). Пробите бяха разпръснати със слой злато с дебелина 20 nm в атмосфера на аргон с 6 mA йонен ток и 0,1 mm Hg в Ion Coater IB-3 (Eiko Engineering, Mito, Япония). За сканираща електронна микроскопия се използва микроскоп Camscan S2 (Cambridge Instruments, Cambridge, UK) с разделителна способност 10 nm и работен обем 20 kV (режим SEI). За заснемане на изображения е използван софтуерът MicroCapture (SMA, Русия).
Конфокална лазерна сканираща микроскопия (CLSM)
Използвахме конфокална система за лазерно сканиране (Nikon, Япония), в която Eclipse, клинично обърнат микроскоп за лабораторни изследвания, се комбинира с конфокален модул А1. Размерът на отворите, лазерните параметри и размерът на анализиращия филтър за всички серии оптични секции бяха избрани според препоръките на производителя, за да се постигне висока разделителна способност на изображенията.
Първични култури на GFP, експресиращи миши ембрионални фибробласти
MEF клетки са изолирани от GFP + ембриони на 13,5-ия ден от вътрематочния растеж. Две жени от C57Bl/6 бяха сдвоени с мъж GFP + за една нощ и проверени за вагинални тапи на следващата сутрин. Моментът на откриване на запушалката се счита за 0,5-ия ден от датата на бременността. Мишките бяха евтаназирани на 13,5-ия ден от бременността. Матката беше отстранена; главите и вътрешните органи бяха отделени от ембрионите и експресията на GFP беше определена с помощта на транс-илюминатор. Останалите тъкани бяха асептично нарязани с очни ножици, дисоциирани в 0,05% разтвор на трипсин/EDTA и центрофугирани при 1000 rpm в продължение на 5 минути. Получената клетъчна суспензия се прехвърля в 25 cm 2 колби за култивиране за прилепнал клетъчен растеж (Greiner). Впоследствие клетките се култивират в DMEM, допълнен с 4,5 g/L глюкоза (HyClone) и 10% фетален говежди серум (HyClone) при 37 ° C, 5% CO2 и 95% влажност. Клетките се пасажират в съотношение 1: 3 на всеки три дни, след като достигнат 80-85% сливане. Женските C57Bl/6 са закупени от Фонда за развъждане на животни в Пущино (BIBC RAS); и трансгенните мъже с изразения GFP са любезно предоставени от N.N. Логунова (ISTC RAMS).
Женските C57Bl/6 са закупени от Фонда за развъждане на животни в Пущино (BIBC RAS); и трансгенните мъже с изразения GFP са любезно предоставени от N.N. Логунова (ISTC RAMS).
РЕЗУЛТАТИ И ДИСКУСИЯ
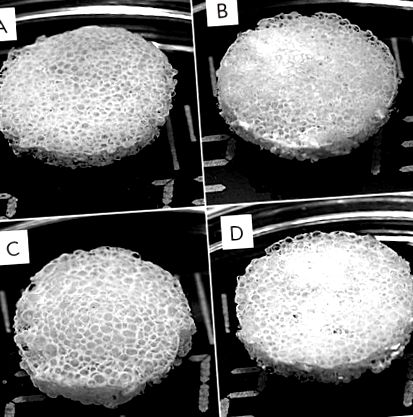
По-рано сме формирали копринени скелета [6] и копринени скелета-HA [5] и сме изследвали биологичните свойства на пилотните проби. Скелето притежава всички характеристики, необходими за костна хирургия; по-специално те са биосъвместими, здрави и порести. Настоящото проучване дава копринени скелета, композитни копринени фиброин-желатин и копринени фиброин-HA скелета и композитни скелета, съдържащи три основни компонента: копринен фиброин, желатин и HA (Фиг. 1). За получаване на тези скелета е избран агент за образуване на пори с предварително зададен диаметър на частиците.
Външен вид на 3D порести копринени фиброини (A) и композитни фиброин – желатин (B), фиброин-хидроксиапатит (C) и фиброин-желатин-хидроксиапатит (D) скелета. Въвеждането на желатин и хидроксиапатит в структурата на скелето не променя външния му вид
Получените тестови проби могат да запазят своята цялост и да придобият предварително зададената цилиндрична форма. Композитните копринени фиброин-желатинови скелета претърпяха еластична деформация под пряко механично налягане, докато копринените фиброин-HA скелета останаха деформирани. Порите на скелета, произведени чрез излугване, имат размери, съответстващи на добавените частици на порообразуващия агент (150-300 µm).
Повърхността на продуктите беше изследвана чрез сканираща електронна микроскопия (SEM) (фиг. 2). Получените скелета имат клетъчна мрежеста структура, напълно свободна от порообразуващия агент (неговите следи никога не са открити в материала) (Фиг. 2, 3). Тестът за пропускливост със суспендирани цветни частици мастило потвърди конюнктивността на порите на скелето.
Структура на 3D порести копринени фиброини (A) и композитни фиброин – желатин (B), фиброин-хидроксиапатит (C) и фиброин-желатин-хидроксиапатит (D) скелета. Изображенията са записани на сканиращ електронен микроскоп. Въвеждането на желатин и хидроксиапатит в структурата на скелето не променя размера на порите и общата структура на скелето
Пореста стена от копринени фиброин (А) и композитни фиброин-желатин (В), фиброин-хидроксиапатит (С) и фиброин-желатин-хидроксиапатит (D) скелета. Изображенията са записани на сканиращ електронен микроскоп. Въвеждането на желатин и хидроксиапатит в структурата на скелето променя фината архитектура на скелета
Изследването на структурата на пробата показа, че количествата желатин и НА в композитно скеле не влияят върху конюнктивността на порите, външния вид на изделията и тяхната пропускливост на мастилото. Три тестови проби имаха еднаква порьозност и външен вид поради факта, че порьозността на веществото се управлява от параметрите на порообразуващия агент (който образува пори с диаметър 150–300 µm) и не зависи от количеството добавки, желатин или ХА.
Диаметърът на порите диктува механичните свойства на структурата и скоростта на нейното биоразграждане; това също влияе върху пост-имплантационната тъканна реакция и клетъчното взаимодействие с повърхността на скелето. По-големите пори улесняват по-добрата и по-бърза интеграция на новообразуваната тъкан, нейната васкуларизация и по-ефективна биорезорбция на присадката.
Триизмерното култивиране на клетки изисква скелета с незатворена структура. Порите, свързани с дупки и канали, образуват сложна, незатворена вътрешна повърхност, която улеснява миграцията на клетките към вътрешните слоеве на изкуствено скеле. Освен това, незатворена структура на порите осигурява условия за обмен на среда и отстраняване на метаболити, като по този начин улеснява образуването на хомогенна среда в рамките на скелето [5, 7-9].
CLSM изследването показа, че водната среда влияе върху целостта и порьозността както на фиброина, така и на всички композитни скелета, нито веднага след потапяне (1 час), нито ден по-късно. Тази характеристика е много важна, тъй като разпадането или промяната на основната структура и физическите характеристики на присадката във водна среда предотвратява използването му in vivo. Липсата на значителни способности за абсорбиране и задържане на вода позволи на артикулите да запазят своите предварително зададени параметри.
Адхезията на зависимите от субстрата клетки върху повърхността на скелето е необходима, за да се запази тяхната жизнеспособност в 3D култура [10, 11]. Субстратът влияе върху производството на извънклетъчни компоненти на матрикса от клетките, неговия синтез и състав. Способността да се поддържа клетъчна адхезия и пролиферация се счита за важен параметър in vitro за биосъвместимост за материал, използван като субстрат [10-12]. Следователно, материал с инхибиращи свойства ще инхибира регенерацията на тъканите in vivo.
Коприненият фиброин е протеин с висока якост, без канцерогенни, токсикогенни или алергенни свойства. Той запазва функционалните си характеристики за даден период, не предизвиква локален възпалителен отговор, не предизвиква разпространение на инфекция и се замества с естествена тъкан на пациента с течение на времето; следователно това е материал, подходящ за регенериране на костна тъкан [5-7].
Фиброинът е амфифилен протеин със значително разпространение на хидрофобни свойства [13]; неговата изоелектрична точка pI е 4.2. Поради този параметър той не се разтваря нито във вода, нито в разредени разтвори на някои киселини и основи [13], докато се зарежда отрицателно при физиологично рН = 7, за разлика от положително заредения спидроин [5], като по този начин клетката намалява адхезия и увеличаване на клетъчната пролиферация [5].
Производно на колаген, желатин, се използва като добавка към композитни материали. Колагенът е основният фибриларен компонент на извънклетъчния матрикс и съединителната тъкан с молекулно тегло 300 kDa. Колагенът се намира в почти всички видове тъкани, като осигурява тяхната здравина и структурна стабилност. По този начин протеинът включва приблизително 30% от общата протеинова маса при бозайниците. Този материал не е токсичен и е слаб алерген; важните недостатъци на колагеновите скелета обаче включват лоши механични свойства и кратко време за биоразграждане (то се регулира от омрежващи агенти само частично, което ограничава живота на колагеновите изделия до един месец). Желатинът е продукт на денатурация на колаген. Съдържа голямо количество глицин, пролин и 4-хидроксипролин, заедно с последователността от три аминокиселини (аргинин, глицин и аспартат - RGD), които се свързват с клетъчните рецептори (интегрини), като по този начин насърчават клетъчната адхезия и пролиферация . Подобни последователности се откриват и в други протеини от клетъчния матрикс; използването им обаче значително увеличава цената на тези продукти.
Изследвахме ефектите на добавките за скеле върху адхезията и разпространението на първичен MEF. Fi- Фиг. 5. Нарастващ брой на миши ембрионални фибробласти (MEF) по време на култивиране върху 3D порест копринен фиброин и композитни скелета Брой клетки в 1 mm2 изглед 1400 1200 1000 800 600 400 200 0 Време на култивиране, дни 1 4 7 Фиброин Фиброин + Желатин Фиброин + HA Фиброин + Желатин + НА бробластите са хетерогенна клетъчна популация, способна да произвежда такива извънклетъчни матрични компоненти като проколаген, фибронектин, проеластин, глюкозни аминогликани, нидоген, ламинин, тенастин и хондроитин-2-сулфат. Фибробластите участват активно в зарастването на рани и епителизацията [14]. Нещо повече, те могат да секретират фактори за растеж на съдов епител (VEGF), като по този начин стимулират ангиогенезата и образуването на лимфни съдове [15, 16]. Избрахме първичната култура на миши ембрионални фибробласти, чийто пролиферативен потенциал е по-висок от този в клетките след раждането.
Нарастващ брой на миши ембрионални фибробласти (MEF) по време на култивирането върху 3D порест копринен фиброин и композитни скелета
Изображенията, записани от CLSM, са поредица от хоризонтални оптични секции на скеле. Налични бяха клетки и конструкции на скеле с дълбочина до 300 µm (фиг. 4). Изображенията са използвани за броене на клетки. Промените в броя на клетките, култивирани на различни скелета с течение на времето, бяха сравнени. Желатинът и HA, въведени в структурата на скелето, подобряват клетъчната адхезия и скоростта на пролиферация (Фиг. 5). По този начин, в рамките на един ден, броят на клетките на композитно скеле е бил 2,5 пъти по-голям от този на скеле на фиброин, докато на 4 и 7 ден той се е увеличил повече от три пъти.
Експресиращи GFP миши ембрионални фибробласти (MEF) върху коприненото фиброиново скеле (A, E, I), композитно скеле от фиброин-желатин (B, F, J), хидроксиапатит (C, G, K), желатин и хидроксиапатит (D, H, L) след 1 (A – D), 4 (E – H) и 7 (I – L) дни на отглеждане. Изображенията показват проекции на повърхността на оптичните секции
ЗАКЛЮЧЕНИЯ
В това проучване са произведени копринени скелета и композитни скелета с желатин и добавки HA. Тези скелета имат незатворена структура, поддържат целостта си и не са механично дезинтегрирани. Модификацията на фиброиновите скелета с желатин и НА едновременно променя свойствата на тяхната повърхност. Тези промени подобряват адхезията и разпространението на MEF в 3D култура, което прави модифицираните скелета обещаващ материал за регенеративна медицина, особено за регенерация на костната тъкан.
Благодарности
Авторите са благодарни на Г.Н. Давидович, ръководител на лабораторията за електронна микроскопия, Московски държавен университет "Ломоносов", за съдействието му при записването на SEM изображения.
Това проучване е извършено върху оборудване, закупено за сметка на Програмата за развитие на Московския държавен университет и оборудване, принадлежащо на CUC MSU; с финансова подкрепа от Министерството на образованието и науката на Руската федерация.
Това проучване е част от Федералната целева програма „Изследвания и развитие в приоритетните области на Научно-технологичния комплекс на Русия за периода 2007–2013 г.“ (Правителствен договор № 14.512.11.0006, от 07.03.2013 г.), Руската фондация за фундаментални изследвания (безвъзмездна помощ) № 14-04-01799) и Институт за наука и технологии „Сколково“ (SkolTech) в рамките на инициативата MIT SkolTech.
- Бърза редукция на 4-нитрофенол, използвайки желатинов хидрогел, съдържащ сребърни наночастици
- Диета на костите на баба Диета Нейната тайна рецепта за отслабване И по-добро здраве от Емили Потс
- Тревен шаран Ефекти от солеността върху оцеляването, отслабването и съдържанието на вода в мускулната тъкан
- Противоречия около заобикалящия прием на протеини с диети наситен ефект и здраве на бъбреците и костите
- Приготвяне на царевичен копринен чай, ползи и странични ефекти - TopicTea