Тревор Дж. Лейборда
Катедра по педиатрия, Университет на Юта, Солт Лейк Сити, UT 84113, САЩ
М Кайл Дженсън
Катедра по педиатрия, Университет на Юта, Солт Лейк Сити, UT 84113, САЩ
Мариан Каван
Катедра по педиатрия, Университет на Юта, Солт Лейк Сити, UT 84113, САЩ
Марк Дено
Катедра по педиатрия, Университет на Юта, Солт Лейк Сити, UT 84113, САЩ. [email protected]
Автор-кореспондент: Марк Дено, доктор по медицина, доцент, катедра по педиатрия, Университет в Юта, Солт Лейк Сити, 81 North Mario Capecchi Drive, UT 84113, САЩ. [email protected]
Телефон: + 1-801-2133599 Факс: + 1-801-5877539
Резюме
Основен съвет: Този преглед предоставя основана на доказателства рамка за ендоскопско и медицинско управление на деца с първичен склерозиращ холангит.
ВЪВЕДЕНИЕ
Първичният склерозиращ холангит (PSC) е хронично възпалително заболяване, характеризиращо се с холестаза и прогресивно стриктуриране и разрушаване на интрахепаталното и екстрахепаталното билиарно дърво. PSC е рядък сред общата педиатрична популация, с честота и разпространение съответно 0,2 и 1,5 случая на 100000 деца. PSC е често срещан при деца с възпалителни заболявания на червата (IBD), засягащи поне 10% от децата с улцерозен колит [1].
Етиологията на PSC е сложна и включва както генетични, така и фактори на околната среда. Идентифицирани са множество аномалии по „оста на червата и черния дроб“, включително дефекти в: имунната регулация, механизмите на хепатобилиарна защита, метаболизма на жлъчните киселини, микробиома и чревната пропускливост. Пациентите претърпяват променлива прогресия през хепатобилиарна фиброза, цироза и краен стадий на чернодробно заболяване (ESLD) със значително повишен риск от холангиокарцином (CCA). В педиатрията повечето случаи на PSC първоначално се представят без усложнения. По-малко от 5% имат ESLD или доминиращи билиарни стриктури (DS) при диагностициране. В рамките на десет години от диагностицирането, 50% от децата ще развият клинични усложнения, включително 30%, изискващи чернодробна трансплантация (LT) [2].
Понастоящем няма медицинска терапия, която да забави прогресирането на чернодробното заболяване или появата на клинични усложнения при PSC. Заболяването се признава като едно от най-големите неудовлетворени нужди в хепатологията [3]. Урсодезоксихолевата киселина (UDCA) и пероралната терапия с ванкомицин (OVT) се използват широко при деца, но бавно прогресиращият характер на PSC възпрепятства адекватно задвижваните клинични изпитвания. Усъвършенстваната ендоскопия играе важна роля за успокояване на PSC, като често е необходима ендоскопска ретроградна холангиопанкреатография (ERCP) за стентиране и балонно разширяване на билиарните стриктури. LT остава единствената възможност за пациенти с PSC с ESLD [4]. Тук правим преглед на често срещаните и нововъзникващи стратегии за лечение на PSC при деца и тяхната роля в управлението въз основа на най-новата литература.
УРСОДЕОКСИХОЛНА КИСЕЛИНА
Един аспект на патогенезата на PSC изглежда е ненормален пул на жлъчните киселини [5-7]. HydroPHOBIC жлъчните киселини могат да бъдат хепатотоксични и високите концентрации, налични в PSC, изглежда са цитотоксични в жлъчното дърво. Пациентите с PSC може да нямат ефективен буферен слой „бикарбонатен чадър“ между холангиоцитите и лумена на жлъчката [8], което комбинира този ефект. UDCA е хидрофилна жлъчна киселина с цитопротективно действие, която се абсорбира лесно през устата. UDCA повишава нивата на хидрофилни жлъчни киселини в жлъчката [9,10] и намалява проявата на антиген на хистосъвместимост от хепатоцитите [11]. UDCA е ефективен за възрастни с първичен жлъчен холангит, друго имунно медиирано заболяване, насочено към жлъчните пътища [12,13]. Ролята му в PSC обаче е противоречива.
ЦЕЛИ ЗА ЛЕЧЕНИЕ И КРАЙНИ ТОЧКИ
Валидирането на биомаркери като сурогатни крайни точки е необходимо в детския PSC. Понастоящем няма приета сурогатна крайна точка, която надеждно да предсказва клиничните резултати при PSC. Няма официално съгласие кои биохимични, рентгенографски или хистологични маркери представляват най-добрия начин за доказване на ремисия или стратификация на пациента като „нискорисков“ или „високорисков“ за прогресиране до чернодробни резултати. Валидирането на сурогатен маркер на активността на заболяването е критично и за дизайна на клиничните изпитвания. Тъй като PSC прогресира бавно, в продължение на години или дори десетилетия, за предпочитане е да се проведе голямо клинично изпитване, което да покаже нормализиране на биомаркер за шест месеца, вместо намаляване на клиничните събития за 5-10 години.
През 2014 г. Международната група за изследване на първичен склерозиращ холангит инициира процес на Delphi за идентифициране на кандидат-сурогатни крайни точки. ALP, вибрационно контролирана преходна еластография (VCTE), чернодробна хистология, ALP и чернодробна хистология в комбинация и общ серумен билирубин са избрани за бъдещо проучване и валидиране [116]. PSC, възникнал от детството, не е бил специално разгледан в този процес на Delphi, а ALP не е полезен биомаркер за детско чернодробно заболяване. Нормалната ALP варира в широки граници при деца и юноши. Стойности от над 500 IU/L са нормални при момчета и момичета на възраст 12-13 години поради бърз растеж и костен обмен [117,118], а стойностите в хиляди са нормални при малки деца с доброкачествена преходна хиперфосфатаземия [119]. Измерването на чернодробно специфични нива на изозим на ALP не е рутинно в клиничната практика. Вместо това нивата на GGT се измерват рутинно в педиатричната клинична практика. GGT няма източник от костите, което избягва объркващия ефект на скелетния растеж, наблюдаван при ALP.
Има все повече доказателства за полезността на GGT като кандидат сурогатна крайна точка в детската PSC. GGT при диагностициране на PSC при деца корелира с дългосрочните резултати, но ALP не [2]. Отговорът на GGT е успореден на други маркери, включително ALP в клинично изпитване на норсурсодезоксихолова киселина [7]. Намаляване на GGT при едногодишен прогнозиран дългосрочен резултат при детски PSC [24]. Повишаването на ALP и GGT в PSC представлява подобен феномен на холестаза и относителна жлъчна обструкция и възпаление. Както е описано по-рано, когато ALP се нормализира при възрастни с PSC, прогнозата е отлична [21]. По този начин нормализирането на GGT изглежда най-практичната цел за лечение на деца. Колкото по-голямо е намалението на GGT, толкова по-добра е общата прогноза, като намалението> 75% представлява най-добрият отговор. Пациентите, които нормализират GGT до по-малко от 50 IU/L, имат най-добрата прогноза като цяло [24]. Необходими са повече изследвания, за да се определи оптималната реакция на GGT в по-кратки срокове. На практика клиничният опит предполага, че оптимален отговор на GGT се наблюдава в рамките на 8-12 седмици, като пациентите достигат най-нисък потенциален GGT към този момент, с малко или никакво допълнително подобрение с продължаваща терапия.
ТРАНСПЛАНТАЦИЯ НА ЧЕРЕН ДЪРВЪТ
LT е единствената ефективна терапия за PSC, която е прогресирала до цироза с краен стадий на чернодробно заболяване. PSC е едно от водещите показания за LT, което представлява 5% от всички LT в Съединените щати [122]. Резултатите след трансплантация за PSC са благоприятни и сравними с други педиатрични чернодробни заболявания с> 90% преживяемост на пациента и присадката на 5 години [123,124].
Хепатобилиарният рак е необичайна индикация за LT при деца, но тези случаи се срещат. Приблизително 1% от пациентите с PSC с детско начало ще развият CCA, главно при тийнейджъри от мъжки пол. Неаадювантната химиолучия, последвана от LT, предлага благоприятни резултати за избрани пациенти [128], вероятно по-добри от резултатите, постигнати с първична хирургична резекция без трансплантация. Няма потвърдени случаи на хепатоцелуларен карцином в голяма кохорта от педиатрични пациенти с PSC [2], но теоретично този риск съществува при всяко хронично чернодробно заболяване. Настоятелно се препоръчва консултация с център за насочване с опит в LT за хепатобилиарни ракови заболявания, за да се подпомогне хирургичното планиране, преди да се подложи на локална операция по резекция.
LT в PSC има уникални периоперативни съображения. Много пациенти имат повтарящи се пристъпи на бактериален холангит преди трансплантацията, с многократно или хронично излагане на широкоспектърни антибиотици. Мултирезистентните организми са от особено значение. Освен това, поради високите нива на съпътстващи IBD и автоимунен хепатит при деца с PSC, много пациенти влизат в трансплантация на имуносупресивни лекарства, създавайки допълнителен риск от опортюнистични и атипични инфекции. С увеличаване на употребата на OVT за PSC при деца, трябва да се внимава за скрининг на пациенти за VRE. Препоръчва се консултация с инфекциозни болести, за да се определи оптималната периоперативна антимикробна профилактика.
Управлението на IBD около LT за PSC е сложно. Нито един протокол за имуносупресия не се е доказал като най-ефективен при контролиране на IBD pre-LT и най-често се препоръчва приемането на IBD управление. По същия начин изборът на имуносупресивен режим след LT е сложен. Нито един режим не е по-ефективен. Установено е, че циклоспоринът и азатиопринът имат защитни ефекти за IBD след LT за PSC, докато микофенолатът и такролимусът са вредни [129]. Аминосалицилатите могат да осигурят защитна полза от рецидив на IBD. Независимо от това, въпреки значителната имуносупресия след LT,> 50% от пациентите ще имат активно заболяване на IBD, което налага допълнителна терапия [130]. Освен това не съществува консенсус относно оптималното време на колектомия, свързана с LT. Въпреки че данните предполагат, че колектомия pre-LT може да предотврати рецидив на PSC, адекватни данни, които да предполагат рутинна колектомия при всички пациенти, не съществуват [131]. Времето на колектомия трябва да се персонализира, като се вземат предвид фактори като тежест на порталната хипертония и тежест на основното IBD. Наличието на диспластични лезии в дебелото черво е абсолютна индикация за колектомия преди LT.
Трансплантацията може да се случи при починали и живи донори с подобен успех. Някои данни предполагат, че дарението, свързано с живота, може да предложи превъзходно оцеляване [132]. Това може да е свързано с по-кратко време на изчакване и по-малко болни по време на трансплантация или поради имунологични прилики и по-ниски нива на рецидив на PSC. Roux-en-Y холедохоеюностомия и жлъчна анастомоза от канал до канал показват подобна едногодишна преживяемост на пациента и присадката при мета-анализ [133]. Пациентите с PSC имат повишен риск от съдова тромбоза след LT [134] и изискват внимателно следоперативно наблюдение и антикоагулантна профилактика.
PSC често се появява отново (rPSC) в трансплантирания черен дроб. rPSC се диагностицира, когато PSC-подобни дуктални лезии и холестаза се появят шест месеца или повече след трансплантацията. Трябва да се внимава да се изключат дуктуларните лезии от съдови усложнения (стеноза или тромбоза на чернодробната артерия), анастомотични билиарни стриктури и CMV инфекции. rPSC се среща при 16% от възрастните пациенти с трансплантация при медиана от 6 години [135]. При децата петгодишният риск от рецидив след LT за PSC е 23%. Преживяемостта на присадката след рецидив е лоша: 53% след пет години [136]. Основната етиология е неизвестна, но свързаните рискови фактори включват по-млада възраст при диагностициране на PSC и/или трансплантация, съжителството на IBD и индукция на тимоглобулин [137]. Едно проучване демонстрира, че ритуксимаб може да предотврати рецидив на заболяването, включително с ABO-несъвместимо дарение на LT [138]. Профилактиката на rPSC изисква непрекъснато проучване като фактори като колектомия (отбелязано по-горе) и оптималните индукционни и поддържащи имуносупресивни режими.
След LT честотата на колоректален карцином е особено висока [139]. Колоректалният рак се среща при почти 20% от всички получатели на трансплантация по време на проследяване. Пациентите с LT с IBD се нуждаят от ежегодно ендоскопско наблюдение за колоректален рак.
ЗАКЛЮЧЕНИЕ
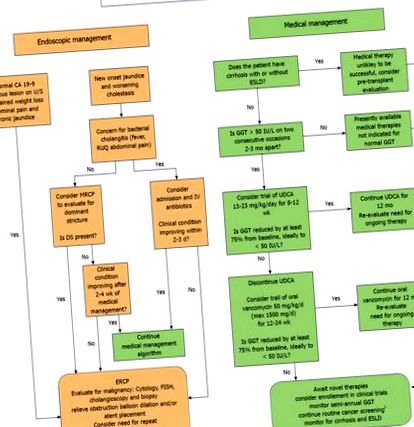
Понастоящем няма конкретни насоки за лечение на деца с PSC. Данните са ограничени и трябва да се свърши много работа за идентифициране на последователно ефективна терапия и за определяне на най-добрите сурогатни биомаркери за отговор на лечението. Поне някои пациенти реагират на UDCA или OVT и по-голямата част от децата с PSC вече опитват една или и двете от тези терапии. В опит да предложим на доставчиците и пациентите рамка за стандартизиран подход към лечението, ние предлагаме следния алгоритъм за лечение, основан на доказателства, подробно описан на Фигура Фигура 1, 1, да бъде актуализиран, тъй като през следващите години ще станат достъпни повече данни.
Ендоскопски и медицински алгоритъм за управление на детски първичен склерозиращ холангит. 1 помислете за CA 19-9 и абдоминален ултразвук на всеки 6-12 месеца за всички пациенти над 15 години и наблюдение на колоноскопия на всеки 1-2 години за пациенти с първичен склерозиращ холангит-възпалително заболяване на червата.
Бележки под линия
Изявление за конфликт на интереси: Авторите съобщават за липса на конфликт на интереси.
Източник на ръкописа: Поканен ръкопис
Рецензията започва: 29 август 2018 г.
Първо решение: 8 октомври 2018 г.
Статия в пресата: 6 януари 2019 г.
Тип специалност: Гастроентерология и хепатология
Страна на произход: САЩ
Класификация на доклада за партньорска проверка
Степен А (отличен): 0
Степен B (много добър): 0
Степен C (Добър): C, C
P- Рецензент: Tenca A, Xia Q S- Редактор: Cui LJ L- Редактор: A E- Редактор: Tan WW
Информация за сътрудника
Trevor J Laborda, Катедра по педиатрия, Университет на Юта, Солт Лейк Сити, UT 84113, САЩ.
M Kyle Jensen, Катедра по педиатрия, Университет в Юта, Солт Лейк Сити, UT 84113, САЩ.
Мариан Каван, катедра по педиатрия, Университет на Юта, Солт Лейк Сити, UT 84113, САЩ.
- Лечение на щитовидната жлеза Няма бързо решение за отслабване при деца - ScienceDaily
- Лечение на запек при деца NIDDK
- Ухапвания от кърлежи при лечение на деца, симптоми и отстраняване
- Програми за лечение при деца с наднормено тегло и затлъстяване Как да постигнем промени в начина на живот ScienceDirect
- Възможности за лечение на хипопластични и хипокалцифицирани постоянни молари при деца