Сигал Мейлин
неврологична служба, MD Biosciences Ltd, Nes-Ziona, Израел
Fausto Machicao
b Молекулярна генетика и диагностика, Отделение по вътрешни болести IV, Университетска болница, Тюбинген, Германия
Мартин Елмингер
c Експериментална медицина, разработка на биомаркери, Takeda Pharmaceuticals International GmbH, Цюрих, Швейцария
Резюме
Това проучване има за цел да изследва дали Actovegin, който е депротеинизиран ултрафилтрат, получен от телешка кръв, демонстрира невропротективни ефекти при модел на плъхове с преходна глобална церебрална исхемия. Четиридесет плъхове на Sprague Dawley бяха подложени на запушване с четири съда, за да предизвикат преходна глобална церебрална исхемия, последвано от физиологичен разтвор или лечение с Actovegin. Направени са фиктивни операции на 15 плъхове. Актовегин (200 mg/kg) или физиологичен разтвор се прилага 6 часа след запушване на каротидната артерия и след това ежедневно до 40-ия ден. Обучението и паметта се оценяват с помощта на теста за воден лабиринт на Morris в продължение на два различни 5-дневни периода и също се извършва тестване на силата на сцепление за контрол на потенциални двигателни увреждания. Мозъците на плъхове бяха събрани за хистологичен анализ на ден 68. В сравнение с контролите, лекуваните с Actovegin плъхове показаха намалена латентност за достигане до скритата платформа при второто учебно изпитване за тестване на воден лабиринт (46,82 ± 6,18 срещу 27,64 ± 4,53 сек., P Ключови думи: актовегин, исхемия, учене, памет, невропротекция, инсулт
Въведение
Исхемичният инсулт е нарастваща клинична и икономическа тежест в световен мащаб [1,2]. Дългосрочните увреждания, като когнитивно увреждане след инсулт (PSCI), често се появяват след инсулт [3] и до 22% от всички пациенти с инсулт могат да останат клинично дементирани 3 месеца след първоначалната исхемична инсулт [4]. По този начин продължаването на лечението на исхемичен инсулт и неговите последствия спешно изисква допълнителни проучвания, особено защото Световната здравна организация прогнозира, че мозъчно-съдовите заболявания ще продължат да бъдат една от водещите причини за смъртност в близко бъдеще [5].
Последните разработки в нашето разбиране за патофизиологията на индуцираното от исхемия невронално увреждане стимулира интереса към нови невропротективни терапии [6], които потенциално могат да предпазят от последствията от инсулт, включително PSCI. Оценени са различни терапии [7] и въпреки че много от тези терапии са се провалили в клинични изпитвания [7,8], проучванията на тромболизата са показали съществуването на подлежаща на възстановяване полутенка след артериална оклузия [9]. Това наблюдение активизира изследванията на терапевтичната невропротекция за терапии с инсулт.
Патофизиологията на инсулта е сложна, но инхибирането на някое от множеството молекулярни събития с терапевтични средства може частично да предпази мозъчната тъкан от нараняване [10]. Например, все повече доказателства показват, че оксидативният стрес значително допринася за наблюдаваната смърт на невроналните клетки след исхемичен инсулт. Предполага се, че реперфузията на исхемична тъкан води до освобождаване на реактивни кислородни видове (ROS) и реактивни азотни видове от митохондриите [11], което води до дисфункция на кръвно-мозъчната бариера и други вредни ефекти в околните тъкани [12,13].
Actovegin, който е лекарство, базирано на депротеинизиран ултрафилтрат, получен от телешка кръв (≤5000 D) [14], е едно лечение, което понастоящем се разследва в добро, съвместимо с клиничната практика, двойно-сляпо, плацебо-контролирано проучване за лечение на PSCI (ARTEMIDA; http://clinicaltrials.gov идентификатор:> NCT01582854). Клиничните проучвания при други популации пациенти показват, че Actovegin подобрява клиничния резултат както при диабетна полиневропатия (DPN) [15], така и при пациенти със смесена деменция [16,17], въпреки че неговите ефекти върху острата церебрална исхемия не са добре проучени. Анализите in vitro и in vivo, изследващи начина на действие на Actovegin, разкриват плейотропни невропротективни и метаболитни ефекти.
Заедно с тези открития, експерименти, използващи плъхове, третирани със стрептозотоцин (STZ), показващи тежки невропатични симптоми, демонстрират, че Actovegin може да намали дегенерацията на периферните неврони и да подобри тяхната функционалност. Промени в активността на поли (ADP-рибоза) полимераза (PARP) са наблюдавани при неврони на плъхове, лекувани с Actovegin, и са замесени в неговия механизъм на действие [18]. Освен това, експериментите in vitro с използване на първични култури на хипокампален неврон показват, че Actovegin може да намали оксидативния стрес и апоптозата, като по този начин увеличава клетъчната преживяемост [19]. Предполага се, че наблюдаваното намаляване на апоптозата включва модулация на пътя на ядрения фактор каппа В (NF-кВ) [20]. Други изследвания показват, че Actovegin засилва усвояването на глюкозата, енергийния метаболизъм и усвояването и усвояването на кислорода и че ускорява зарастването на рани на молекулярно ниво [21]. Клетъчните и молекулярни ефекти на лечението с Actovegin след исхемия все още не са характеризирани, тъй като досега проучванията са фокусирани върху in vitro модели и други модели на заболявания, включително диабетна полиневропатия.
Като се има предвид това, целта на това проучване е да разгледа дали Actovegin предоставя невропротекция в утвърден модел на плъхове на глобална церебрална исхемия и ако е така, дали този ефект е свързан с подобрения в когнитивните и неврологичните показатели. За да се оценят ефектите от Actovegin след церебрална исхемия, моделът на инсулт, предизвикан от четири съда (4-VO), е избран като моделна система за това проучване, тъй като това е надежден и широко използван модел на плъхове на преходна глобална исхемия на предния мозък.
Материали и методи
Животни
В това проучване са включени петдесет и пет мъжки плъхове Sprague Dawley (които са били използвани в подобни проучвания [22,23]) с тегло ~ 250 g (± 20%). На плъховете им беше разрешено минимум 5 дни да се приспособят към заобикалящата ги среда и им беше осигурена храна (търговска, стерилна диета за гризачи) и вода ad libitum. Изследването е одобрено от Комитета за етично поведение при грижите и използването на лабораторни животни. Всички опити бяха направени за максимално благосъстояние на животните, като същевременно се запази научната валидност и цялост.
Моделът на инсулт, предизвикан от 4 VO
По време на процедурата температурата на сърцевината на всяко животно се наблюдава с помощта на ректална сонда (Модел 400; YSI Inc., Yellow Springs, OH, USA), свързана с термометър (Модел 8402-00; Cole-Parmer Instrument Co. Ltd, Лондон, Великобритания). Исхемичното оскърбление е започнато, когато се постигне ректална температура от 37–38 ° C и тази температура се поддържа през цялата процедура.
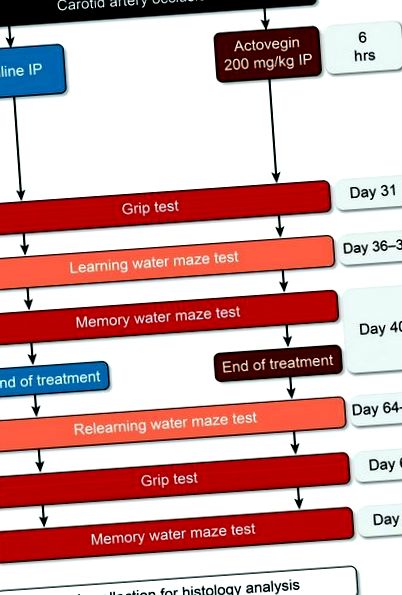
След операцията плъховете бяха разпределени на случаен принцип в една от трите експериментални групи: фалшива операция, физиологичен разтвор или лечение с Actovegin. Актовегин (200 mg/kg) и физиологичен разтвор се прилагат интраперитонеално (IP) 6 часа след запушване на каротидната артерия и веднъж дневно до Ден 40 (Фиг. (Фиг. 1). 1). По-рано тази доза Actovegin е изчислена като еквивалентна на дозата, използвана при пациенти с DPN при хора, и ежедневните инфузии на Actovegin често се предписват в клиничната практика. В допълнение, този режим на дозиране е бил използван преди това в невропатични проучвания на плъхове [18].
Проучете експериментален дизайн. Актовегин (200 mg/kg) и физиологичен разтвор се прилагат 6 часа след запушване на каротидната артерия до Ден 40. Изследването на хватката е извършено на 31 и 67 ден; опитите за учене на воден лабиринт бяха извършени на 36–39 и 64–67 дни; и опитите с воден лабиринт в паметта бяха извършени на 40 и 68 ден.
Воден лабиринт на Морис
Водният лабиринт на Морис е избран, защото това е един от най-често използваните функционални методи за оценка на нараняване на хипокампа. По време на проучването бяха завършени два периода на тестове за воден лабиринт на Морис (Фиг. (Фиг. 1; 1; Дни 36–40 и 64–68 след обща запушване на сънната артерия), за да се оценят ефектите на Actovegin върху ученето и паметта. Тези тестове са извършени в съответствие с модифициран протокол, който е описан по-рано от Raz et al. [28], а лекуваните с Actovegin плъхове са сравнени с плъхове, лекувани с физиологичен разтвор и фалшиво оперирани. Избраните времеви точки оценяват ефектите на Actovegin в стационарна фаза на невронно увреждане [29], а не по време на нива на висока възпалителна активност [30].
Плъховете бяха въведени в стандартизиран басейн с диаметър 1,2 м, пълен с вода за 120 секунди. или докато не са открили платформа, скрита на 1 см под водната повърхност. В стаята, в която беше разположен басейнът, бяха осигурени няколко визуални сигнала, за да могат плъховете да се ориентират пространствено във водния лабиринт. По-конкретно, една тръба е разположена от изток на запад на северната стена, на южната стена е отбелязано „X“, втора тръба е разположена от тавана до пода на западната стена, а входната врата е разположена на източна стена. Плъховете, които са намирали скритата платформа, са имали право да останат на нея за 10 секунди, а плъхове, които не са успели да намерят платформата в рамките на 120 секунди. бяха поставени на платформата за 10 сек. На плъховете бяха разрешени два опита да намерят скритата платформа и този тест за обучение беше извършен за период от 4 дни (Дни 36–39 и Дни 64–67; Фиг. Фиг. 1). 1). Тестовете на паметта (пробни опити) бяха извършени на петия ден (дни 40 и 68), по това време скритата платформа беше премахната и плъховете бяха поставени в басейна за една 60-секунда. пробен период. Времето, което всеки плъх прекарва в квадранта, където преди е била разположена скритата платформа, е записано от наблюдател, който е бил заслепен за експерименталните групи.
Водният лабиринт на Морис беше използван, за да се оцени колко добре плъховете запомниха местоположението на скритата платформа и дали се бяха научили да се ориентират към подходящия квадрант. Втората поредица от тестове за воден лабиринт на Morris (дни 64–68) беше проведена, за да се оцени дали ефектите на Actovegin продължават след прекратяване на лечението и следователно дали може да има свойства, модифициращи заболяването.
Тестване на сцеплението
Като контрола беше проведено тестване на сцеплението, за да се определи обективно количествената мускулна сила на плъхове. Измервател на якост на сцепление (Cat # 47200; Ugo Basile Srl, Monvalle Varese, Италия) измерва силата на сцепление на предния крайник за всеки плъх два пъти на Ден 2, за да получи изходна стойност и отново на Дни 31 и 67 (Фиг. 1) ). 1). Накратко, плъховете бяха внимателно държани за опашките си, преди да бъдат поставени над върха на решетка, така че предните им лапи да могат да хванат силомера. След това плъховете бяха изтеглени назад, докато вече не можеха да се задържат на глюкомера, като по този начин измерваха максималната си сила на сцепление.
Хистологичен анализ
Невронното увреждане, нанесено от модела 4-VO, може да бъде оценено с помощта на количествени хистологични измервания. В настоящото проучване се определя преживяемостта на пирамидалните клетки на хипокампална рога на амонис 1 (СА1). В края на проучването (ден 68), плъховете бяха умъртвени с натриев пентобарбитал (> 100 mg/kg IP) и след това бяха перфузирани с физиологичен разтвор и 4% формалдехид през лявата камера. Мозъците бяха фиксирани след това във формалдехид за поне още 72 часа. Мозъчните блокове на плъхове се приготвят, използвайки стандартни техники за вграждане на парафин. След вграждането на тъканите 5-μm хипокампални срезове бяха изрязани, оцветени с хематоксилин и еозин и изследвани чрез стандартен анализ на оцелели (т.е. жизнеспособни) клетки [31] от наблюдател, който беше заслепен за експерименталните условия. За количествени хистологични анализи на хипокампалния регион CA1 регионът е разделен на три области. Във всяка област бяха преброени CA1 неврони, които изглеждаха нормални и сумата от трите области представляваше общия брой на нормалните CA1 неврони на регион.
След този анализ всички блокове, вградени в парафин, се съхраняват до последващ анализ.
Статистически анализ
Данните бяха анализирани с помощта на t-тест на Student (Prism V 4.0; GraphPad Software Inc., La Jolla, CA, USA) и еднопосочен anova, последван от многосравнителен анализ на Tukey. P (фиг. 2) 2) показва, че лечението с Actovegin е защитено срещу CA1 клетъчна смърт. В сравнение с контролите, лечението с Actovegin значително увеличава средния брой жизнеспособни клетки (ляво полукълбо, 332 ± 27 срещу 166 ± 50 клетки при плъхове, третирани с Actovegin спрямо физиологичен разтвор, P Фиг.3). 3). Степента на невропротекция между отделните животни е различна, но остава значителна между групите.
Микрофотографии на вградени в парафин мозъчни секции, оцветени с хематоксилин и еозин. Разделите на подполета CA1 в поле са показани с по-голямо увеличение (Б., д, F и З.) и броят на жизнеспособните неврони в тези области е преброен. (A и Б.) показват почти пълна загуба на CA1 неврони при третиран с физиологичен разтвор контролен плъх. (° С и д) изобразяват почти пълното запазване на CA1 невроните в третиран с Actovegin плъх. (Е. и F) демонстрират частично запазване на CA1 невроните при третиран с Actovegin плъх. (G и З.) показват непокътнати CA1 неврони в фалшиво опериран плъх.
Хипокампална CA1 пирамидална клетъчна преживяемост. Данните са представени като средни стойности ± стандартните грешки на средната стойност (* P Фиг. 4). 4). Учебните склонове бяха изчислени на 40-ия ден и потвърдиха, че третираните с Actovegin плъхове показват значително по-висока степен на обучение в сравнение с третираните с физиологичен разтвор плъхове (P = 0,019; Фиг. Фиг. 5 5).
- Загубата на тегло подобрява паметта и променя мозъчната активност при жени с наднормено тегло - ScienceDaily
- Увеличаване на теглото след лечение на хипертиреоидизъм е често срещано нещо, което трябва да знаете
- Преходният потенциален рецепторен канал на ванилоид тип 1 регулира индуцираното затлъстяване, инсулин
- Контрол на теглото и управление и лечение на затлъстяването Клиника в Кливланд
- Наддаване на тегло след лечение на хипертиреоидизъм - PubMed