Катедра по медицински науки, Медицински факултет, Университет на Улсан, Улсан, Корея
Катедра по патология, Медицински център на университета Халим, Сеул, Корея
Департамент по биологични науки, Университет на Улсан, Улсан, Корея
Катедра по биологични науки, Университет на Улсан, Улсан, Корея
Департамент по хранителни науки и хранене, Университет на Улсан, Улсан, Корея
Катедра по вътрешни болести, Университетска болница в Улсан и Медицинско училище, Университет в Улсан, Улсан, Корея
Парк Neung ‐ Hwa, Катедра по вътрешни болести, Университетска болница Улсан и Медицинско училище, Университет Улсан, Улсан, Корея
In-Seob Han, Отделение по вътрешни болести, Университетска болница в Улсан и Медицинско училище, Университет в Улсан, Улсан, Корея; Департамент по биологични науки, Университет на Улсан, Улсан, Корея;
Катедра по биологични науки, Университет на Улсан, Улсан, Корея
Парк Neung ‐ Hwa, Катедра по вътрешни болести, Университетска болница Улсан и Медицинско училище, Университет Улсан, Улсан, Корея
In-Seob Han, Отделение по вътрешни болести, Университетска болница в Улсан и Медицинско училище, Университет в Улсан, Улсан, Корея; Департамент по биологични науки, Университет на Улсан, Улсан, Корея;
Катедра по медицински науки, Медицински факултет, Университет на Улсан, Улсан, Корея
Катедра по патология, Медицински център на университета Халим, Сеул, Корея
Катедра по биологични науки, Университет на Улсан, Улсан, Корея
Департамент по биологични науки, Университет на Улсан, Улсан, Корея
Департамент по хранителни науки и хранене, Университет на Улсан, Улсан, Корея
Катедра по вътрешни болести, Университетска болница в Улсан и Медицинско училище, Университет в Улсан, Улсан, Корея
Парк Neung ‐ Hwa, Катедра по вътрешни болести, Университетска болница Улсан и Медицинско училище, Университет Улсан, Улсан, Корея
In-Seob Han, Отделение по вътрешни болести, Университетска болница в Улсан и Медицинско училище, Университет в Улсан, Улсан, Корея; Департамент по биологични науки, Университет на Улсан, Улсан, Корея;
Катедра по биологични науки, Университет на Улсан, Улсан, Корея
Парк Neung ‐ Hwa, Катедра по вътрешни болести, Университетска болница Улсан и Медицинско училище, Университет Улсан, Улсан, Корея
In-Seob Han, Отделение по вътрешни болести, Университетска болница в Улсан и Медицинско училище, Университет в Улсан, Улсан, Корея; Департамент по биологични науки, Университет на Улсан, Улсан, Корея;
Разкриване: Авторите не декларират конфликт на интереси.
Вижте онлайн формулярите за конфликт на интереси на ICMJE за тази статия.
Резюме
Обективен:
Висцералното затлъстяване допринася за развитието на свързани със затлъстяването разстройства като диабет, хиперлипидемия и мастни чернодробни заболявания, както и сърдечно-съдови заболявания. В това проучване установихме дали локалното приложение на капсаицин може да намали натрупването на мазнини във висцералните мастни тъкани.
Методи и резултати:
Първо забелязахме, че локалното приложение на 0,075% капсаицин върху мъжки мишки, хранени с високомаслена диета, значително намалява наддаването на тегло и висцералните мазнини. Мастните клетки бяха значително по-малки в мезентериалната и епидидималната мастна тъкан на мишки, третирани с капсаицин крем. Лечението с капсаицин също понижава серумните нива на глюкоза на гладно, общ холестерол и триглицериди. Имуноблот анализ и RT-PCR разкриват повишена експресия на адипонектин и други адипокини, включително активиран от пероксизома пролифератор рецептор (PPAR) α, PPARγ, висфатин и адипсин, но намалена експресия на фактор на туморна некроза-α и IL-6.
Заключения:
Тези резултати показват, че локалното приложение на капсаицин при затлъстели мишки ограничава натрупването на мазнини в мастните тъкани и може да намали възпалението и да увеличи чувствителността към инсулин.
Въведение
Въпреки че затлъстяването е свързано с инсулинова резистентност, рисков фактор както за диабет тип 2, така и за сърдечно-съдови заболявания ((1)), степента на натрупване на мазнини в цялото тяло не определя непременно появата на тези заболявания. Всъщност висцералното затлъстяване е основният рисков фактор за неподходящо съхранение на триглицериди в адипоцитите, а натрупването на мазнини във висцералните мастни тъкани играе решаваща роля за развитието на свързани със затлъстяването разстройства като диабет тип 2, хиперлипидемия, хипертония и метаболитен синдром ( (2), (3)). Адипоцитите са високоспециализирани клетки, които влияят на енергийната хомеостаза, като секретират редица биологично активни адипокини. Изследванията на адипокините силно повлияха на нашето разбиране за връзката между повишената мастна тъкан и затлъстяването ((4)). Всъщност регулирането на адипонектина надолу е механизъм, при който затлъстяването може да причини инсулинова резистентност и диабет ((5)). Следователно насочването към адипокините, свързани с висцералното затлъстяване, може да бъде полезна стратегия за предотвратяване на метаболитни патологии, предизвикани от затлъстяването.
Адипонектинът е 30-kDa адипокин, който е силно експресиран в адипоцити и концентрацията му е обратно свързана с натрупването на висцерална мастна тъкан. Той има антидиабетни, антихипертензивни и антиатерогенни свойства, както и противовъзпалителни и антионкогенни действия ((2)). Въпреки че механизмът, чрез който плазмените нива на адипонектин се намаляват при лица с високи нива на висцерална мазнина, не е ясен, съвместното култивиране с висцералната мазнина инхибира секрецията на адипонектин от подкожните адипоцити ((6)). Това откритие предполага, че висцералната мастна тъкан освобождава някои фактори, които инхибират синтеза или секрецията на адипонектин. Адипонектинът подобрява инсулиновата чувствителност чрез увеличаване на енергийните разходи и окисляването на мастните киселини чрез активиране на аденозин монофосфат-активирана протеин киназа (AMPK) и чрез увеличаване на експресията на целеви гени на активиран от пероксизомен пролифератор рецептор α (PPARα) като трансолоказа на мастни киселини/CD36, ацил-КоА оксидаза и разединяващ протеин (UCP) 2 ((5)).
Капсаицинът, основна остра съставка на люти люти чушки и други чушки, има пряко въздействие върху изолирани адипоцити инвитро ((7), (8)) и има активност на затлъстяване при животински модел ((9), (10)). Освен това има епидемиологични доказателства за връзка между консумацията на храни, съдържащи капсаициноиди, и по-ниската честота на затлъстяване ((11), (12)). Shin и Moritani ((13)) съобщават, че консумацията на капсаицин 1 час преди упражнения с ниска интензивност подобрява липолизата и следователно може да бъде ценна добавка при лечението на лица с хиперлипидемия и/или затлъстяване. Според тези проучвания върху животни и хора, диетичният капсаицин може да се счита за функционален агент, който помага за предотвратяване на затлъстяването. Въпреки това, той не е идеален за контролиране на затлъстяването при хора, тъй като дългосрочната консумация на капсаицин може да бъде ограничена от неговата остра. Капсаицинът обикновено се прилага локално за намаляване на болките и паренето, често съобщаваните симптоми на болезнена невропатия ((14)). Понастоящем се използва в локални кремове и дермални пластири с високи дози за облекчаване на болката при периферни невропатии, като постхерпетична невралгия, причинена от херпес зостер, и може директно да се прилага върху кожата на корема, без странични ефекти при животински модели и хора ( (16)).
В това проучване използвахме in vivo модел на мишка, хранени с диета с високо съдържание на мазнини (HFD за изследване на ефекта на локално прилаган капсаицин като лечение за предотвратяване на висцерално затлъстяване.
Методи и процедури
Експерименти с животни и хора
В това проучване са използвани мъжки мишки C57BL/6. Всички експериментални процедури са одобрени от Комитета по грижа и употреба на животните в Университета на Улсан и са съобразени с насоките на Националните здравни институти. Мишките бяха хранени с 60% HFD (Research Diets, New Brunswick, NJ) и бяха разделени на две групи: контролна група (н = 7) и експериментална група (н = 7) лекувани веднъж дневно с 0,075% крем капсаицин. Кремът за капсаицин се приготвя чрез смесване на капсаицин в хидрофилна крем основа (Sigma, Сейнт Луис, Мисури), и 100 mg се прилага върху обръсната кожа на корема при всеки случай. За последващо лечение с капсаицин, затлъстелите мишки са хранени с 60% HFD в продължение на 7 седмици и след това са получавали или контролен крем (н = 8) или 0,075% крем капсаицин (н = 7) за още 7 седмици, докато все още е на HFD. След това мишките се претеглят и убиват чрез дислокация на шийката на матката. Мезентериалната мастна епидидимна мазнина на всяка мишка се обединява и претегля и кръвта се събира от сърцето.
Хистологичен анализ
Висцералната мастна тъкан се фиксира в 10% неутрален буфериран формалин за 24 часа, нарязва се на малки парченца и се вкарва в парафин за хистологичен анализ. Пробите бяха изрязани с микротом, монтирани на стъклени стъкла с D-полилизиново покритие, депарафинизирани в ксилол и оцветени с хематоксилин и еозин, за да се оцени размерът на адипоцитите. Площта, заета от адипоцити, е изчислена с помощта на морфология на поплавъка в програмата Image J (http://rsb.info.nih.gov/ij/).
Изолация и анализ на РНК
Висцералните мастни тъкани се хомогенизират с TRIzol (Invitrogen, Carlsbad, CA). RT-PCR се използва за измерване на нива на генна експресия, които са нормализирани до количеството на GAPDH иРНК. кДНК са синтезирани с Go Taq ДНК полимераза (Promega, Madison, WI) в MyCycler Thermal Cycler (Bio-Rad). Продуктите на полимеразната верижна реакция се анализират чрез електрофореза в агарозни гелове и оцветяване с етидиев бромид, за да се провери дали са получени единични ампликони с очакваните размери.
Western blot анализ
Висцералните мастни тъкани се хомогенизират в HNTG лизисен буфер (50 mmol/l 4- (2-хидроксиетил) -1-пиперазинетансулфонова киселина, 150 mmol/l NaCl, 1% тритон X-100 и 10% глицерол), допълнен с протеаза инхибиторен коктейл (Sigma). Лизатите се избистрят чрез центрофугиране при 12000ж за 20 минути при 4 ° С. Концентрациите на протеини се определят чрез анализа на Брадфорд (Pierce, Rockford, IL) и равни количества протеини се разделят чрез SDS-полиакриламиден гел електрофореза и се прехвърлят в нитроцелулозни мембрани. Мембраните бяха блокирани в буфериран с Tris физиологичен разтвор с Tween 20, съдържащ 5% обезмаслено сухо мляко за 2 h при стайна температура. Свързаните първични антитела бяха открити с пероксидазно-свързани вторични антитела и подобрена система за откриване на хемилуминесценция (Pierce). Интензитетите на лентите бяха определени чрез денситометричен анализ със системата за документиране на гел Gel Doc (Bio-Rad, Hercules, CA) и програмата Image J (NIH) и бяха нормализирани до β-актин. Всички анализи бяха проведени в два екземпляра.
Анализ на плазмата
Кръв се събира в хапаринизирани епруветки и плазмата се приготвя незабавно чрез центрофугиране (890ж, 4 ° С, 15 минути). Плазмените концентрации на глюкоза, триглицериди и общ холестерол са измерени с търговски ензимен колориметричен комплект (Asan Pharm, Сеул, Корея).
Статистически анализ
Данните са представени като средни стойности ± s.e.m. Дву опашка тТестовете бяха използвани за анализ на разликите в наддаването на телесно тегло и приема на храна, а плазмените данни бяха анализирани чрез двупосочен ANOVA. Статистическите данни са изчислени с помощта на софтуера GraphPad Prism версия 5.0 (GraphPad Software, La Jolla, CA).
Резултати
Капсаицинът намалява телесното тегло на затлъстелите мишки
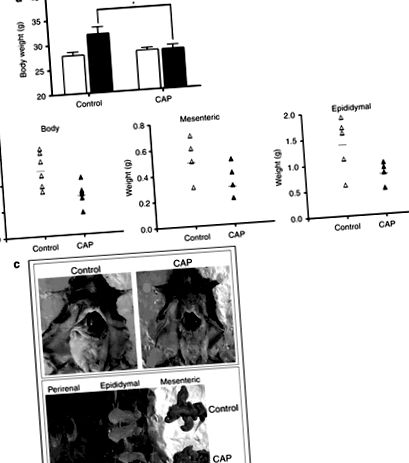
Предишно проучване показа, че диетичният капсаицин намалява индуцираната от затлъстяване инсулинова резистентност при затлъстели мишки, хранени с HFD ((17)). В това проучване капсаициновият крем се прилага локално върху кожите на мишки, хранени с HFD в продължение на 8 седмици. Увеличението на телесното тегло, наблюдавано при контролните мишки, хранени с HFD, не се наблюдава в групата, лекувана с 0,75% капсаицин (Фигура 1а). За да изследваме висцералната мазнина, измерихме теглото на черния дроб и мезентериалната и епидидималната мастна тъкан. Мезентериалната мастна тъкан на лекуваните с капсаицин мишки тежи по-малко от тази на контролните затлъстели мишки (Фигура 1b) и е много по-малко увеличена от тази на контролните затлъстели мишки (Фигура 1в).
Локалното приложение на капсаицин намалява затлъстяването. Крем за капсаицин (0,075%) се прилага върху мишки C57BL/6, хранени с високомаслена диета (HFD) в продължение на 7 седмици. (а) Общо телесно тегло (BW), (б) Тегло на BW и мастната тъкан на отделни мишки. (° С) Представителни анатомични снимки на контролни мишки и мишки, третирани с капсаицин крем. Теглото на BW и тъканите се измерва с аналитичен баланс. Данните са средни ± s.e.m. *P
За да изследваме ефекта на капсаицин върху мастните тъкани на мишки, които вече са със затлъстяване, хранехме мишки с HFD в продължение на 7 седмици и след това третирахме половината от тях с капсаицин крем за още 7 седмици, като продължихме да предоставяме HFD. Фигура 2а показва, че телесното тегло се увеличава стабилно в контролната група, докато има малко или никакво нарастване на телесното тегло в групата, лекувана с капсаицин (P
Локалното приложение на капсаицин при мишки със затлъстяване намалява по-нататъшното увеличаване на телесното тегло и мастната тъкан. Мишките бяха хранени с HFD непрекъснато в продължение на 14 седмици. След 7 седмици мишките бяха разделени на две групи, едната от които получи лечение с 0,075% крем капсаицин през останалите 7 седмици, другата контролна сметана. (а) Обща печалба от BW. (b) Тегло на BW и мастната тъкан на отделни мишки. (в) Общо тегло на мастните тъкани. (г) Общ прием на храна. (д) дневни калории в храната (kcal/ден). Данните са средни ± s.e.m. на мишки. ***P
Капсаицинът намалява липидните капчици във висцералните тъкани и инсулиновата резистентност на затлъстелите мишки
Сравнихме съдържанието на липиди във висцералните тъкани на затлъстели мишки със и без приложение на капсаицин в експеримент от вида, описан на Фигура 2. Напречните сечения на мезентериалната и епидидималната мастна тъкан и черния дроб, показаха значително намаляване или пълно отсъствие на липидни капчици при третирани с капсаицин мишки (Фигура 3а). Лечението с капсаицин също намалява честотата на големи и средни (50–100 µm 2 и 40-50 × 10 2 µm 2) адипоцити както в мезентериалната, така и в епидидималната мастна тъкан (Фигура 3b).
Ефект от локалното приложение на капсаицин върху мастната тъкан, плазмената глюкоза и липидите. (а) Представителни хистологични изображения на мезентериални и епидидимни мастни тъкани (H&E). (б) Размерът на клетките се определя чрез морфометрия. (° С) Нива на глюкоза, общ холестерол и триглицериди в плазмата на убити мишки. Данните са средни ± s.e.m. на мишки от всяка група в експеримент от типа, описан в легендата към фигура 2. **P
Плазмените нива на глюкоза, холестерол и триглицериди след лечение с капсаицин, измерени, както е описано по-горе ((17)), също са по-ниски при мишките, третирани с капсаицин, в съгласие с хистологичните данни.
За да разберем по-добре молекулярния механизъм, чрез който приложението на капсаицин намалява натрупването на липиди в мезентериалната мастна тъкан, измерихме нивата на транскрипт на няколко гена, участващи в възпалението и липидния метаболизъм. Както е показано на Фигура 4а, експресията на фактор на туморна некроза-α (TNF-α) и IL-6 е малко по-ниска при затлъстелите мишки, получаващи локално приложение на капсаицин, отколкото в контролната група със затлъстяване. Наблюдават се обаче значителни повишения в експресията на редица адипокини и гени, свързани с липидния метаболизъм, като адипонектин, адипсин, висфатин, липопротеин липаза (LPL), PPAR (α, β/δ, γ), UCP2, мастна киселина Свързващ протеин 4 (FABP4), транспортер на мастни киселини 1 и ацил-CoA синтетаза член на семейството 1 (ACSL1) (Фигура 4b) и Western blots показват, че експресията на адипонектин и лептин също се увеличава на ниво протеин (Фигура 4в ). Тези открития предполагат, че локалното приложение на капсаицин инхибира липогенезата в мезентериалните мастни тъкани чрез повишено регулиране на адипокините, особено адипонектин и лептин.
Ефекти от локалното приложение на капсаицин върху експресията на свързани със затлъстяването гени в мезентериалните мастни тъкани. (а) Експресия на TNF-α и IL-6 гени. (б) Експресия на гени адипонектин, адипсин, висфатин, LPL, ACSL1, FABP4, FATP1, UCP2 и PPAR. иРНК. ACSL1, дълговерижен член на семейството на ацил-КоА синтетаза 1; FATP1, транспортер на мастни киселини 1; LPL, липопротеин липаза; PPAR, активиран от пероксизомен пролифератор рецептор; UCP2, разединяване на протеин 2 (° С) Нивата на протеини на адипонектин и лептин бяха определени чрез Western blot анализ с адипонектин и антилептинови антитела.
Дискусия
Мастната тъкан участва в регулирането на енергийната хомеостаза като важен ендокринен орган, секретиращ редица биологично активни адипокини ((5)). По-рано сме показали, че хранителният прием или интраперитонеалната инжекция на капсаицин намалява висцералната мастна тъкан и възпалението, предизвикано от затлъстяването, като стимулира експресията на адипонектин ((7), (17)). Адипонектинът като адипокин напоследък привлича голямо внимание. В скелетните мускули той увеличава експресията на молекули, участващи в транспорта на мастни киселини, изгарянето на мастни киселини и разсейването на енергията. Тези промени намаляват съдържанието на триациглицериди в тъканите ((31)). По-горе показахме, че експресията на адипонектин е значително увеличена от локално лечение с капсаицин. Тъй като нивото на адипонектин в плазмата е намалено при затлъстяване ((5)), нашите открития показват, че намаленото натрупване на висцерална мазнина в резултат на локално приложение на капсаицин води до секреция на адипонектин от висцералната мастна тъкан. Също така остава възможно локалното приложение на капсаицин да повишава енергийния метаболизъм чрез сензорно-централната симпатикова нервна ос и да потиска натрупването на висцерална мастна тъкан, както и пероралното приложение на преходния рецепторен потенциал ванилоид I ([32], [33]).
Взети заедно, нашите данни предполагат, че локалното приложение на капсаицин променя функцията на адипоцитите по такъв начин, че да намали висцералното затлъстяване и възпаление и да увеличи чувствителността към инсулин.
- Локалното приложение на капсаицин намалява висцералната мастна мазнина, като влияе на нивата на адипокин в
- Локалното приложение на капсаицин намалява теглото, загубата на алергична неприязън и чревната лигавица
- Локален загуба на мазнини Капсаицин крем притъпява наддаване на тегло в модел на гризачи и увеличава лептина,
- Най-добрите прегледи на мазнини за жени за отслабване отзиви, характеристики и видове приложение
- Защо висцералните мазнини са лоши Механизми на метаболитния синдром - Бергман - 2006 - Затлъстяване - Уайли