Elandia A Santos 1,2, Bruna SL Coelho 2, Lilian G Teixiera 3, Ester Roff® 2, Helton C Santiago 2 и Jacqueline I Alvarez Leite * 2
- 1 Departamento de NutriГ§ЈЈo, Бразилия
- 2 Departamento de Bioqugmica e Imunologia, Бразилия
- 3 Departamento de NutriГ§ЈЈo, Бразилия
Получено: 28 октомври 2018 г .; Публикувано: 09 ноември 2018 г.
*Автора за кореспонденция: Jacqueline I Alvarez-Leite, Departamento de Bioqugmica e Imunologia, Бразилия
--> Резюме -> PDF
Резюме
Хранителната алергия се състои от заболяване, характеризиращо се с повръщане, загуба на тегло, дехидратация и активиране на възпалителни медиатори в чревната лигавица. Капсаицинът, пикантният компонент на пипера, вече е описан като аналгетично и противовъзпалително средство. Това пилотно проучване оценява ефекта от локалното използване на капсаицин върху модел на хранителна алергия. Алергиновите алергични мишки (OVA), лекувани локално със 100 mg крем от капсаицин (0,075%) или контролен крем без капсаицин, се предизвикват с разтвор на OVA (20%) в продължение на 7 дни. Ежедневно се оценяват приема на телесно тегло, храна и антиген (OVA). IgG и IgE против яйцеклетки, неутрофил, еозинофил и чревна инфилтрация на макрофаги и производство на слуз бяха измерени след двете лечения. Резултатите показват, че алергичните мишки, лекувани с локален капсаицин, показват по-висока толерантност към алергени, по-ниска загуба на тегло, намалена чревна инфилтрация на еозинофили и неутрофили и намалено производство на слуз в сравнение с нетретираните мишки. Въпреки по-високия прием на алерген от мишки, лекувани с капсаицин, концентрациите на циркулиращи IgE и IgG антитела са сходни и в двете групи. Заключихме, че локалното лечение с капсаицин отслабва интензивността на симптомите на хранителна алергия, което предполага благоприятно действие при това разстройство.
Ключови думи: Капсаицин; Хранителна алергия; Орална толерантност
Съкращения: TRPV1: преходен рецепторен потенциал ванилоид 1 OVA: овалбумин; MPO: миелопероксидаза EPO: еозинофил пероксидаза; NAG: ензими и n-ацетилглюкозаминидаза TCR: Т-клетъчен рецептор; TNF: Туморен фактор на некроза IL: Интерлевкин; IFN: Интерферон; PPARпЃ§: активиран от пероксизомен пролифератор рецептор гама LXR: Чернодробен Х рецептор
Въведение
Хранителната алергия е атопично заболяване, засягащо деца и възрастни по целия свят [1]. Той се развива, когато има неуспех в индукцията или срив в оралната поносимост. Поради нарастващата честота на хранителна алергия, в литературата нарастват проучвания за превантивни действия, включително нутрицевтици [2,3] Капсаицинът (8-метил-N-ванилил-1-6-ноненамид) е пикантно вещество, открито в люти чушки (Capsicum frutescens и Capsicum annum), с важна роля в готвенето. Капсаицинът е силно селективен агонист за преходния рецепторен потенциал ванилоид 1 (TRPV1), неселективен катионен канал, за предпочитане експресиран от първични аферентни сензорни неврони на болковия път. Тази характеристика прави капсаицин потенциално полезен при лечението на хронична болка [4-7]. Кремът за капсаицин за локално приложение е комерсиализиран за лечение на някои възпалителни разстройства. Ефикасността на такова приложение чрез е демонстрирана в проучвания за облекчаване на болката, свързани с артрит, следоперативна невралгия, диабетна невропатия и псориазис [4,8]. По този начин, ние имаме за цел да оценим ефекта от локалното използване на капсаицин в модел на хранителна алергия хронично l, характеризиращ се с чревно възпаление на лигавицата.
Материали и методи
Резултатите от концентрацията в кръвта показват, че нивата на анти OVA IgE и IgG1 антитела са съвместими с наличието на OVA алергия. Не е открита обаче разлика между ALE и ALE CAPS групите, като се имат предвид концентрациите на IgE или IgG1 (Фигура 1). Въпреки че нивата на IgE и IgG1 са сходни и в двете групи, приемът на OVA разтвор от своя страна е по-висок при животни, лекувани с локален капсаицин, показвайки по-висока толерантност към алергена (Фигура 1). Приемът на храна е намален в сравнение със здрави мишки, но подобен при алергични групи, потвърждаващ подобен прием на калории между групите ALE и ALE CAPS. Независимо от това, ALE CAPS мишките показаха по-добро развитие на телесното тегло, със загуба на тегло по-ниска, отколкото в групата ALE през експерименталните дни (Фигура 1). Когато бяха анализирани чревните възпалителни инфилтрати, беше отбелязано, че групата ALE CAPS показва по-ниска инфилтрация на неутрофили и еозинофили, както се предполага от активността на MPO и EPO, съответно (Фигура 2). Не се забелязва разлика, когато се сравнява инфилтрацията на макрофагите (p = 0,064). Групата ALE проявява хиперсекреция на слуз от бокаловите клетки. Въпреки това се наблюдава по-малко образуване на слуз при алергични животни, лекувани с капсаицин в сравнение с алергични животни (Фигура 3).
Фигура 1: Оценка на кръвните нива на IgE (A) и IgG1 (B), кумулативен прием на храна (C), прием на овалбумин (D) и развитие на теглото (E) при мишки, алергични към овалбумин, локално третирани с крем без капсаицин (ALE), 0,075% крем капсаицин (ALE CAPS) или при мишки без алергия или лечение с капсаицин (CT). Резултатите са изразени като средно и SD. SD. N = 7/група. * Статистически значимо (стр 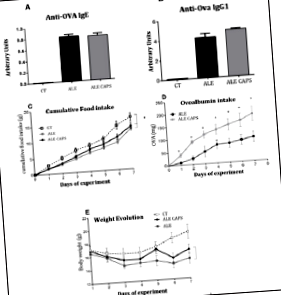
Фигура 2: Непряка оценка на инфилтрация на неутрофил (A), еозинофил (B) и макрофаги (C), оценена чрез активността на ензимите миелопероксидаза (MPO), еозинофилна пероксидаза (EPO) и n- ацетилглюкозаминидаза (NAG), съответно в тънките черва на овалбумина алергични мишки, локално третирани с крем без капсаицин (ALE), 0,075% крем с капсаицин (ALE CAPS) при мишки без алергия или лечение с капсаицин (CT). Пръчките представляват средните стойности и вертикалните линии стандартната грешка на 7 животни/група. * стр
Фигура 3: Оценка на неутралната слуз, произведена от бокаловите клетки на тънките черва. (А) Количествено определяне на слуз, представена като PAS-положителна зона на чревната лигавица (пЃm2) по поле. Лентите представляват медията и стандартната грешка от 4 животни на група. * стр
Дискусия
Тези резултати предполагат, че локалният капсаицин действа като противовъзпалително средство, създавайки по-малко възпалена чревна среда. Друга важна характеристика на хранителната алергия е увеличеното производство на слуз от бокаловите клетки [13]. Известно е, че в късната фаза на хранителната алергия еозинофилите освобождават липидни медиатори като простагландин D2, които увеличават производството на слуз от чревни чашевидни клетки [13]. Нашите данни предполагат, че по-ниското производство на слуз в групата на ALE CAPS може да бъде резултат от по-ниската инфилтрация на еозинофили в тази група и по-ниското освобождаване на липидни медиатори. Нашите данни се съгласяват с хипотезата, че локалният капсаицин ще действа главно в късната фаза на хранителна алергия, водеща до по-ниска инфилтрация на възпалителни клетки. Въпреки че противовъзпалителното действие на капсаицин е описано в няколко in vitro проучвания, механизмите не са напълно изяснени [4,19,20]. Един от възможните механизми е свързан с действието на капсаицин като TRPV1 лиганд [21].
Заключение
Нашите данни показват, че локалното приложение на капсаицин е свързано с положителни ефекти при хранителна алергия, свързани с намаляване на основните прояви, като отвращение от алергени и загуба на телесно тегло.
Признание
Това проучване беше подкрепено от Fundaço de Amparo Pes Pesquisa do Estado de Minas Gerais (FAPEMIG), Coordena® Aperfei®oamento de Pessoal de NGvel Superior (CAPES), Conselho Nacional de Desenvolvimento CientGfico e TecnolPіgico и CNC -reitoria de Pesquisa (PRPq) на Университета на Федералния Минас Жерайс. Авторите благодарят на Мария Хелена Алвес де Оливейра и за подкрепата в съоръжението за животни.
- Локалното приложение на капсаицин намалява висцералната мастна мазнина, като влияе на нивата на адипокин в
- Локален загуба на мазнини Капсаицин крем притъпява наддаване на тегло в модел на гризачи и увеличава лептина,
- Локалното приложение на капсаицин намалява висцералната мастна мазнина, като влияе на нивата на адипокин в
- Актуални хапчета за отслабване през нощта Прости идеи за отслабване The Impact Genome Project®
- Актуални предимства на дафиновите листа за отслабване Movimento Rete
