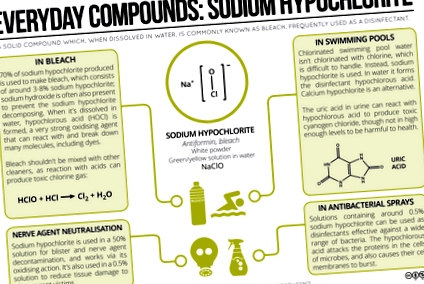
Измина известно време от последния запис в поредицата Everyday Compounds, така че днешната публикация разглежда натриевия хипохлорит. Този химикал е вероятно да се намери в няколко почистващи продукта във вашата кухня и освен това е едно от основните съединения, използвани за хлориране на водата в басейните. Ето един поглед върху химията зад тези употреби и потенциалните опасности.
Натриевият хипохлорит е твърд бял прах, но по-често се използва разтворен във вода. Разтворите на натриев хипохлорит обикновено се наричат белина, въпреки че домакинският белина съдържа и малки количества от няколко други съединения, включително натриев хидроксид и калциев хипохлорит. Натриевият хипохлорит обикновено представлява 3-8% от обема; разтворен във вода, той има силно алкално рН, което може да раздразни кожата. Идеята за силните киселини, причиняващи изгаряния, е общоизвестна, но всъщност силните алкали могат да бъдат също толкова опасни и концентрираното белина е с достатъчно високо pH, за да причини изгаряния на кожата при контакт.
Натриевият хипохлорит, разтворен във вода, също образува хипохлорна киселина, HOCl, слаба киселина, но силен окислител, който е отговорен за избелващия ефект на белина. Хипохлорната киселина може да реагира с багрила в дрехите, разкъсвайки връзките и предотвратявайки поглъщането на видимата светлина от молекулата. Той има и антимикробна активност, тъй като може да реагира с протеини и ДНК на бактериите, както и да разгражда техните клетъчни мембрани. За постигане на този ефект е необходима много ниска концентрация на хипохлорна киселина.
Вероятно сте наясно, че е често срещан съвет да не смесвате домакински почистващи продукти поради потенциално опасните реакции, които могат да се случат. Например някои почистващи препарати за тоалетни могат да съдържат солна киселина. Ако те се смесят с белина, той може да реагира с натриев хипохлорит и да образува токсичен хлорен газ. Дори смесването на малки количества от тези почистващи препарати може да доведе до производството на обем хлорен газ, дразнител на белите дробове, над безопасни нива. Почистващите продукти, съдържащи амоняк, също могат да реагират с белина, като образуват токсични хлороамини.
Като дезинфектант натриевият хипохлорит намира приложение и в басейните. Въпреки че съвсем логично бихте могли да предположите, че хлорът се използва за хлориране на басейни, това не е много практичен избор, тъй като е труден за работа и е токсичен. Следователно вместо това обикновено се използва натриев хипохлорит (или калциев хипохлорит). Образува хипохлорна киселина, която, както беше отбелязано по-рано, има антимикробни свойства. Неговото присъствие също има някои интересни химически последици в резултат на всеки плувец, който реши да облекчи пикочния си мехур в басейна, действие, което дори Майкъл Фелпс с радост призна.
Както се оказва, пикочната киселина в човешката урея може да реагира с хлорирана вода и чрез поредица от реакции може да произведе цианогенен хлорид (CNCl) и трихлороамин (NCl3). И двете химикали, особено цианоген хлоридът, са доста токсични, с ефекти на експозиция, включително кашлица, конвулсии и повръщане. Преди обаче да се заричате никога повече да не стъпвате в обществен басейн, струва си да разгледате производството и концентрацията на тези химикали малко по-подробно.
Авторът на изследването от 2014 г., в което тези констатации са публикувани свободно, признава, че нивата, които те са открили във водата на плувния басейн, не са близо до нивата, на които биха били смъртоносни, или дори на ниво, което може окончателно да се счита за вредно. За да подчертае, че има малко причини за безпокойство, Ars Technica публикува статия, в която те обмислят колко урина трябва да се добави към басейна, за да се получат смъртоносни концентрации на цианогенен хлорид. Те заявяват:
„Както се оказва, концентрацията на пикочна киселина в пее, според нашето изчисление, е около 112 пъти по-голяма от концентрацията на пикочна киселина, използвана в експеримента. Ако можехме да приемем пропорционален добив на цианогенен хлорид само от използването на повече пикочна киселина, всъщност бихме могли да постигнем токсични нива на цианогенен хлорид за олимпийски басейн от 10 mg/L хлорирана вода ... за еквивалентно количество урина. Това означава, че ако всеки човек пикае 0,8 L от силно концентрирана урина, добивът му през целия ден в този басейн, ще ви трябват около три милиона души, които пикаят в този басейн. Ако можете да стигнете до този басейн, без да умрете нито от задушаване, нито от удавяне в урината на други хора, вероятно бихте могли да издържите смъртта чрез отравяне с цианогенен хлорид или поне доста добра кома. "
Те също така заключават, че всъщност, за да се превърне цялата пикочна киселина в цялата тази урина в цианогенен хлорид, ще ви е необходимо много по-високо ниво на хлориране във водата - ефективният еквивалент на половин литър хлор на литър вода. Така че, ако планирате да плувате в басейн, толкова хлориран, че вероятно ще ви убие само от това, а има и три милиона души, които се подреждат, за да уринират, тогава да, уринирането в басейна със сигурност ще бъде вредно . Въпреки това, в местния басейн вероятно можете да бъдете спокойни.
Препратки и допълнително четене
- Летливи странични продукти за дезинфекция в резултат на хлориране - L Lian & Others
- Колко пикаене в басейн би ви убило? - Ars Technica
- Натриев хипохлорит - Молекула на месеца, Университет в Бристол
- Икони за бутилки за плуване и спрей, взети от The Noun Project (публично достояние)
- Органичен пилешки бульон от Pacific Range - с ниско съдържание на натрий 32 fl oz Pkg - Swanson Health Products
- Продукти без рецепта за бременни и кърмачки
- NOW Foods Панкреатин 200 mg 250 капсули - Swanson Health Products
- NOW Foods Energy 90 Veg Caps - Swanson Health Products
- Професионална платформа за доставка на нови хранителни продукти за масова и специална консумация, енергия