1 Departmento de Farmacologia, Centro de Ciências Biológicas, Universidade Federal de Santa Catarina (UFSC), Campus Universitário, Trindade, 88049-900 Florianópolis, SC, Бразилия
2 Centro de Inovação e Ensaios Pré-Clínicos (CIEnP), Av. Luiz Boiteux Piazza, 1302-Canasvieiras, 88056-000 Florianópolis, SC, Бразилия
Резюме
Много заболявания на централната нервна система се характеризират и понякога се влошават от интензивен възпалителен отговор в засегнатата тъкан. Понастоящем се приема, че разрешаването на възпалението е активен процес, медииран от група медиатори, които могат да действат синхронно, за да превключат фенотипа на клетките от провъзпалителна към друга, която благоприятства връщането към хомеостазата. Този нов род медиатори за разтваряне включва резолвини, протектини, марезини и липоксини, първите открити. В този кратък преглед ние предоставяме преглед на съвременните познания за клетъчните и молекулярните взаимодействия на липоксините при заболявания на централната нервна система, при които те изглежда улесняват разрешаването на възпалението, като по този начин упражняват невропротективно действие.
1. Въведение
Неврологичните заболявания, като болестта на Алцхаймер, болестта на Паркинсон, травматично мозъчно увреждане и инсулт, наред с други, както и състояния, водещи до хронична невропатична болка, обикновено представляват подчертано преходно или продължително невровъзпаление. Дали това възпалително състояние има благоприятни или вредни ефекти е все още противоречиво. Организираните действия на микроглии, макрофаги и лимфоцити водят до защитен механизъм за изолиране на увредената мозъчна тъкан и унищожаване на засегнатите клетки. По този начин възпалителните реакции обикновено водят до самоограничаващ се лечебен процес. Ако обаче този отговор не се контролира адекватно, имунната система започва да атакува невредими досега клетки, което може да причини прогресивна невронална загуба, наред с много други вредни ефекти [1].
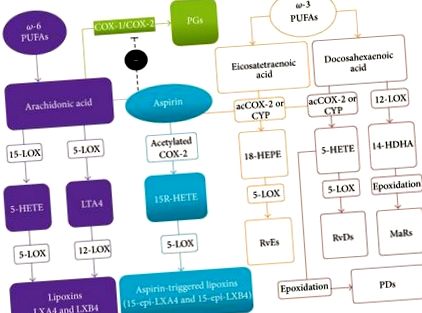
Много проучвания повдигнаха въпроса, че полезните ефекти от добавките с диета с омега-3 (ω-3) полиненаситените мастни киселини (PUFAs) могат да бъдат резултат от техния метаболизъм в потенциално противовъзпалителни вещества [2–5]. В действителност, все по-голям брой доказателства сочат, че възпалението може да се модулира от ендогенно произведени липиди, които активно участват в овладяването на отговорите на гостоприемника при нараняване, което води до активно разрешаване на възпалителния процес [6]. Тази група ендогенни прорезолиращи липидни медиатори понастоящем включва липоксини (LX), резолвини, протектини и марезини, всички от които имат потенциал за активно разрешаване на възпалението, като сигнализират за метаболитни, клетъчни и тъканни събития за връщане към хомеостаза след възпаление, в процес известен като катабаза [7].
LX (и ATL) насърчават по-голямата част от техните ефекти, въздействайки върху специфичен G протеин-свързан рецептор, обозначен като ALX/FPR2 рецептор, член на суперсемейството на формил пептидния рецептор. Този рецептор се намира в широк спектър от тъкани, включително далак и бели дробове, и клетки като макрофаги, неутрофили и микроглии и е свързан с различни специфични сигнални пътища, в зависимост от това къде се изразяват [13]. Рецепторът ALX/FPR2 също реагира на резолвини и няколко пептиди, някои от които, подобно на анексин-1, са разтворими, докато други, като амилоидогенни пептиди, са противовъзпалителни [14]. Важно е, че LXA4 може да се свърже и с допълнителни рецептори, включително арил въглеводородния рецептор AhR [15], цистеинил левкотриеновия рецептор (CysLT) [16, 17], GPR32 рецептора [18] и CB1 канабиноидния рецептор [19]. LXA4 обаче не винаги действа като агонист, когато е свързан с тези рецептори, тъй като е частичен антагонист на CysLT рецептора [14] и алостеричен усилвател на сигнала при CB1 канабиноидните рецептори [19].
Въпреки че LX са получени от АА ейкозаноиди, те могат да бъдат ясно разграничени от класическите проинфламаторни простагландини, тромбоксан и левкотриени въз основа на способността им да предизвикат самоограничаващ се отговор на възпалението, когато се генерират от левкоцити. Всъщност тяхното образуване и функции са пряко свързани с промяна във фенотипа на неутрофилите, присъстващи на мястото на възпалението [20]. Веднъж образувани на мястото на нараняване, LXs потискат набирането на неутрофили, усилват фагоцитозата на апоптотичните неутрофили от макрофаги и стимулират натрупването на нефлогистичен тип моноцити/макрофаги, които не произвеждат провоспалителни медиатори [21].
Все по-голям брой проучвания демонстрират ролята на LX като противовъзпалителни и разтварящи агенти в различни животински модели на периферни и централни разстройства, включително сърдечно-съдови заболявания, както са прегледани от други [6, 10, 22, 23]. Тук ще предоставим конкретно преглед на профила на биологичните действия на LX, които биха могли да имат значение за потенциалното им използване като терапевтични средства за възпалителни разстройства в централната нервна система.
2. Болест на Алцхаймер
Болестта на Алцхаймер (AD) е опустошителен невродегенеративен синдром, характеризиращ се с драстична и прогресираща деменция и промени в поведението, свързани с натрупването в мозъка на извънклетъчни сенилни плаки, съставени главно от амилоид β протеин (Aβ), интраневронални неврофибриларни заплитания, съдържащи хиперфосфорилиран тау протеин, и хронично невровъзпаление. Това заболяване засяга милиони хора по целия свят, особено в края на живота и причините за него са напълно разбрани [24]. Въпреки усилените усилия, понастоящем AD няма лечение и наличното поддържащо лечение далеч не е ефективно. Това, заедно с подчертаното увеличаване на продължителността на живота на световното население, прави търсенето на по-ефективно лечение на АД едно от най-големите предизвикателства в съвременната медицина.
Ролята на липидите в патогенезата на AD е анализирана от няколко групи и някои проучвания показват, че мозъците на пациенти с AD имат възможен аномален липиден метаболизъм [25–27]. Невродегенеративният процес при АД е тясно свързан с възпалителен отговор в мозъка, който включва няколко липидни възпалителни медиатори, получени от АА [28]. В действителност, съвсем скорошно проучване разкри, че разрешаването на възпалението е нарушено в мозъка на пациенти с AD [29]. Проучването установи, че нивата на LXA4 в пробите от гръбначномозъчна течност и хипокампус на пациенти с AD са по-ниски от тези на контролните субекти и че това намаление е корелирано със степента на когнитивния дефицит и натрупването на тъкан в протеина тау. Обратно, експресията на ALX/FPR2 рецептори е очевидно по-голяма в пробите на AD хипокампа.
Интригуващо, амилоиден β протеин (Aβ), един от основните фактори, допринасящи за патогенезата на AD, се свързва и активира ALX/FPR2 рецепторите, но с антагонистични ефекти [30]. Le и колеги [30] показаха, че Aβ1-42 упражнява хемотаксична активност в човешки левкоцити чрез активиране на рецептор ALX/FPR2. Съответно, друго проучване показа, че Aβ, действайки чрез ALX/FPR2 рецептори, индуцира хемотаксис и производство на супероксид в миши неутрофили и стимулира култивирани миши микроглиални клетки, което категорично предполага неговата ключова роля при набирането на микроглиални клетки до сенилни плаки, индукция на оксидативен стрес и последващо невро възпаление при AD [31] . Тези и други експериментални наблюдения ясно установяват ALX/FPR2 рецепторите като патофизиологично значими в Аβ-медиирани проинфламаторни отговори при AD [32].
От друга страна, скорошно проучване установи, че продължителното лечение два пъти дневно с ATL 15-епи-липоксин A4 (ATLA4) насърчава впечатляващи ефекти в генетично базиран миши модел на AD [33]. Сред най-забележителните открития на проучването, ATLA4 понижи производството на мозъка на провоспалителните медиатори TNF-α, интерлевкин-1β (IL-1β), интерферон-γ, IL-6, GM-CSF и RANTES и на MMP-9, всички те са силно свързани с прогресията на AD. Обратно, ATLA4 повишава мозъчните нива на противовъзпалителните цитокини IL-10 и TGF-β, стимулира натрупването на алтернативни микроглиални клетки, които за разлика от класическите, показват нефлогистичен фенотип и подобряват клирънса на Aβ в ЦНС. Трябва да се отбележи и в съответствие с по-ранни наблюдения, че Aβ активира NFκB сигнален път в мозъка на мишката [34], лечението с ATLA4 също намалява NFκАктивиране на B в мозъчните астроцити (но не и в невроните или микроглиалните клетки) [34].
В обобщение, LXA4 и Aβ упражняват противоположни ефекти върху рецептора ALX/FPR2 и докато производството на LXA4 в мозъка е намалено при AD, рецепторите ALX/FPR2 са свръхекспресирани [29]. На пръв поглед този сценарий би силно подкрепил укрепващото действие на Aβ върху патогенезата на AD. Парадоксално е обаче, че повишената експресия на ALX/FPR2 рецептори в глиални клетки по време на AD също трябва да направи болния мозък по-реагиращ на LXA4, което прави лечението с LX много интересна възможност за терапията на AD. Въпреки това, тъй като LXA4 може да взаимодейства и с допълнителни рецептори, различни от рецепторите ALX/FPR2, въздействието на действието на LXA4 върху такива молекулярни цели върху неговите невропротективни ефекти при AD остава да бъде по-добре характеризирано. Например, като се има предвид, че CB1 канабиноидите оказват благоприятни ефекти при животински модели на AD [35], фактът, че LXA4 е алостеричен усилвател на сигнала при CB1 канабиноидните рецептори [19], може да бъде от значение за неговия потенциал при лечение на AD.
3. Инсулт
Исхемичният инсулт е основна причина за заболеваемост и смъртност в целия свят и резултатът му зависи от степента на вторично мозъчно увреждане на полусянката, причинено от разпространение на възпаление [36]. След като настъпи инсулт, пропускливостта на кръвно-мозъчната бариера (BBB) незабавно се увеличава и активира каскада от възпалителни реакции, която включва глиална активация, неутрофилна инфилтрация, повишена експресия на селектини и други молекули на междуклетъчна адхезия върху ендотелните клетки на BBB, както и инфилтрация на имунни клетки, водеща до исхемична мозъчна травма [37–39]. След инсулт има прекомерно генериране на реактивни кислородни видове (ROS), които влошават невроналната смърт [40, 41]. Промените в пропускливостта на BBB, наблюдавани малко след появата на преходна или постоянна фокална исхемия при пациенти с хора и при модели на инсулт при животни, са до голяма степен следствие от увеличеното производство на металопротеинази (MMP), главно на MMP-9 и MMP-2, от ендотелни клетки, микроглии и астроцити [42-51]
Както беше обсъдено по-рано, ALX/FPR2 рецепторите за LXA4 присъстват в неутрофилите, моноцитите, макрофагите, невронните стволови клетки и резидентните клетки в ЦНС, което ги прави потенциални мишени за LXA4 в мозъка [52-55]. Първоначалното възпаление, наблюдавано малко след нараняване, постепенно се разширява, за да засегне много по-голяма площ в продължение на няколко часа до дни след инсулт [56, 57]. Мозъчната исхемия бързо предизвиква активиране на резидентна глия заедно с набирането на кръвни клетки [58] и след като неутрофилите инфилтрират засегнатата област, те освобождават фосфолипази, протеази и кислородни свободни радикали [56]. Мозъчните ненаситени мастни киселини са особено уязвими към индуцирано от свободните радикали пероксидация. Не е изненадващо, следователно, при животински модели на инсулт нараняването може да бъде подобрено чрез блокиране на части от възпалителната каскада [59, 60] или ограничаване на инфилтрацията на неутрофили в ранните етапи [56, 58, 61].
MMPs представляват друга важна цел за полезните действия на LXA4 при инсулт. В тази връзка, при плъхове, подложени на преходна оклузия на средната церебрална артерия, ранното лечение след нараняване с аналог LXA4 BML-111 насърчава значително намаляване на експресията и активността на MMP-9 и MMP-3, както и увеличаване на експресията на ендогенен MMP инхибитор TIMP-1 в кората [64]. Това лечение също така намалява мозъчния оток, нарушението на BBB и размера на инфаркта в кората, но не и в стриатума, което предполага, че то селективно отслабва разпространението на възпалението в кората [64]. Нещо повече, лечението с BML-111 драстично намалява инфилтрацията на неутрофили в мозъка и активирането на микроглиалните клетки [64]. Инхибирането на активността на глиалните клетки може да бъде особено важно за противовъзпалителната активност на LX, тъй като ATLA4 значително намалява LPS-индуцираното производство на реактивни кислородни видове в култивирани микроглиални клетки [75] и производството на азотен оксид и PGE2 чрез експресия на iNOS и COX-2 в култивирани астроцити [76].
Към днешна дата само едно проучване се опитва да използва антагонисти, за да характеризира рецепторите, медииращи невропротективните ефекти на LXA4 при инсулт [74]. Интерес представлява това проучване, което показва, че комбинираното лечение на плъхове, подложени на запушване на средната церебрална артерия, с антагонист на рецептора ALX/FPR2 Boc-2 (бутоксикарбонил-Phe-Leu-Phe-Leu-Phe), само насърчава частична блокада на LXA4-индуцирано намаляване на размер на мозъчния инфаркт и подобряване на неврологичните резултати. Освен това, Boc-2 също не успя да блокира индуцираната от LXA4 експресия на ядрен фактор, свързан с еритроид 2 фактор 2 (Nrf2) и неговата транслокация в ядрото, както и тази на HO-1 и синтеза на GSH. Всъщност по-ранно проучване показа, че ALX4 активира Nrf2 сигналния път в мишки и човешки макрофаги [77]. Тъй като този транскрипционен фактор координира експресията на гени, регулирани от антиоксидантни елементи на отговор, Boc-2-резистентните Nrf2-зависими ефекти на LXA4, описани от Wu и сътрудници [74], т.е. повишена експресия на HO-1 (редокс-чувствителен индуцируем ензим) и синтез на GSH (антиоксидантен протеин), представляват важен механизъм, независим от рецепторите ALX/FPR2 за защита на клетките от окислително увреждане след инсулт.
Взети заедно, изследванията, разгледани в този раздел, показват, че LXA4, ATLA4 и BML-111 оказват ясни невропротективни ефекти при модели на инсулт. По този начин LX могат да имат терапевтична стойност за лечение на исхемичен инсулт. Изглежда, че поне част от невропротективните ефекти на LXA4 произтичат от активиране на Nrf2-GSH/OH-1 сигнален път.
4. Травматично нараняване на мозъка
Травматичното увреждане на мозъка (TBI) се дефинира като промяна в мозъчната функция или доказателство за мозъчна патология, причинена от външна сила и е свързана с увреждане на мозъка [78]. Приблизително 235 000 американци са хоспитализирани годишно за нефатален TBI, а 1,1 милиона се лекуват в спешни отделения, но с 50 000 фатални случая всяка година TBI е една от водещите причини за смъртност сред младите хора [79, 80]. Основните причини за TBI включват падания, катастрофи с превозни средства, нападения и спорт [81].
Ясно е, че това пионерско проучване на Luo et al. [82] вече разкри много окуражаващи действия на LX в TBI и би трябвало да стимулира много допълнителни изследвания по тази конкретна тема.
5. Невропатична болка
Разпространението на хроничната болка сред американското и европейското население се оценява на около 30% и се смята, че около една пета от хората, които съобщават за хронична болка, страдат предимно от невропатична болка (т.е. около 6% от общото население) [83]. Невропатичната болка се определя като болка в резултат на нараняване или дисфункция на соматосензорната система [84], но тази терминология всъщност обхваща няколко вида невропатична болка, повечето от които се повлияват слабо от наличните в момента лечения [83].
Нараняването или възпалението на периферната тъкан често предизвиква обратими промени в сензорната нервна система, които повишават чувствителността към ноцицептивна болка, механизъм, който предпазва и осигурява правилното зарастване на увредената тъкан. За разлика от това, невропатичната болка е често неадаптивно състояние в резултат на пряко увреждане на самата нервна система. Той е свързан с постоянни промени в чувствителността на болковите пътища към възприемане на вредни стимули, така че обикновено безвредните стимули предизвикват болка (алодиния) и отговорите на вредните стимули са преувеличени по амплитуда (хипералгезия) и/или продължителност (хиперпатия), заедно с епизодите на спонтанна болка [85].
Важно е, че възпалителните цитокини, включително IL-1β, IL-6 и TNF-α се произвеждат периферно и централно в отговор на увреждане на нервите [86]. Следователно, периферното и централното невровъзпаление не само е замесено в генерирането и поддържането на хронична възпалителна болка [79, 80], но също така е вероятно да допринесе за невропатичната болка [79, 80]. Всъщност, дори ако невропатичните и невропатичните болки обикновено се признават за отделни образувания, много от невротрансмитерите, невропептидите, цитокините и ензимите, замесени в двата вида болка, са еднакви [83]. В тази връзка досега само няколко проучвания са се опитали да характеризират ефектите на LX и ATL в модели на възпалителна и невропатична болка.
Първото проучване за оценка на ефектите на LXA4 върху болката установи, че интравенозните или интратекални инжекции на LXA4, LXB4 или аналог на ATL намаляват термичната хипералгезия на възпалителната задна лапа, предизвикана от карагенан при плъхове [54]. Изследването също така съобщава, че гръбначните астроцити експресират ALX/FPR2 рецептори и реагират на LXA4 с намалено активиране на екстрацелуларна сигнално-регулирана киназа и c-Jun N-терминална киназа. В потвърждение на виждането за регулаторна роля на LX при спинална възпалителна ноцицептивна обработка, друго проучване показва, че интратекалното приложение на LXA4 също инхибира механичната алодиния и увеличаването на нивата на TNF-α в гръбначния стълб, индуцирани от карагенан в задната лапа на плъхове [87].
Директните лезии на централната нервна система, като тези, причинени от инсулт или травматично увреждане на мозъка или гръбначния мозък, също могат да провокират състояние на невропатична болка, известно като „централна болка“ при значителна част от пациентите [88]. Възможните ефекти на LX при контролиране на ноцицептивните промени и спонтанната болка, свързани с тези видове наранявания, остават да бъдат оценени, но от проучванията, докладвани в този раздел, LX могат да представляват ново средство за ефективно насочване на болката както на възпалителни, така и на невропатични болка.
6. Заключения
Конфликт на интереси
Авторите декларират, че няма конфликт на интереси по отношение на публикуването на тази статия.
Принос на авторите
Алесандра Кадет Мартини и Стефания Форнер допринесоха еднакво за тази работа.
Признание
Авторите са подкрепени в Бразилия от Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq).
Препратки
- Активността на нервната система може да предскаже успешна загуба на тегло
- Устойчиво натрупване на свързващи микротубули лекарства за химиотерапия в периферната нервна система
- „Истинската“ причина, поради която не отслабвате Силата на автономната нервна система -
- Нервната система може да държи ключ към загубата на тегло - Consumer Health News HealthDay
- Странични ефекти на Mirena (вътрематочна система, освобождаваща левоноргестрел), предупреждения, употреба