Кристина М. Возняк
1 Откриване на наркотици на Джон Хопкинс
Джеймс Дж. Ворнов
4 Medpace, Синсинати, Охайо
Ин Ву
1 Откриване на наркотици на Джон Хопкинс
Кеничи Номото
3 Eisai Inc., Andover, MA
Брус А. Литълфийлд
3 Eisai Inc., Andover, MA
Кристофър ДесЖардинс
3 Eisai Inc., Andover, MA
Янке Ю
3 Eisai Inc., Andover, MA
Джордж Лай
3 Eisai Inc., Andover, MA
Лариса Рейдерман
3 Eisai Inc., Andover, MA
Нанси Уонг
3 Eisai Inc., Andover, MA
Барбара С. Слъшър
2 Катедра по неврология, медицинска психиатрия и неврология, Балтимор, д-р
Резюме
ВЪВЕДЕНИЕ
Отдавна е признато, че кумулативната доза химиотерапия с течение на времето е най-важният клиничен предиктор за невропатия. Тази зависимост от дозата може да се дължи или на натрупване на нараняване, причинено от токсичността на всяко приложение, или на натрупване на лекарство в периферните нервни тъкани, които достигат токсични нива само след многократни дози. Излагането на периферна нервна тъкан е трудно да се изчисли клинично и вероятно е слабо прогнозирано от плазмената концентрация поради променливо разпределение, често силно повлияно от фактори като формулировка или начин на приложение (9–12). В допълнение, механизмите за изчистване от тъканите също варират, определя се както от свързването на химиотерапевтични агенти в тъканите, така и от изтичането, медиирано от транспортни механизми като Р-гликопротеини.
За да се изследва допълнително потенциалната връзка между натрупването на периферна нервна тъкан и невропатията, би било полезно да се сравнят химиотерапевтичните средства със сходни механизми, но различен невротоксичен потенциал. В описаните тук експерименти ние определихме връзката между фармакокинетиката на плазмата, концентрацията на тъканите в периферната нервна система и развитието на невропатия, използвайки еднократно приложение и двуседмичен модел на MTD за три микротубули, насочени към химиотерапии. За първи път докладваме, че и трите лекарства показват драматично и трайно натрупване в DRG и SN, като измеримите нива се поддържат седмици след последната доза. Въпреки това, поне в случая на паклитаксел и ерибулин, степента на проникване и натрупване на тъкани не корелира с развитието на невропатия.
МЕТОДИ
Животни
Женски мишки BALB/c (на възраст приблизително 7–8 седмици в началото на дозирането) са получени от лабораториите Harlan (Indianapolis, IN) и са поддържани със свободен достъп до вода и стандартизирана синтетична диета (Harlan Teklab). Температурата и влажността в помещенията за животните и процедурата се поддържат съответно на 20 ± 2 ° C и 55 ± 10%. Изкуственото осветление осигуряваше цикъл от 12 часа светлина/12 часа тъмнина (светлина от 7 до 19 часа) Всички експериментални протоколи бяха одобрени от Институционалния комитет по грижа и употреба на животните на Sobran Inc и се придържаха към всички приложими институционални и правителствени насоки за хуманно отношение към лабораторните животни.
Мишките бяха лекувани с еднократни и многократни дози от предварително определен 6-дозов MTD режим, прилаган интравенозно по график Q2Dx3 × 2 седмици (за метода вж. (3)). MTD се определя като максимална доза ерибулин мезилат, иксабепилон или паклитаксел, приложена, при която не повече от едно животно от лекуваната група, умират спонтанно. В допълнение, това беше максималната тествана доза, при която нито една мишка от дозовата група не изисква евтаназия поради> 20% индивидуална загуба на тегло, показваща явни клинични признаци на дистрес или невъзможност за ядене и/или пиене. Установено е, че дозата на MTD, когато се прилага интравенозно 6 пъти по схема Q2Dx3 × 2 седмици, е 1,125 mg/kg за ерибулин, 2 mg/kg за иксабепилон и 30 mg/kg за паклитаксел.
Лекарства и формулировки
Ерибулин мезилатът (синтезиран в Изследователския институт Eisai и съхраняван при -80 градуса на тъмно) се разтваря в 100% безводен DMSO (Sigma-Aldrich, Сейнт Луис, Мисури), за да се получи 10 mg/ml основен разтвор, който се отделя в аликвотни части и се съхраняват при -80 ° C до деня на приложение. Всеки ден на приложение основният разтвор се размразява и разрежда с физиологичен разтвор до крайна концентрация от 0,112 mg/ml в 2,5% DMSO/97,5% и се прилага в обем от 10 ml/kg.
Паклитаксел (закупен от LC Laboratories, Woburn, MA и съхраняван при -20 градуса С, на тъмно) се разтваря в етанол (100%) при 10% от крайния обем. След това се добавя еднакъв обем кремофор (10% от крайния обем) и сместа се завихря за около 10 минути. Непосредствено преди инжектирането се прибавя ледено физиологичен разтвор до крайния обем (като 80% от крайния) и разтворът се поддържа на лед по време на дозиране. Дозиращите разтвори от 3 mg/ml се приготвят пресни ежедневно и се прилагат в обем от 10 ml/kg.
Иксабепилон (Ixempra, Bristol-Myers Squibb, NJ) е приготвен съгласно вложката на опаковката. Формулираният основен разтвор на иксабепилон (2 mg/ml) незабавно се разпределя в аликвотни части и се съхранява при 80 градуса С до употреба. На всеки експериментален ден основният разтвор се разрежда чрез добавяне на 50% етанол/50% кремофор с последващо завихряне, за да се получи разтвор, който е 5 пъти необходимата концентрация на дозиране. Накрая бяха добавени 4 обема PBS, докато се завихряше, за да се постигне крайна концентрация на дозиране от 10 ml/kg.
Фармакокинетични проучвания
Електрофизиология
РЕЗУЛТАТИ
Фармакокинетични проучвания
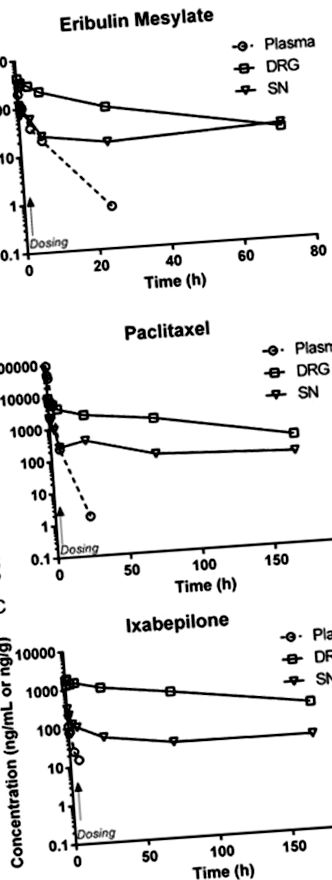
След интравенозно приложение плазмените концентрации на ерибулин, паклитаксел и иксабепилон бързо намаляват, вероятно поради бързото разпределение в периферните отделения (19–21). Ограниченията на чувствителността на анализа предотвратиха характеризирането на крайната елиминация. След еднократна инфузия и трите лекарства бързо се разпределят в DRG и SN, оставайки над границата на откриване за над 72 часа. Анализите на времето на концентрация на ерибулин, паклитаксел и иксабепилон в съответните им матрици след единична доза са показани на фигура 1А-С .
Фармакокинетичен профил на паклитаксел, ерибулин мезилат и иксабепилон в плазма, DRG и SN от мишки, получаващи еднократна интравенозна доза (отбелязана със стрелка), съответно от 30, 1.125 и 2.0 mg/kg. Във всички случаи плазмените проби, събрани след 24 часа след дозата, са под по-ниските нива на количествено определяне, въпреки че нивата на DRG и SN остават количествено измерими до 72 часа след дозата. (Символи: плазма ⦵, DRG, SN).
Както се вижда от фармакокинетичните параметри (Таблица 1), трите лекарства варират значително при относително проникване в тъканите след интравенозно приложение. Натрупването по време на ранното разпределение в тъканите, отразено като максимална експозиция (Cmax), достигнато в тъканите в сравнение с плазмата, е най-голямо за иксабепилон, последван от ерибулин. Пиковата концентрация на паклитаксел в тъканите е по-ниска от пиковата плазмена концентрация, докато ерибулин и иксабепилон показват по-голяма Cmax в тъканите, отколкото в плазмата. Пиковата експозиция е по-голяма при DRG, отколкото седалищния нерв и за трите съединения. Цялостната експозиция на DRG и SN по отношение на плазмата се характеризира чрез изчисляване на индекса на проникване в тъканите (TPI) както за Cmax, така и за AUC. Както е показано в таблица 1, относителната експозиция по която и да е от мерките е по-голяма при DRG, отколкото при седалищния нерв и за трите лекарства с иксабепилон с най-висока експозиция, ерибулин е междинен и паклитаксел относително по-нисък.
маса 1
Фармакокинетични параметри на единична интравенозна доза ерибулин мезилат, паклитаксел и иксабепилон при мишки.
- Нервната система може да държи ключ към загубата на тегло - Consumer Health News HealthDay
- Невропротективни ефекти на липоксин А4 при патологии на централната нервна система
- „Истинската“ причина, поради която не отслабвате Силата на автономната нервна система -
- Активността на нервната система може да предскаже успешна загуба на тегло
- Следвоенна превенция Възникващи рамки за предотвратяване на употребата на наркотици след войната срещу наркотиците