Резюме
Заден план
Невроналните цероидни липофусцинози (NCL) са най-често срещаните автозомно-рецесивни невродегенеративни нарушения при деца. Клиничните прояви включват прогресивен когнитивен спад, двигателно увреждане, атаксия, зрителна загуба, гърчове и ранна смърт. Към днешна дата са известни повече от 440 мутации, причиняващи NCL в 13 гена.
Представяне на дело
Ние докладваме клинични и генетични характеристики на 5-годишно момиче, засегнато от цероидна липофусциноза тип 7 (NCL7). Тя е имала прогресивно двигателно и психическо влошаване от 2,5-годишна възраст. По-късно тя развива прогресивна загуба на зрение, стереотипи, действие миоклонус и епилепсия. На 5-годишна възраст тя спря да ходи. Въз основа на симптомите беше предложена диагноза на синдрома на Rett, но не бяха открити аномалии в MeCP2. Идентифицирахме нова хомозиготна мутация в MFSD8 ген (c.525 T> A, p.Cys175Ter). Доколкото ни е известно, това е първият доклад на MFSD8 генна мутация при руски пациент с вариант късно-инфантилен NCL.
Заключения
Нашите резултати увеличават мутационния спектър на цероидна липофусциноза тип 7 и демонстрират огромна диагностична стойност на секвенирането на екзома за педиатрични NCL. Също така потвърдихме, че NCL трябва да се подозира при пациенти с Rett-подобен фенотип в началото и отрицателен MECP2 мутация.
Заден план
Невроналните цероидни липофусцинози (NCL), известни също като болест на Batten, са група от автозомно-рецесивни лизозомни заболявания за съхранение. Съобщава се за автозомно доминантно наследяване в една форма, възникнала при възрастни [1]. NCL е най-често срещаното невродегенеративно разстройство в детска възраст с разпространение до 1: 14 000 в световен мащаб [2]. НКЛ са свързани с прогресивна загуба на когнитивни и двигателни умения, гърчове, миоклонус, загуба на зрение и обикновено намалена продължителност на живота. Възрастта на настъпване може да бъде променлива. Почти всички пациенти с NCL са имали натрупване на автофлуоресцентен липопигмент в лизозоми на неврони и други клетъчни типове. Този процес на съхранение е свързан със селективно унищожаване и загуба на неврони в мозъка и ретината. Ултраструктурата на складовите депозити варира между различните форми на NCL [3].
Преди това NCL класификацията се основаваше на възрастта на поява заедно с клиничното представяне. Пациентите са групирани в един от четирите основни типа НКЛ: инфантилен, късно инфантилен, непълнолетен и възрастен [4].
Към днешна дата са известни повече от 440 мутации, причиняващи NCL в 13 гена [5]. Новата класификация, структурирана в 7 диагностични оси: отговорен ген, точен генетичен дефект, клинични характеристики (възраст в началото, представяне на симптоми, прогресия на заболяването), биохимичен фенотип, ултраструктурни характеристики, функционалност и други забележки [6]. Но не винаги съществува пряка корелация между гена, който е мутирал, и фенотипа [7].
В рамките на късно инфантилни НКЛ са описани няколко типа с дискретни различни клинични характеристики и са разделени на вариант късно инфантилен НКЛ (vLINCL). vLINCL са генетично хетерогенни форми с четири основни гена, причиняващи заболявания: CLN5, CLN6, CLN7 (MFSD8), CLN8. Хомозиготни или съставни хетерозиготни мутации в MFSD8 по-рано се съобщава, че причиняват vLINCL, наречена болест NCL7 (OMIM 610951). MFSD8 ген (OMIM 611124) кодира CLN7, предполагаем лизозомен транспортен протеин [8].
Формата NCL7 е описана за първи път при деца от Турция: Topcu с колеги оценява клинични и хистопатологични характеристики на 36 турски пациенти с късно инфантилна NCL [9]. Тази форма се счита за отделен клиничен и генетичен вариант на NCL, но по-късни проучвания показват, че болестта NCL7 не се ограничава само до турското население [8, 10, 11]. Сега е очевидно, че турският vLINCL е генетично много хетерогенен с мутация в три гена: CLN6 [12], CLN8 [13] и MFSD8 [14]. Клиничният фенотип на пациенти с различни варианти на инфантилни и късни инфантилни НКЛ е доста еднороден. Обаче, подобно на Rett начало е описано за болестта NCL7, произведено от MFSD8 генни мутации и детска болест NCL1 [9, 15, 16]. Подобни аутистични характеристики и стереотипни движения се наблюдават при няколко форми на NCL [17, 18].
В това проучване анализирахме клинични и генетични характеристики на 5-годишно момиче с когнитивно и двигателно влошаване, загуба на зрение, стереотипи, миоклонус и епилепсия.
Представяне на дело
Пациентът беше 5-годишно момиче от Русия. Тя е имала незабележима перинатална, неонатална и фамилна анамнеза (родителите и брат са клинично здрави).
Тя е родена от петата бременност, второто раждане и е родена чрез цезарово сечение. Теглото й при раждане е 3800 g и височина 53 cm. Резултатите на Апгар са съответно 8 и 8 на 1 и 5 минути. Не са наблюдавани аномалии през неонаталния период. До 2,5 години момичето се развива според възрастта си без забавяне на говора и двигателното развитие. На възраст от 2,5 години на фона на травма на малкия пръст момиче спря да говори. Постепенно речта беше възстановена, но речникът намаля. На 3 години настъпва първият фебрилен пристъп. По-късно родителите забелязват значително влошаване на нейната реч и комуникация. Тя стана социално оттеглена. Мозъчният магнитен резонанс разкрива дифузни лезии в бялото вещество и хипоплазия на долната церебеларна вермиса. На възраст от 3, 5 години се появиха стереотипни движения. От 3, 5 години пациентът започва лечение с валпроева киселина (антиепилептично лекарство). Но двигателното влошаване напредва: на 5-годишна възраст тя спира да ходи.
Въз основа на наблюдаваните симптоми е предложена диагноза на синдрома на Rett. Преди клиничното секвениране на екзома бяха проведени следните изследвания: измерване на нивото на палмитоил протеин тиоестераза (PPT) в левкоцитите, тандемна мас спектроскопия, секвениране на MeCP2 и ТЕЦ1, анализ на често срещани мутации на митохондриална ДНК. Всички проучвания не показват аномалии.
На възраст от 5 години 8 месеца е приета в Научно-практически център по детска психоневрология с двигателно и психическо влошаване, зрително увреждане и стереотипи.
Тя имаше нормално физическо развитие: беше 20, 5 кг тегло и 111 см височина. Главата беше с нормална форма, обиколката на главата беше 50, 5 cm (норма). Кожата беше нормална и чиста. Коремът беше мек, безболезнен. Изпражненията и микцията бяха нормални. Основните изследвания на кръвта и урината бяха нормални.
Нямаше интерес към околната среда, нямаше игрална дейност. Ориентацията в пространството и времето липсваше. Речта и разбирането на речта са нарушени: тя използва само речеви звуци и срички. Тя имаше стереотипни движения на ръцете и лицето. Момичето има миоклонус в ръцете, краката и мускулите на лицето. Тактилната стимулация засилва миоклонуса. Тя не ходи, не стои, не пълзи. Едно момиче може само да държи главата си, да се преобръща, да седи с периодични падания.
Офталмологичната оценка разкрива частична атрофия на зрителните нерви, нистагъм, пигментозен ретинит и смесен астигматизъм.
ЕЕГ (електроенцефалография) разкрива значително забавяне на образуването на кортикална електрогенеза и лошо структурирана епилептиформна активност в тилно-париетално-задните темпорални области.
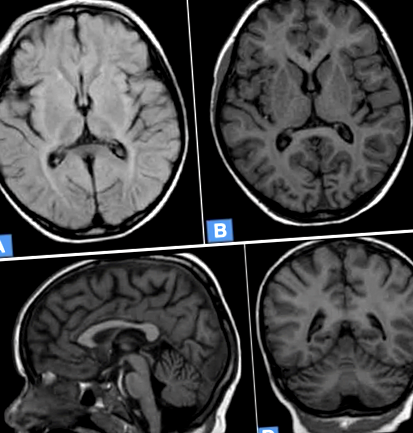
ЯМР (магнитно резонансно изображение) разкрива корова атрофия, перивентрикуларна левкопатия на двете полукълба на мозъка и атрофия на малкия мозък (фиг. 1).
Мозъчен ЯМР на 5-годишно момиче с NCL7. а. Дифузна корова атрофия, увеличена интензивност на MR сигнала в перивентрикуларно бяло вещество. Аксиално T2 претеглено изображение FLAIR. б. Дифузна кортикална и подкорова атрофия на мозъка. Аксиално T1 претеглено изображение. ° С. Атрофия на малкия мозък, кортикална атрофия на мозъка. Претеглено изображение на Sagittal T1. д. Дифузна кортикална и подкорова атрофия на мозъка, атрофия на малкия мозък. Предно претеглено изображение T1
ЕКГ (електрокардиография) показа силна синусова брадиаритмия. Пулсът беше 48–84 удара в минута.
В болницата тя получи лечение с антиконвулсанти: топирамат (100 mg/ден) и леветирацетам (1200 mg/ден).
MFSD8 вариант, идентифициран чрез секвениране на екзома, е потвърден от секвенцията на Сангер.
Дискусия и заключения
В тази статия описахме случай на 5-годишно момиче с двигателно и психическо влошаване, прогресивна загуба на зрение, стереотипи, миоклонус и епилепсия. Заболяването е имало Rett-подобно начало (психомоторна регресия, стереотипни движения на ръцете). Следователно, преди клиничното секвениране на екзома синдромът на Rett беше изключен чрез анализ на MeCP2. Също така е извършен анализ на честите мутации и биохимични индекси за няколко заболявания: аминоацидопатии, органична ацидурия, NCL1, NCL2, бета-окислителни нарушения на митохондриалните мастни киселини, MELAS (митохондриална енцефалопатия, лактатна ацидоза и подобни на инсулт епизоди), MERRF синдром (миоклонична епилепсия) с парцаливи червени влакна), NARP (невропатия, атаксия и пигментозен ретинит). Всички резултати бяха отрицателни.
Секвенирането на екзома разкри хомозиготен c.525 T> Вариант в екзон 6 на MFSD8 (NM_152778.2). Този вариант води до преждевременен стоп кодон (p.Cys175Ter). Тази хомозиготна мутация е потвърдена чрез секвениране на Сангер (фиг. 2).
Електрофореграма от секвенция на Сангер на пробанда, показваща хомозиготната c.525 T> Промяна в екзон 6 на MFSD8, което предсказва промяна в p.Cys175Ter
Тази мутация не се отчита при 60 706 субекта в ExAC [34] или при 2535 субекта в 1000 Genomes Browser [32]. Тази мутация не е намерена в нашите 2000 собствени доходи.
Откритият вариант беше предвиден да бъде патогенен. Този вариант засяга 175 аа протеин в трансмембранната спирала. Този безсмислен вариант може да доведе до пресечен протеин, който е нефункционален или води до разграждане на иРНК чрез медиирано от безсмислие разпадане [40].
Тази мутация не е описана по-рано, но хомозиготни или съставни хетерозиготни мутации в този ген са свързани с цероидна липофусциноза. Към днешна дата, 38 мутации в MFSD8 са описани по-рано, като повечето от тях са хомозиготни мисенс мутации [5, 11]. Тези мутации водят предимно до болест NCL7 - подтип на vLINCL форма. Фенотипите на почти всички засегнати индивиди са много сходни, независимо от типа мутация [41].
Симптомите на болестта NCL7 обикновено започват между 2 и 11 години (средно начало 5 години). Първоначалните характеристики обикновено включват припадъци и загуба на предварително придобити умения. С напредването на заболяването се развива психическа регресия, миоклонус, нарушение на говора, загуба на зрение [15].
MFSD8 ген, който е локализиран в хромозома 4q28.1-q28.2, кодира CLN7, предполагаем лизозомен транспортер с предполагаема топология на 12 трансмембранни домейни, за който е доказано, че е локализиран в лизозомната мембрана и принадлежи към суперсемейството на главния фасилитатор (MFS). Тези протеини са единични полипептидни носители, които са способни да транспортират малки разтворени вещества, като използват хемиосмотични йонни градиенти [42]. Специфични молекули, които MFSD8 транспортира през лизозомната мембрана, не са идентифицирани. Въпреки че този протеин е повсеместно експресиран, са установени високи концентрации на транскрипт в няколко мозъчни места, като мозъчна кора и хипокампус [43].
Въпреки напредъка в диагностиката на невродегенеративни разстройства, NCL остават предизвикателство за педиатричните невролози, тъй като клиничните признаци при малки деца или малки деца са фини и често се припокриват с други вродени невродегенеративни заболявания, като митохондриални разстройства, синдром на Rett или паркинсонизъм с ранно начало. Craiu с колеги заключи, че NCL трябва да се подозира при пациенти с Rett-подобен фенотип в началото и отрицателен MECP2 мутация [15]. Болестта на нашия пациент също е имала Rett-подобни признаци в началото, което е причинило забавяне на диагностиката. Както синдромът на Rett, така и NCL обикновено имат нормално развитие до 9–24-месечна възраст. Пациент в Craiu et al. статията има болест NCL7 с Rett-подобно начало на 18 месеца. Нашият случай има късна проява на 2,5 години, което затрудни диагностицирането. Повишаването на генетичното разбиране на НКЛ доведе до подобряване на диагностичните подходи. Нашето проучване разкри, че ранният офталмологичен преглед на пациенти с двигателна и психическа регресия може да бъде полезен за диагностика.
Въпреки че няма лечение за това състояние, правилната и ранна диагностика е важна за подходящо управление на слабото зрение, образователно планиране и генетично консултиране.
Този доклад описва първия случай на болест NCL7 в Русия. Нашите открития разшириха разнообразието от варианти на MFSD8 и доказана стойност на секвенирането на екзоми за педиатрични НКЛ.
Съкращения
Американски колеж по медицинска генетика и геномика
- Амилорид разрешава устойчиви отоци и хипертония при пациент с нефротичен синдром; случай
- 10 невероятни предимства на седналия руски обрат
- Ръководство за клиницисти Бариатрична хирургия и пациент на ObGyn MDedge ObGyn
- Най-добрата тренировка за вашия тип тяло Списание за пясъчен часовник или извита форма на тялото
- Пенсионер от Дагестан, загубил почти 10 кг за един пробег, разказа за рекорда си - RT на руски